绵羊源荚膜血清D型多杀性巴氏杆菌的生物学特性及2种候选疫苗的免疫效果评价
汪阳,张凌,金映红,汪萍,薛晶,梁芊芊,李晓卓,郑启铭,刘文锴,韩翔舒,夏俊*
(1. 新疆农业大学动物医学学院,新疆 乌鲁木齐 830000;2. 农业农村部草食动物疫病防控重点实验室(部省共建),新疆 乌鲁木齐 830000;3. 新疆畜牧科学院兽医研究所/动物临床医学研究中心,新疆 乌鲁木齐 830000;4. 石河子大学动物科技学院,新疆 石河子 832061)
巴氏杆菌病主要是由多杀性巴氏杆菌(Pasteurellamultocida,Pm)引起的一种人畜共患传染病,具有较高的发病率和死亡率,以肺炎或多脏器出血为主要特征,呈世界性分布,对羊养殖业具有严重危害[1]。根据荚膜多糖抗原的不同将Pm分为A、B、D、E和F 这5种血清型。不同血清型的Pm功能相似,但是其宿主特异性及流行性具有显著差异。PmA常与禽霍乱有关;PmB、PmD和PmE常与猪、牛等动物的败血症或肺炎有关;PmF常与火鸡有关[2]。
Pm引起的巴氏杆菌病常使用抗生素治疗,但是按照农业农村部制定的《全国兽用抗菌药使用减量化行动方案(2021—2025年)》要求,应落实减抗、无抗养殖行动,做到规范科学用药。由于抗生素会引起耐药性、药物残留等生物和食品安全等诸多问题[3],采用预防性和治疗性疫苗才是最为安全有效的防治方法。
灭活疫苗属于传统疫苗,是目前Pm防治常用的免疫疫苗,其制备技术成熟,使用过程安全性高。研究表明,Pm灭活苗具有较高的同源保护效力,但其不同血清型之间的交叉保护力较弱,并且灭活苗通常都需要添加佐剂来刺激机体免疫系统反应[4]。对此,研究者们试图改进Pm疫苗,以消除目前疫苗的缺点。Pm的外膜蛋白(Omps)和菌毛蛋白等的重组疫苗对牛、山羊或小鼠都具有一定的保护作用,其中OmpH以同源三聚体的形式存在于多个血清型,核苷酸序列比对不同血清型之间具有较高的同源性[5]。Muenthaisong等[6]研究显示PmB型重组OmpH通过滴鼻免疫对牛或水牛具有保护能力,并能诱导抗体和细胞介导的免疫反应。Sthitmatee等[7]也证实在禽中OmpH蛋白具有很强的同源性和交叉保护作用。马建伟[8]也证实牛源Pm A型OmpH蛋白对PmA和PmB型的具有交叉保护性。所有的感染动物(牛、禽、猪、兔和羊等)Pm分离株基本都含有OmpH蛋白[9],因此,OmpH蛋白很可能是羊源不同血清型Pm的潜在交叉保护因子。
本研究从绵羊的肺中分离到1株Pm,采用分离鉴定、PCR鉴定、药敏试验等方法初步研究其生物学特性,并制备其灭活疫苗和OmpH重组疫苗,评价不同疫苗的免疫保护性,为新疆地区绵羊巴氏杆菌病的防治提供参考。
1 材料与方法
1.1 样品来源
从新疆某地采集的病死犊羊肺脏,于4 ℃低温环境下运回实验室。PmA-XJ3、PmD-XJ3、PmF-XJ3和Pm未知血清型菌株,均由农业农村部草食动物疫病防控重点实验室(部省共建)保存。
1.2 主要试剂
马丁氏肉汤培养基、白油佐剂、铝盐佐剂、弗氏完全佐剂、弗氏不完全佐剂和BL21感受态细胞,购自于Thermo公司;IPTG、非预染蛋白Marker、预染蛋白Marker、一抗鼠抗His标签抗体、二抗羊抗鼠抗体、聚二乙醇20000(PEG20000)和500 mmol/L咪唑等,购自于生工生物有限公司;PCR相关试剂、DNA分子质量标准和PCR凝胶回收试剂盒,购自天根生化科技有限公司;pET-28a(+)-OmpH重组质粒,由本实验室制备。
1.3 细菌的分离鉴定
无菌条件下取病灶交界处约25 g,划线接种至马丁固体培养基37 ℃培养24 h,同时将其置于马丁肉汤培养基37 ℃ 150 r/min培养24 h。次日,以马丁肉汤培养液(菌液)为模板,同时采用Pm特异性基因(Kmt)和5个荚膜血清型特异基因(hyaD-hyaC、bcbD、dcbF、ecbJ、febD)进行PCR扩增,检测是否含有Pm及其分型,扩增后均采用1%琼脂糖凝胶电泳观察结果。引物信息见表1。

表1 Pm特异性检测引物和5个荚膜血清型鉴定引物信息
将PCR检测阳性菌液划线接种至马丁固体培养基,挑取5~10个菌落,进行PCR扩增,将阳性菌落纯化2次后进行革兰染色镜检,分离纯化的细菌以1∶1置于60%甘油,-20 ℃保存。
1.4 最适培养条件的筛选
将纯化菌株分别接种至马丁肉汤和BHI培养基,分别75 r/min和250 r/min、1%和0.1%接种量条件下37 ℃培养24 h,参考文献[10]的方法测量菌液浓度,绘制生长曲线,筛选纯化菌株的最适培养条件。
1.5 药物敏感性试验
采用纸片扩散法(K-B),检测分离菌对11种临床常见药物(阿米卡星、头孢曲松、氧氟沙星、阿齐霉素、氟苯尼考、头孢他啶、林可霉素、克林霉素、庆大霉素、诺氟沙星、环丙沙星)的敏感性。
1.6 耐药相关基因检测
PCR检测氨基糖苷类耐药基因aadA、aadB,氯霉素类耐药基因floR,四环素类耐药基因tetA、tetB,β-内酰胺类耐药基因blaTEM、blaOXA、blaCTX-M-2、blaSHV、ermA,喹诺酮类耐药基因qnrS、qnrA、qnrB,共13种,引物信息见表2。扩增后均采用1%琼脂糖凝胶电泳,凝胶成像系统观察结果。

表2 耐药相关基因引物信息
1.7 毒力相关基因检测
PCR检测铁离子摄取相关基因exbB、exbD、hgbA、tonB、fur,黏附素相关基因fimA,外膜蛋白相关基因Oma87、OmpH、Psl,SOD相关基因sodA、sodC、tbpA和毒素相关基因toxA,共13种毒力基因,引物信息见表3。扩增后均采用1%琼脂糖凝胶电泳,凝胶成像系统观察结果。

表3 毒力相关基因引物信息
1.8 小鼠致病性试验
按照1.4筛选的最适培养条件复苏保存菌株,活菌计数法及分光光度计测定细菌群落约为1.1×1011CFU/mL。选择新疆医科大学动物试验中心6周龄、体重18~20 g的昆明小鼠20只,分为5组,试验第1、2、3、4组每只腹腔接种2.2×107、2.2×106、2.2×105、2.2×104CFU活菌,另设1组阴性对照组(注射无菌PBS)。每日观察和记录小鼠死亡情况,计算最小致死菌量,同时解剖所有死亡小鼠,取心血进行回归检测。
1.9 灭活疫苗的制备
1.9.1 最佳灭活条件的筛选
按照1.4筛选的最适培养条件对保存菌株进行复苏后,按照1%的接种量接种至5份含有20 mL马丁肉汤的无菌试管中,37 ℃ 75 r/min培养10 h后分别加入菌液总体积的0.1%、0.2%、0.3%、0.4%、0.5%的甲醛进行灭活,充分混匀,37 ℃培养24 h,每隔4 h抽取100 μL菌液涂布于马丁肉汤固体培养基上,37 ℃培养24 h,观察有无细菌生长。
1.9.2 最佳佐剂的筛选
选40只小鼠分为4组,每组10只(雌雄各半)。取1.9.1最佳灭活条件的灭活液,试验第1组为不添加佐剂的甲醛灭活液,第2组为铝盐佐剂和灭活液以1∶5的比例混合的混合液,第3组为白油佐剂和灭活液以1∶1的比例混合的混合液,阴性对照组为无菌PBS。背部皮下分别注射相应制剂400 μL,21 d后每只背部皮下接种2.2×105CFU活菌,每天观察并记录小鼠的死亡情况。
1.9.3 安全性检测
取最适灭活条件和最佳佐剂制备的疫苗液100 μL涂布至马丁固体培养基,37 ℃培养24 h,观察有无细菌生长,并取500 μL腹腔注射小鼠,对照组腹腔注射无菌PBS,观察14 d,记录小鼠有无临床反应,第14天剖检免疫小鼠,观察有无病变情况。
1.10 重组蛋白疫苗的制备
1.10.1 重组蛋白的诱导表达
重组pET-28a(+)-OmpH质粒转移到大肠杆菌感受态BL21(DE3)细胞,42 ℃热激后涂布至含有30 μg/mL卡那霉素的平板上,37 ℃培养8 h,挑取单克隆菌落至液体培养基(30 μg/mL卡那霉素)中培养。当OD600值达到0.6时,加入诱导剂IPTG(0.5 mmol/L),分别于20 ℃过夜培养和37 ℃培养6 h;4 000 r/min离心10 min,弃上清液;沉淀(菌体)用缓冲液A(1×PBS,pH=7.4)悬浮,超声破碎仪完全溶解。离心收集上清液和沉淀,沉淀使用缓冲液B(8 mol/L尿素,50 mmol/L Tris-HCl,pH=8.0的300 mmol/L NaCl)溶解,对上清液和沉淀分别制样并采用SDS-PAGE检测。
1.10.2 蛋白纯化
扩大培养细菌后收集菌体进行亲和纯化。将细胞菌体用缓冲液C (8 mol/L尿素,50 mmol/L Tris-HCl,pH=8.0的300 mmol/L NaCl,pH=8.0的0.1% TritonX-100)溶解,超声破碎,离心收集上清液获得粗蛋白;取5 mL Ni-NTA,5倍柱床体积的结合缓冲液清洗平衡柱;粗蛋白与平衡柱填料孵育1 h并收集流出物;将粗蛋白和流出组分进行SDS-PAGE检测。纯化后的组分透析到蛋白保存缓冲液(50 mmol/L Tris,300 mmol/L NaCl,0.1%十二烷基肌氨酸钠,pH=8.0的2 mmol/L DTT)中,透析后用PEG20000浓缩,0.45 μm滤膜过滤后分装,-80 ℃冻存。
1.10.3 目的蛋白检测
对纯化后的蛋白样品进行处理,制样,12%分离胶,5%浓缩胶跑胶,SDS-PAGE检测目的蛋白的表达。将上述胶进行转印,以鼠抗His标签抗体为一抗,羊抗鼠抗体为二抗进行Western blot分析。
1.10.4 安全性检测
将纯化验证后的蛋白与弗氏完全佐剂按照1∶1的比例进行乳化,乳化后多点注射小鼠300 μL,阴性对照组注射同等剂量的无菌PBS,观察14 d,记录小鼠有无临床症状,第14天剖检免疫小鼠,观察有无病变情况。
1.11 免疫攻毒保护试验
灭活疫苗:准备50只小鼠(雌雄各半),均取最适灭活条件和佐剂制备的疫苗液400 μL进行背部皮下注射,21 d后将小鼠随机分为5组,每组10只。每组分别接种实验室保存菌株PmA-XJ3、PmD-XJ3、PmF-XJ3和Pm未知血清型4.4×105CFU,阴性对照组注射无菌PBS。每天观察记录小鼠的死亡情况。
重组疫苗:准备60只小鼠(雌雄各半),按照600 μg/mL的蛋白浓度,首免以蛋白∶弗氏完全佐剂为1∶1的比例,每只小鼠200 μL的剂量进行背部皮下注射;2周后重复1次;2周后再重复1次。3次免疫后7 d,将小鼠分为a~e组和阴性对照组共6组,每组10只。a~e组分别接种实验室保存菌株PmA-XJ3、PmD-XJ3、PmF-XJ3、Pm未知血清型和本研究分离菌PmD 2.2×105CFU,阴性对照组注射无菌PBS。每天观察记录小鼠的死亡情况。
2 结果
2.1 细菌分离鉴定与培养特性观察
PCR鉴定结果显示,Kmt基因扩增产物大小约为500 bp,D型特异性基因扩增产物大小约为690 bp,与预期片段大小相符(图1)。革兰染色镜检见两端钝圆,呈球状或杆状,单个、成对、短链状排列的革兰阴性菌。由此表明从肺脏中分离到的细菌是PmD。

M.DL2000 DNA Marker;1. Kmt基因;2~6. 依次为A、B、D、E、F型特异性基因;N.空白对照。
2.2 药敏试验
游标卡尺测量抑菌圈直径,结果显示(表4),PmD对阿米卡星、头孢曲松、阿齐霉素、头孢他啶、林可霉素、克林霉素、庆大霉素7种药物耐药,为7重耐药菌。

表4 药敏试验结果
2.3 耐药相关基因检测
分离菌中未检测到氨基糖苷类(aadA、aadB),氯霉素类(floR),四环素类(tetA、tetB),β-内酰胺类(blaTEM、blaOXA、blaCTX-M-2、blaSHV、ermA)和喹诺酮类(qnrS、qnrA、qnrB)耐药基因。
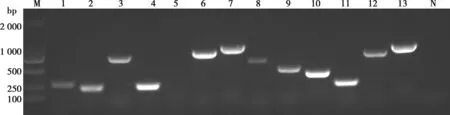
M. DL2000 DNA Marker;1. exbB(283 bp);2. exbD(247 bp);3. hgbA(726 bp);4. tonB(261 bp);5. fur(244 bp);6. fimA(806 bp);7. Oma87(703 bp);8. OmpH(649bp);9. Psl(400 bp);10. sodA(405 bp);11. sodC(249 bp);12. tbpA(728 bp);13. toxA(864 bp)。
2.4 毒力相关基因检测
由图2可见,在分离菌中检测到铁离子摄取相关基因(exbB、exbD、hgbA、tonB),黏附素相关基因(fimA),外膜蛋白相关基因(Oma87、OmpH、Psl),SOD相关基因(sodA、sodC、tbpA),毒素相关基因(toxA),共12种毒力基因。
2.5 最适培养条件筛选
由图3可以看出PmD最佳培养条件为于马丁肉汤培养基,以1%接种量37 ℃ 75 r/min培养16~18 h。
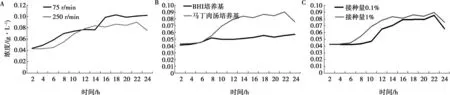
A. 转速;B. 培养基;C. 接种量。
2.6 致病性试验
剖检结果可见,死亡小鼠心脏充血、心包和胸腔积液,肺脏淤血,肝脏肿大、有大量出血点,最小致死菌量为2.2×105CFU,小鼠心血回归检测结果与攻毒菌株一致。
2.7 灭活疫苗的制备
2.7.1 最佳灭活条件的筛选
不同灭活浓度的菌液在24 h后的生长结果显示,0.3%、0.4%、0.5%的灭活液在8 h时就没有菌落生长,因此最佳灭活条件为0.3%的甲醛灭活8 h。
2.7.2 最佳佐剂的筛选
使用不同佐剂的灭活液对小鼠进行攻毒保护试验发现,铝盐佐剂的灭活液对本研究分离菌株PmD的免疫保护率达到80%,免疫保护效果较好(表5),确定铝盐佐剂为最佳佐剂。
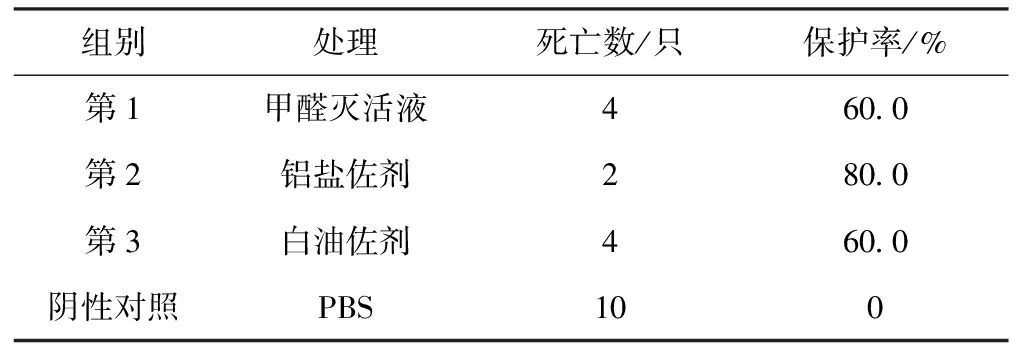
表5 分离菌株PmD最佳佐剂的筛选
2.7.3 灭活疫苗的安全性检测
用疫苗液涂布的马丁固体培养基上无细菌生长,小鼠在14 d内无明显的临床反应,食饮欲均正常,剖检免疫小鼠,小鼠各器官无明显病变。表明灭活疫苗安全性良好。
2.8 重组蛋白疫苗的制备
2.8.1 蛋白表达与纯化检测
蛋白表达结果显示,在20 ℃和37 ℃培养条件下,获得35 ku的目的蛋白条带,该蛋白以包涵体的形式存在(图4A)。蛋白纯化结果显示,500 mmol/L咪唑洗脱组分得到了较纯的目的蛋白(如图4B)。

M.蛋白Marker;1.诱导前总蛋白;2.20 ℃上清液;3.20 ℃沉淀;4.37 ℃上清液;5.37 ℃沉淀;6.上样;7.流出;8.平衡;9~11. 分别为20、50和500 mmol/L咪唑洗脱组分。
2.8.2 融合目的蛋白验证
对融合蛋白进行SDS-PAGE分析,结果显示在理论分子量附近有明显的条带(如图5A),可初步判断融合蛋白纯化成功。用TMB显色试剂盒显色,Western blot结果显示,在相应位置出现1条明显条带(如图5B),表明该蛋白为目的蛋白。
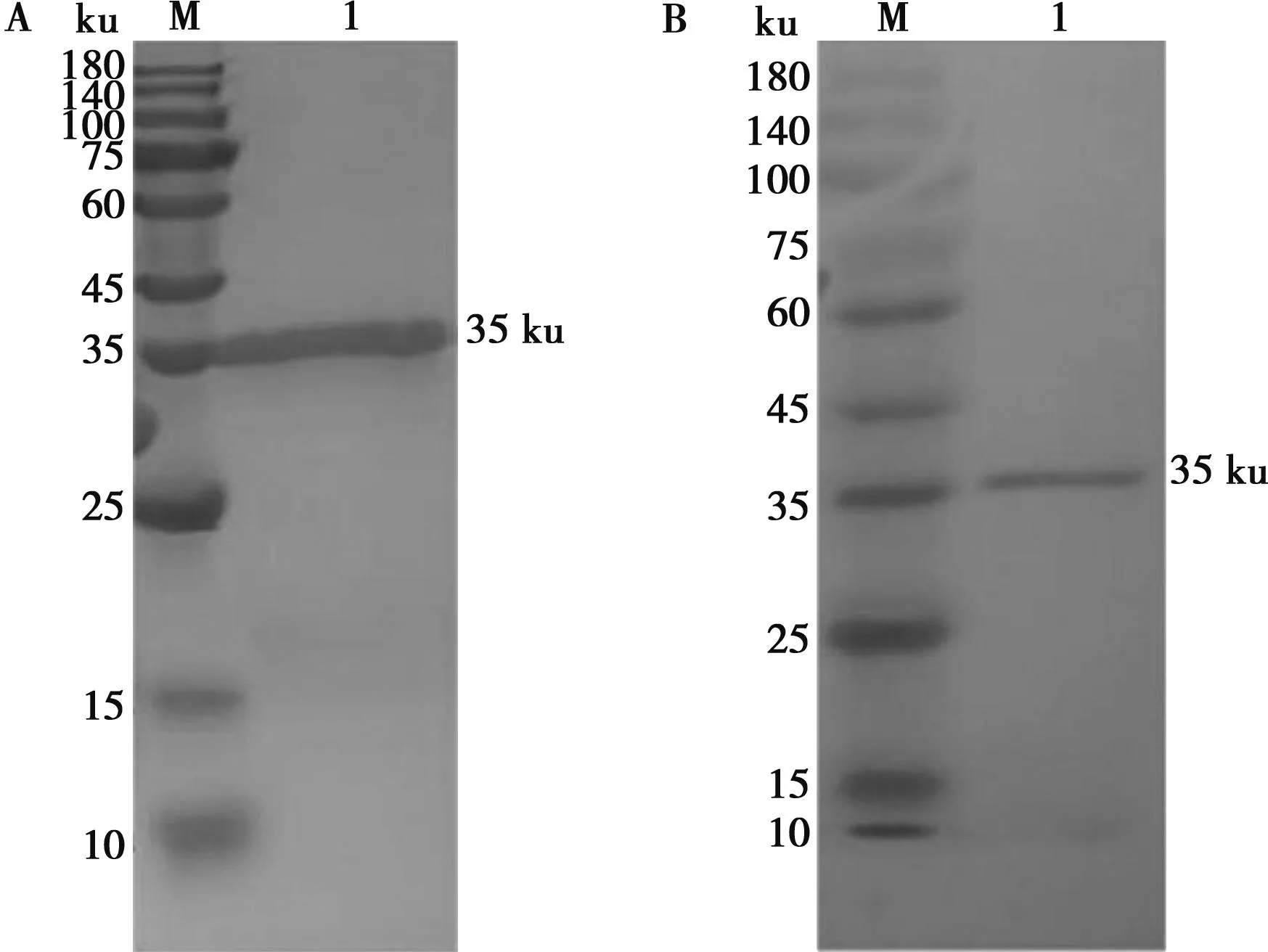
M.蛋白Marker;1.融合目的蛋白。
2.8.3 重组蛋白疫苗的安全性检测
小鼠背部皮下多点注射蛋白疫苗,48 h后注射区域有明显肉芽肿出现,属于接种疫苗后常见的反应,无其他临床症状,食饮欲均正常。第14天进行剖检,脏器无明显病变,表明重组蛋白疫苗安全性良好。
2.9 免疫攻毒保护试验
灭活疫苗免疫攻毒保护试验结果显示(表6),第2组小鼠48 h内死亡2只,其余小鼠均存活,保护率为80%;第1、4组小鼠24 h内全部死亡,保护率为0;第3组小鼠48 h内死亡8只,2只状态良好,保护率为20%;阴性对照组小鼠状态均良好。解剖死亡小鼠,心血培养后进行常规细菌检查,确认与注射菌一致。结果表明,本研究分离菌PmD灭活疫苗对相同血清型Pm的免疫保护效果较好,对不同血清型Pm的免疫保护效果差。

表6 铝盐佐剂灭活疫苗对小鼠的免疫保护效果评价
OmpH重组疫苗对小鼠的免疫保护效果表明(表7):18 h内b组和d组小鼠精神状态良好,a组、c组和e组均死亡2只,其他组精神状态良好;48 h内a组2只死亡,b、e组3只死亡,d组1只死亡;72 h内a组全部死亡,b组3只死亡,c组4只死亡,d组全部死亡;5 d后b组3只死亡,e组4只死亡,c组全部死亡,对照组精神状态良好。解剖死亡小鼠,心血培养后进行常规细菌检查,确认与注射菌一致。结果表明,蛋白疫苗对小鼠的免疫保护效果差,但与灭活疫苗小鼠死亡时间相比,蛋白疫苗可以延迟小鼠的死亡时间,在临床研究中可为患病动物争取治疗时间。

表7 OmpH重组疫苗对小鼠的免疫保护效果评价
3 讨论
羊产业是我国规划在“十四五”期间大力发展的产业。新疆作为我国肉羊生产的主力地区,提高产羔数和保障羔羊存活率是非常重要的。Pm是对羔羊具有严重危害的病原微生物,本研究从病死羔羊肺脏中分离到1株强毒力PmD菌株,该菌具有7重耐药性,与张继红[11]研究的结果相似。分离菌株未检测到耐药基因,与耐药表型的结果不一致,王子杰等[12]分析Pm和溶血性曼氏杆菌(Mh)的耐药性,发现Pm和Mh均对青霉素耐药,但并未检测到相关耐药基因;王镭[13]的研究表明,PmA和PmD菌株均对多种药物耐药,但耐药基因与耐药表型并不能完全吻合。这表明Pm菌株对某种抗生素的耐药是由多种机制共同作用的结果,由多种因素决定,如外界环境的诱导、耐药基因的突变等[14]。由于我国羊肉的消费类型从成年羊转向羔羊[15],羔羊肉抗生素易残留又是目前非常严峻的食品安全问题,因此,对该菌的控制不能再单纯地依赖于抗生素。Pm疫苗则是避免严重疾病发生的最佳途径,也可避免生物和食品安全问题。
灭活疫苗因其制备技术成熟,使用过程安全性高,是目前Pm防控最常用的疫苗种类之一。但是迄今为止,Pm商品化疫苗仅具有针对猪、牛、兔和禽的灭活疫苗,目前暂无用于羊的任何类型商品化疫苗。因此,本研究制备了PmD灭活疫苗,其对同血清型菌株(PmD)的保护率达到80%,对异型菌株的保护率较低,这与Odugbo等[16]的研究结果一致,说明Pm的交叉保护率较低。
由于Pm不同血清型间具有一些同源性较高的保护因子,因此,本研究进一步研究了OmpH新型重组蛋白疫苗,即采用羊源Pm OmpH蛋白制备重组蛋白疫苗,结果显示其保护率极低,仅对PmD型菌株有10%的保护率,这与其他源OmpH重组蛋白疫苗的结果相差较大[5-8]。但是也发现该疫苗能延缓小鼠的发病和死亡时间,这与杨成凯[17]研究的猪源Pm OmpH重组蛋白疫苗的研究结果一致。OmpH重组蛋白疫苗保护率较低的主要原因可能是重组蛋白也需要佐剂的辅助,不同的佐剂能够非特异性地增强或改变机体对抗原的免疫应答,对免疫原本身的影响较大;其次可能是OmpH通过原核表达后极易形成包涵体,其复性后对蛋白的功能产生了一定的影响,具体原因还有待进一步研究。
4 结论
本研究从犊羊的肺中分离到1株强毒力的PmD菌株,该菌具有7重耐药,提示对羊场进行日常治疗Pm感染时应谨慎使用抗生素。本研究评价了由PmD菌株制备的灭活疫苗与OmpH重组蛋白疫苗的免疫保护性,提示使用PmD灭活疫苗对同血清型菌株的免疫保护效果较好,对不同血清型的Pm交叉保护性较差,而OmpH重组蛋白疫苗对各种血清型菌株保护效果均不理想,因此,对于羊多杀性巴氏杆菌病的防控还需进一步研究多价疫苗和新型疫苗。

