阪崎克罗诺杆菌双抗夹心酶联免疫吸附检测方法的建立
张欣,王福成,韩先干,祁克宗,宋祥军,董雨豪,蒋蔚*
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 南京农业大学动物医学院,江苏 南京 210095;3. 安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036)
阪崎克罗诺杆菌(Cronobactersakazakii)是一种隶属于肠杆菌科的革兰阴性菌[1],曾被称为黄色阴沟杆菌,后更名为阪崎克罗诺杆菌,并设立新属克罗诺杆菌属,该属包括阪崎克罗诺杆菌(C.sakazakii)、丙二酸克罗诺杆菌(C.malonaticus)、苏黎世克罗诺杆菌(C.turicensis)、广泛克罗诺杆菌(C.universalis)、莫氏克罗诺杆菌(C.muytjensii)、康帝蒙提克罗诺杆菌(C.condimenti)和都柏林克罗诺杆菌(C.dublinensis)这7个种[2]。阪崎克罗诺杆菌作为一种重要的食源性致病菌,广泛存在于植物、食品加工原料及环境中,被列为婴幼儿配方奶粉A类致病菌[3]。2002年,阪崎克罗诺杆菌被列为“某种严重危及某些人群生命并遗留终身严重后遗症的病原体”[4]。由于该菌对高温和渗透压具有较强的抵抗能力,因此在奶粉的加工、放置、冲调等过程中可大量存活,容易感染婴幼儿,特别是免疫力低下的人群,引起脑膜脑炎、梗死性结肠炎[5],甚至引起成人的骨髓炎菌血症和恶性肿瘤,幸存者留有神经系统后遗症,严重者有致死可能[6]。正是由于阪崎克罗诺杆菌具有较强致病性,使得该菌成为全世界范围的研究热点。
目前阪崎克罗诺杆菌的检测方法主要是传统细菌培养法,但存在检测周期长、试验步骤繁琐等缺点,因此,建立便捷、准确且灵敏度高的检测方法尤为重要。目前常用的分子生物学检测手段以PCR[7]和环介导等温扩增技术[8]等为主,虽灵敏度高,但存在引物设计复杂,对试验操作技能要求较高,且需要昂贵的设备等问题。双抗体夹心酶联免疫吸附(double antibody sandwich enzyme-linked immunosorbent assay,DAS-ELISA)是基于免疫学分析技术建立的快速检测方法[9],将已知抗体包被于固相载体,待测抗原结合后,再加入检测抗体,形成单抗原同时结合双抗体的“夹心”结构,从而特异性检测抗原。该法无需昂贵复杂的设备,且具有快速便捷、特异性强等优点,因此被广泛应用在病毒和细菌大批量快速检测中[10]。
本研究首先制备阪崎克罗诺杆菌效价高、特异性强的单克隆抗体,在此基础上建立双抗夹心ELISA的检测方法,以期满足阪崎克罗诺杆菌免疫学检测的不同需求。
1 材料与方法
1.1 菌株和试剂
阪崎克罗诺杆菌CICC21552、CICC21561、CICC21550,广泛克罗诺杆菌CICC21570,莫氏克罗诺杆CICC23943,苏黎士克罗诺杆菌CICC24178,丙二酸克罗诺杆菌CICC21551,都柏林克罗诺杆菌CICC21564,单核细胞增生李斯特菌(Listeriamonocytogenes)CICC21662购买自中国工业微生物菌种保藏管理中心。铜绿假单胞菌(Pseudomonasaeruginosa)ATCC9027和金黄色葡萄球菌ATCC6538购买自美国模式培养物集存库(ATCC)。阪崎克罗诺杆菌CMCC1.6765购买自中国医学细菌保藏管理中心。大肠杆菌(Escherichiacoli)O157:H7,副溶血弧菌(Vibrioparahaemolyticus)SH112和鼠伤寒沙门氏菌(Salmonellatyphimurium)SL14028由本实验室保存。
SP2/0缺陷型骨髓瘤细胞由本实验室保存;4~6周龄昆明小鼠和BALB/c小鼠购自上海杰思捷生物有限公司;辣根过氧化物酶(HRP)标记二抗购买自Abcam公司;抗体亚型鉴定试剂盒购买自Southern Biotech公司。
1.2 阪崎克罗诺杆菌抗体的制备
1.2.1 免疫及血清效价的测定
阪崎克罗诺杆菌标准株在37 ℃震荡培养至对数生长期,PBS梯度稀释,平板计数法进行活菌计数。等量混合4株阪崎克罗诺杆菌标准株,用终浓度为0.3%的甲醛灭活,用无菌生理盐水调整浓度为1.0×1010CFU/mL。首次免疫选用等量弗氏完全佐剂进行完全乳化,足垫注射BALB/c小鼠。间隔2周后进行再次免疫,此时细菌用等量不完全佐剂进行乳化,皮下多点注射。四免后间隔1周,将小鼠断尾采血检测效价。选择血清效价在1∶32 000以上的小鼠,取脾细胞准备进行细胞融合,融合前3 d,用无菌生理盐水调整菌液浓度为5×109CFU/mL,对小鼠进行腹腔加强免疫。将该阪崎克罗诺杆菌标准菌株按照上述同样的免疫程序免疫新西兰白兔,第4次免疫后,耳源静脉采血并收集血清,利用间接ELISA检测方法测定效价,同时设置阴性对照(健康家兔血清)。测定免疫兔血清OD450值(P)和阴性对照OD450值(N),P/N≥2.1判定为阳性。
1.2.2 细胞融合及单克隆抗体腹水的制备、效价和单抗亚型测定
无菌分离小鼠脾脏并收集脾淋巴细胞,与骨髓瘤SP2/0细胞进行融合及阳性杂交瘤细胞筛选,并经亚克隆纯化细胞株,扩大培养后经小鼠体内诱生单抗腹水获得抗阪崎克罗诺杆菌单克隆抗体。
阪崎克罗诺杆菌CICC21552灭活后PBS洗3次,经碳酸盐缓冲液重悬,调整菌液浓度至1.0×1010CFU/mL作为抗原包被96孔酶标板,通过间接ELISA方法测定腹水效价,P/N≥2.1判定为阳性。根据抗体亚型鉴定试剂盒说明书要求,测定单抗的亚型。
1.3 双抗夹心ELISA检测方法的建立
抗阪崎克罗诺杆菌兔多抗作为包被抗体(100 μL/孔包被酶标板),4 ℃过夜包被,PBST清洗;每孔加入1%明胶200 μL,37 ℃封闭2 h,PBST清洗;加入检测抗原(阪崎克罗诺杆菌菌液),同时设置阴性对照(非阪崎克罗诺杆菌菌液),37 ℃温育2 h,PBST清洗;加入稀释后的阪崎克罗诺杆菌单克隆抗体,每孔100 μL,37 ℃温育2 h,PBST清洗;加入HRP标记山羊抗鼠二抗,37 ℃温育1 h,PBST清洗;加入TMB底物显色液进行显色,2 mol/L浓硫酸终止反应后使用酶标仪测OD450吸光值,P/N≥2.1可判定为阳性。
1.4 双抗夹心ELISA反应条件的优化
棋盘稀释法确定阪崎克罗诺杆菌抗体最佳包被的稀释度,阪琦克罗诺杆菌兔多抗作为捕获抗体,包被浓度按照1∶1 000、1∶2 000、1∶4 000、1∶8 000的梯度进行稀释。按照上述试验方法进行清洗及封闭,后续加入检测抗原(阪崎克罗诺杆菌菌液浓度为1×107CFU/mL),阪琦克罗诺杆菌单克隆抗体5B9株作为检测抗体,检测浓度按照1∶1 000、1∶2 000、1∶4 000、1∶8 000的梯度进行稀释,同时设置阴性对照,其他步骤参照1.3。选择测定的P/N值最大时,对应的捕获抗体和检测抗体的稀释度为最佳使用浓度。
1.5 阳性判定标准的确定
使用以上建立的双抗夹心ELISA 的检测方法,取8份阴性样品用PBS稀释后,经酶标仪检测OD450吸光值,并计算OD450的平均值(X)以及标准方差(SD),最终得到的阴阳性临界值(X+3SD)。当样本OD450值≥X+3SD时,判定为阳性;当样本OD450值 分别用金黄色葡萄球菌、鼠伤寒沙门菌、副溶血弧菌、铜绿假单胞菌、单核细胞增生李斯特菌和大肠杆菌O157:H7作为检测抗原,调整各菌液的浓度为1×107CFU/mL。测定建立的双抗夹心ELISA方法的特异性,并设置阴性和空白对照(无菌水)。每组设置3个重复,按1.3中的步骤进行检测。 用阪崎克罗诺杆菌标准菌CICC21552作为检测抗原进行梯度稀释(1×108、1×107、1×106、1×105、1×104、1×103、1×102和1×101CFU/mL),测定双抗夹心ELISA检测方法的敏感性。显色结束用酶标仪读取OD450值。当P/N≥2.1时,可认为是该方法的最低检测限。 使用批内差异和批间差异对建立的阪崎克罗诺杆菌双抗夹心ELISA检测方法进行重复性评价。板内变异:取不同浓度的阪崎克罗诺杆菌CICC21552进行测定,每个浓度在同一块酶标板上作4个重复,通过对OD450值进行分析,计算板内变异系数。分别在不用时间段包被酶标板,每板做4个重复,共包被5次,对得到的OD450值进行分析,计算板间变异系数。 2.1.1 杂交瘤细胞株的融合筛选及克隆 分别收集多次免疫后7 d的小鼠血清,测其效价。4免后选择血清效价达到1∶32 000以上的小鼠,收集脾细胞与SP2/0细胞进行融合,在HAT的筛选作用下,融合成功的杂交瘤细胞能够正常生长,当细胞团生长至一定数量时,抽取细胞上清液进行间接ELISA检测,筛选测得OD450值在2.0左右的克隆为阳性克隆株,并连续进行4次亚克隆筛选,最终筛选出4株能稳定分泌高滴度抗体的阳性克隆株,命名为3A6、5B9、AC9和EF12。 2.1.2 单克隆抗体 ELISA效价测定 采用间接 ELISA方法依次检测 4 株单克隆抗体效价。4株细胞株的效价分别为1∶128 000、1∶256 000、1∶32 000和1∶256 000,参照上述血清效价测定方法测定兔血清效价,结果显示抗体效价随着免疫次数的增加明显升高,效价达到1∶128 000(表1)。 表1 杂交瘤细胞株培养上清液抗体效价(OD450值) 2.1.3 单克隆抗体的亚型测定 结果显示,4种抗体的轻链类型皆为Kappa型,单抗细胞株3A6、5B9和2B6重链均为IgG1,细胞株EF12重链为IgG2a(表2)。 表2 单克隆抗体的亚型鉴定(OD450值) 通过棋盘法对捕获抗体和检测抗体稀释比例进行确定,选择阪崎克罗诺杆菌兔多抗作为捕获抗体,阪崎克罗诺杆菌单克隆抗体5B9株作为检测抗体,HRP标记羊抗鼠作为酶标二抗。结果显示(图1),当阪崎克罗诺杆菌兔多抗的稀释倍数为1∶4 000倍,且阪崎克罗诺杆菌单克隆抗体5B9株稀释倍数为1∶1 000倍时的P/N值最大,且阴性值为0.091 8,符合阴性值较小的条件。因此,选择捕获抗体最佳的稀释比例为1∶4 000,检测抗体的最佳稀释比例为1∶1 000。 图1 捕获抗体和检测抗体最佳工作浓度的优化 由表3可见,采用优化以后的阪崎克罗诺杆菌双抗夹心ELISA方法,检测得到的8份阴性抗原的OD450平均值(X)为0.113 7,求得SD为0.015 3,按照公式最终求得的临界值为0.159 6,当样本OD450值≥0.159 6,同时满足P/N≥2.1时,判定为阳性;否则,判定为阴性。 表3 双抗夹心ELISA检测方法阴性样品的OD450值 用上述建立的双抗夹心ELISA方法检测细胞株上清液抗体和腹水抗体,结果表明,抗阪崎克罗诺杆菌单克隆抗体仅能与试验中克罗诺杆菌属的细菌(苏黎士克罗诺杆菌CICC24178、丙二酸克罗诺杆菌CICC21551、莫氏克罗诺杆菌CICC23943、广泛克罗诺杆菌CICC21570、都柏林克罗诺杆菌CICC21564)发生反应,而不能和其他6种常见的食源性细菌(金黄色葡萄球菌、鼠伤寒沙门菌、副溶血弧菌、铜绿假单胞菌、单核细胞增生李斯特菌和大肠杆菌 O157:H7)发生交叉反应(图2)。 图2 双抗体夹心ELISA的特异性 双抗夹心ELISA检测方法的敏感性试验结果表明(表4),该方法最低检测限可以达到1×106CFU/mL(P/N值大于2.1),建立的双抗夹心ELISA标准曲线在1×106~1×108CFU/mL 检测范围内具有线性关系(R2=0.950 7)(图3)。 图3 双抗体夹心ELISA检测方法的最低检测限 表4 双抗夹心ELISA检测方法敏感性确定 2.6.1 板内变异系数 板内变异系数结果显示,板内变异系数最小为4.57%,最大为12.62%,最大值不超过15%,因此具有良好的重复性,结果见表5。 表5 板内变异系数的确定 2.6.2 板间变异系数 板间变异系数结果显示,板间变异系数最小为4.78%,最大为11.14%,最大值不超过15%,因此具有良好的板间重复性,见表6。 表6 板间变异系数的确定 阪崎克罗诺杆菌免疫学检测方法主要有胶体金试纸条[11]、酶联免疫吸附试验、免疫磁珠[12]等,这些检测方法的适用性与所制备抗体的性能密切相关。因此,获得高亲和性和特异性的单克隆抗体对免疫检测方法的建立尤为重要。 国家食品安全标准及进出口乳品检验检疫条例中明确规定,婴儿乳制产品中不得检出阪崎克罗诺杆菌[13]。克罗诺杆菌属包含阪崎克罗诺杆菌等7个种,且均具有致病性。本研究最终筛选出的单克隆抗体对克罗诺杆菌属6个菌种均具有阳性反应,且对其他的食源性致病菌均没有交叉反应,特异性良好,为建立针对阪崎克罗诺杆菌的免疫学检测方法打下良好基础。 基于单抗的免疫检测方法,如免疫胶体金层析法、ELISA、间接免疫荧光检测方法等,已经广泛应用于细胞生物学、微生物学、免疫学等相关临床诊断[14-16]。该免疫学检测方法可以进行定性或定量检测,具有高效,专一性强等优点,已成功用于很多重要致病菌的快速检测,如肺炎克雷伯菌(Klebsiellapneumoniae)[17],沙门菌(Salmonella)[18]和嗜肺军团菌(Legionellapneumophila)[19]等。与Song等[20]和丁铭[21]建立的阪崎克罗诺杆菌免疫检测试纸条法相比,本研究建立的双抗夹心ELISA方法的检测限可达1.0×106CFU/mL,提高了近10倍,具有更高的灵敏性。此外,本研究建立的双抗夹心ELISA检测方法具有良好的特异性,能快速检测阪崎克罗诺杆菌属6个重要的致病性菌种,且不和其他常见的食源性病原菌发生交叉反应,为阪崎克罗诺杆菌的快速检测奠定基础。 综上,本研究建立的阪崎克罗诺杆菌双抗夹心ELISA方法,具有特异性强、检测结果直观、试验操作便捷等优点,且检测成本较低,可在基层检测中使用。该方法的建立为阪崎克罗诺杆菌的免疫学检测提供有力工具,具有极大的应用前景。1.6 双抗夹心ELISA的特异性和灵敏度测定
1.7 双抗夹心ELISA的重复性试验
2 结果
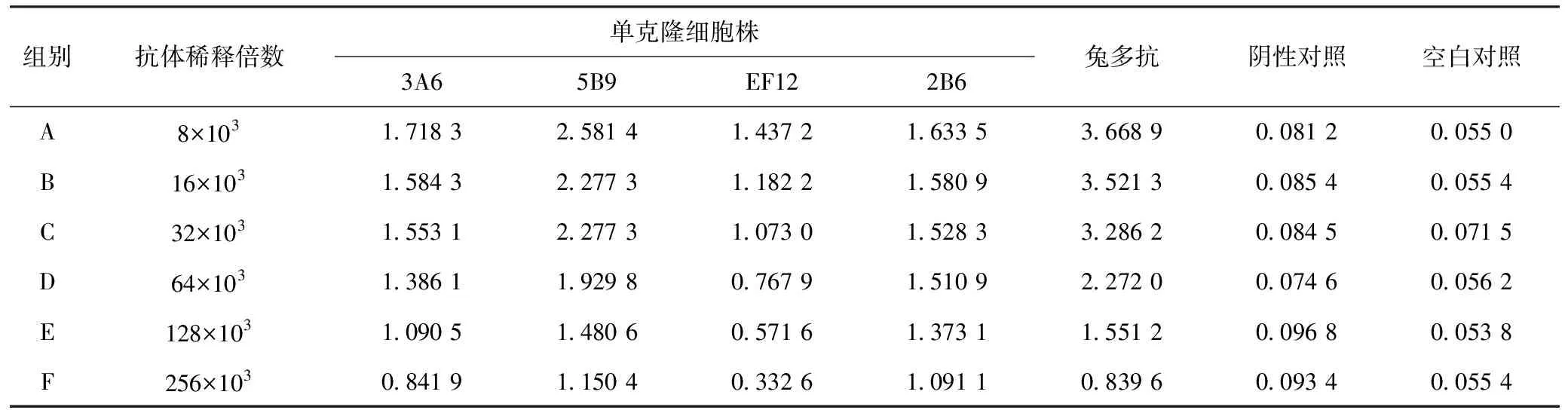
2.1 阪崎克罗诺杆菌单克隆抗体制备

2.2 双抗夹心ELISA方法的建立

2.3 双抗夹心ELISA检测方法阴阳临界值的确定

2.4 双抗夹心ELISA检测方法的特异性

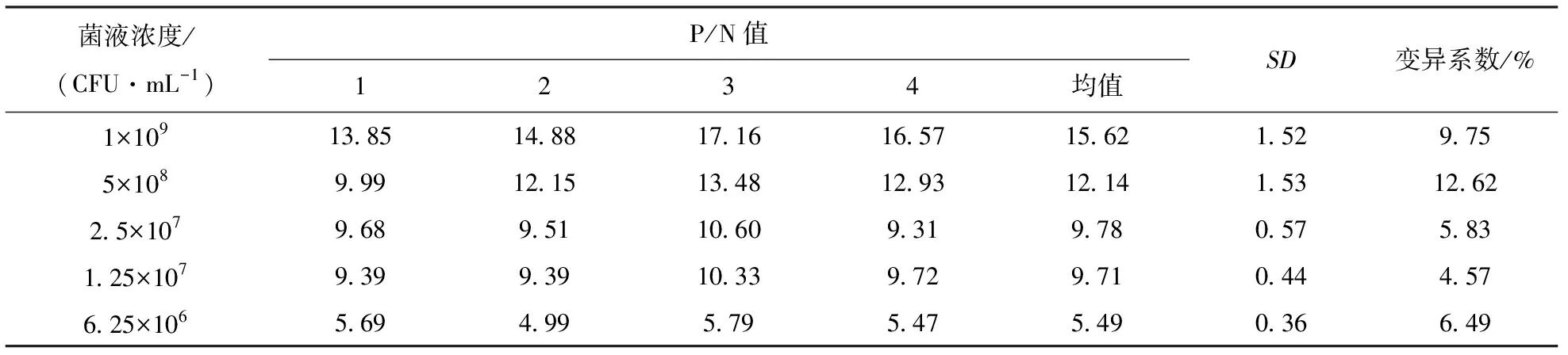
2.5 双抗夹心ELISA检测方法的灵敏度


2.6 重复性试验

3 讨论

