大肠埃希氏菌诱导小鼠乳腺纤维化模型中瘦素及其受体、MMPs和TIMPs表达的研究
高 琼,李晓华,张媛媛,刘雅鑫,陈旭楠,丁玉林,王凤龙*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.兴安盟农牧科学研究所,内蒙古乌兰浩特 137400)
奶牛乳腺炎是乳腺组织受到病原微生物感染或理化因素刺激等发生的炎症反应,据文献报道每年全球奶牛业因乳腺炎造成巨大的经济损失[1]。大肠埃希氏菌(Escherichiacoli)是引起乳腺炎的主要病原之一,其持续感染导致乳腺结构破坏和功能丧失,并最终发展为乳腺纤维化或乳腺硬化。
纤维化原本是组织损伤后一种创伤修复机制,然而在纤维性疾病中表现为创伤修复机制功能障碍,其主要特征是细胞外基质(extracellular matrix,ECM)的过度形成和沉积[2]。ECM产生和降解之间的动态平衡在维持组织稳态中起重要作用[3],基质金属蛋白酶(matrix metalloproteinase,MMPs)及其特异性组织抑制因子被认为是参与维持细胞外基质平衡的主要效应因子,能够降解细胞外基质的不同成分和部分非ECM蛋白,而且还能释放、切割和激活多种生长因子、细胞因子、趋化因子和细胞表面受体,影响多种细胞功能[4]。MMPs在心肌梗死[5]、组织重塑[6]、骨关节炎和癌症等病理条件下已进行了相对系统的研究,其中明胶酶A(MMP-2)和明胶酶B(MMP-9)受到了广泛关注[7],被认为是多种疾病的生物标记物,但在纤维化疾病过程中缺少较为系统的研究。
金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMPs)作为天然内源性组织抑制因子,包括TIMP-1、TIMP-2、TIMP-3和TIMP-4共4种亚型。TIMP可以特异性地与MMP的活性形式结合,形成MMP-TIMP复合物,阻断MMP与底物之间的结合,从而起到抑制MMP活性的作用[4]。在与不平衡的MMP活性相关的病理条件下,TIMP水平的变化显得尤为重要,因为它们可以直接影响MMP活性的水平。
瘦素(Leptin)是一种具有多种生物学功能的细胞因子,具有在胚胎发育、血管生成、免疫、创面愈合等多方面的生理功能。近年来在多种组织器官纤维化过程中均检测到Leptin水平升高,由此引发Leptin与纤维化关系的关注。有研究证实,Leptin可以诱发血管平滑肌及心肌成纤维细胞的增生、肥大[8];参与肝脏、肺和肾间质等纤维化的发生、发展。然而,在乳腺纤维化过程中所起的作用仍鲜有报导。本实验室前期已建立大肠埃希氏菌感染小鼠乳腺纤维化模型,确定了108CFU/mLE.coli为最佳模型建立浓度。本文通过研究小鼠乳腺纤维化模型中Leptin及其受体(Ob-R),以及MMP-2、MMP-9、TIMP-1和TIMP-2的表达及其定位,以探讨其在E.coli诱导的小鼠乳腺纤维化中的相互关系,为奶牛乳腺纤维化发病机理的研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌种 大肠埃希氏菌,由内蒙古农业大学兽医学院病理实验室提供。
1.1.2 实验动物 SPF级Balb/c小鼠,购自斯贝福(北京)生物技术有限公司。
1.1.3 主要试剂 Multisource Total RNAMiniprep Kit,美国AXYGEN公司产品;Prime Script RT reagent Kit、SYBR Premix ExTaqTMⅡ试剂盒,日本TaKaRa公司产品;Leptin、Ob-R、MMP-2、MMP-9、TIMP-1、TIMP-2兔多克隆抗体、山羊抗兔IgG-HRP,Affinity公司产品;AEC显色试剂盒、SDS-PAGE凝胶制备试剂盒,北京索莱宝科技有限公司产品;动物全蛋白提取试剂盒,生工生物工程(上海)股份有限公司产品;BCA蛋白浓度测定试剂盒、ECL蛋白显色试剂盒,美国Thermo公司产品;蛋白预染Marker,北京聚合美公司产品。
1.1.4 主要仪器 组织脱水机(Tissue-TeK®VIPTM5Jr),日本Sakura樱花公司产品;玻片扫描仪器(Axio Scan.Z1),德国Zeiss公司产品;酶标仪(Synergy H4),美国Bio-Tek公司;QuantStudioTM 7 Flex Real-Time PCR System(VIIA7),美国ABI公司产品;电泳仪(1658001),半干转印仪(Trans-Blot®TurboTM),美国伯乐公司产品。
1.2 方法
1.2.1E.coli感染小鼠试验 将处于哺乳期小鼠分为3组,每组50只,分娩日期相隔1~3 d的雌鼠编为同一组。空白对照组小鼠不进行处理,试剂对照组小鼠第4、5对乳腺基底部注射灭菌PBS,每对每侧50 μL;E.coli感染组小鼠第4、5对乳腺组织基底部注射108CFU/mLE.coli,每对每侧50 μL。于感染菌后1、3、7、14、21 d分别采集小鼠乳腺组织,每一时间点各取10只。采集的乳腺组织,一部分在10%中性福尔马林溶液中固定,另一部分置-80℃备用。
1.2.2 免疫组织化学染色检测 采集的小鼠乳腺组织应用常规方法进行脱水、浸蜡、包埋和切片,根据免疫组化试剂盒说明书,将组织切片脱蜡至水,用0.1%胰酶覆盖,放置于温箱修复抗原,3% H2O2处理以消除内源性过氧化物酶活性。用TBST缓冲液洗涤玻片后,分别以兔抗Leptin抗体、Ob-R抗体、MMP-2抗体、MMP-9抗体、TIMP-1抗体、TIMP-2抗体孵育组织4 ℃过夜,部分切片以PBS代替一抗为阴性对照,然后加山羊抗兔HRP-IgG 37℃孵育90 min,AEC试剂显色,光学显微镜下观察。
1.2.3 实时荧光定量PCR检测 根据RNA提取试剂盒说明书,提取各组乳腺组织的总RNA,利用酶标仪测得各组RNA浓度和纯度,参考反转录试剂盒说明书进行cDNA制备,保存于-20 ℃备用。设计β-actin、Leptin、Ob-R、MMP-2、MMP-9、TIMP-1、TIMP-2基因引物序列(见表1),并送至上海捷瑞生物工程有限公司合成。qPCR反应体系参考TB®Premix ExTaqTMⅡ说明书,并于Quant StudioTM 7 Flex Real-Time PCR System仪器进行试验。以β-actin 作为内参基因,检测Leptin、Ob-R、MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA转录水平,试验重复3次。

表1 引物序列
1.2.4 Western blot检测 提取各组小鼠总蛋白,BCA法测定各组蛋白样品浓度;调整蛋白浓度并加入蛋白上样缓冲液,金属浴100 ℃变性5 min后,置于-80 ℃保存;参考Solarbio蛋白凝胶试剂盒说明书操作,配制SDS-PAGE凝胶进行试验,使用相应的抗体孵育,采用ECL显色试剂盒显影拍照。
1.3 数据分析
qPCR结果采用2-ΔCT法分析,蛋白条带通过Image J进行灰度分析,所得数据用Graph Pad Prism8作图,并进行双因素方差分析,P<0.05为差异显著,P<0.01及P<0.001均为差异极显著。
2 结果
2.1 免疫组织化学染色结果
2.1.1 Leptin在小鼠乳腺组织中的表达与分布 对各组小鼠做免疫组织化学染色。箭头所指为阳性颗粒,结果显示,空白组和PBS处理组中小鼠乳腺上皮细胞和少量炎性细胞表达阳性信号(图1A、1B);PBS代替一抗做组内阴性对照,在细胞内未见阳性颗粒(图1C);E.coli感染组中,感染后1 d在部分乳腺腺泡上皮细胞中见到Leptin阳性颗粒,间充质细胞和未退化的脂肪细胞中也见有阳性颗粒(图1D);感染3 d,间质部分浆细胞大量表达阳性颗粒(图1E);感染7 d,间质中部分炎性细胞以及纤维细胞表达阳性颗粒(图1F);感染后14 d,在上皮细胞、间质成纤维细胞和炎性细胞中有大量阳性颗粒表达(图1G);感染21 d,在退化的腺泡附近的上皮细胞、成纤维细胞和炎性细胞中有少量阳性颗粒表达(图1H)。
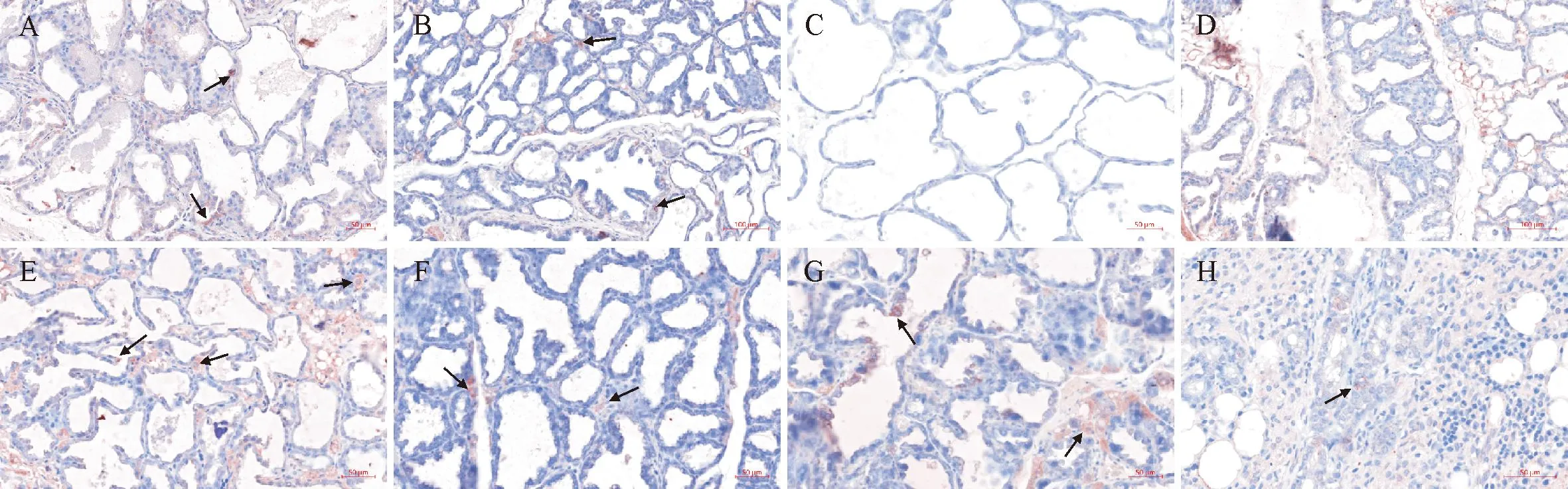
A.空白对照组;B.PBS对照组;C.组内阴性对照组;D~H.E.coli感染后1、3、7、14、21 d乳腺组织。箭头所指为阳性颗粒。
2.1.2 Ob-R在小鼠乳腺组织中的表达与分布 检测瘦素受体在乳腺组织中的分布。箭头所指为阳性颗粒,其结果显示,空白组和PBS对照组均在乳腺上皮细胞表达阳性颗粒(图2A、2B);E.coli感染组中,感染后1 d可在部分上皮细胞观察到阳性颗粒表达(图2D);感染3 d在上皮细胞和炎性细胞中均有阳性颗粒表达(图2E);感染7 d可见间质中纤维细胞、炎性细胞以及部分上皮细胞表达阳性颗粒(图2F);14 d大量上皮细胞和间质中增生的成纤维细胞表达阳性颗粒(图2G);21 d,主要在炎性细胞和成纤维细胞表达阳性颗粒(图2H)。

A.空白对照组;B.PBS对照组;C.组内阴性对照组;D~H.E.coli感染后1、3、7、14、21 d乳腺组织。箭头所指为阳性颗粒。
2.1.3 MMP-2在小鼠乳腺组织中的表达与分布 检测MMP-2的表达与分布。箭头所指为阳性颗粒,结果显示,空白对照组和PBS对照组的导管上皮细胞可见阳性信号表达(图3A、3B);PBS代替一抗做组内阴性对照,在细胞内未见阳性信号(图3C);E.coli感染组1 d,偶见上皮细胞表达强阳性信号,间质中炎性细胞和腺叶间结缔组织中的纤维细胞表达弱的阳性信号(图3D);感染3 d部分上皮细胞表达强阳性信号(图3E);感染7 d上皮细胞表达强阳性信号,间质增宽可见炎性细胞和增生的成纤维细胞表达阳性信号(图3F);14 d部分上皮细胞和间质中成纤维细胞表达阳性信号(图3G);21 d,恢复到静止期的腺泡附近部分上皮细胞,间质中增生的成纤维细胞表达阳性信号(图3H)。

A.空白对照组;B.PBS对照组;C.组内阴性对照组;D~H.E.coli感染后1、3、7、14、21 d乳腺组织。箭头所指为阳性颗粒。
2.1.4 MMP-9在小鼠乳腺组织中的表达与分布 检测MMP-9在小鼠乳腺组织中的表达与分布。箭头所指为阳性颗粒,结果显示,空白对照组和PBS对照组偶见上皮细胞,导管基底部有阳性颗粒表达(图4A、4B);PBS代替一抗做组内阴性对照,在细胞内未见阳性颗粒(图4C);E.coli感染后1 d,偶见上皮细胞有阳性颗粒表达(图4D);感染3 d,间质中成纤维细胞和炎性细胞观察到有阳性颗粒表达,另外在增生的腺泡上皮细胞中有阳性颗粒表达(图4E);感染7 d,偶见间质细胞有阳性颗粒表达(图4F);感染14 d,处于退化过程的腺泡上皮细胞以及间质中成纤维细胞表达阳性颗粒(图4G);感染21 d,阳性颗粒多为间质中成纤维细胞和炎性细胞表达(图4H)。

A.空白对照组;B.PBS对照组;C.组内阴性对照组;D~H.E.coli感染后1、3、7、14、21 d乳腺组织。箭头所指为阳性颗粒。
2.1.5 TIMP-1在小鼠乳腺组织中的表达与分布 检测TIMP-1在小鼠乳腺组织中的表达与分布。箭头所指为阳性颗粒,结果显示,空白对照组和PBS对照组输乳管上皮细胞有阳性颗粒表达(图5A、5B);PBS代替一抗做组内阴性对照,在细胞内未见阳性颗粒(图5C);E.coli感染后1 d在腺上皮细胞和肌上皮细胞均可见阳性信号(图5D);3 d,可见导管和腺泡的上皮细胞均表达阳性颗粒,间质中部分炎性细胞有少量阳性颗粒表达(图5E);感染7 d,主要在间质纤维细胞、成纤维细胞和少量腺上皮细胞表达阳性颗粒(图5F);14 d,可见间充质细胞和炎性细胞大量表达阳性颗粒(图5G);21 d处于退化期的腺泡和泌乳后的腺泡上皮细胞可见有少量阳性颗粒表达(图5H)。

A.空白对照组;B.PBS对照组;C.组内阴性对照组;D~H.E.coli感染后1、3、7、14、21 d乳腺组织。箭头所指为阳性颗粒。
2.1.6 TIMP-2在小鼠乳腺组织中的表达与分布 检测TIMP-2在小鼠乳腺组织中的表达与分布。结果显示,空白对照组和PBS对照组输乳管上皮细胞和炎性细胞有阳性颗粒表达(图6A、6B);PBS代替一抗做组内阴性对照,在细胞内未见阳性颗粒(图6C);E.coli感染后1 d,可见上皮细胞大量表达阳性颗粒(图6D);3 d部分上皮细胞、间质中炎性细胞和成纤维细胞表达阳性颗粒(图6E);7 d,输乳管上皮细胞和周围未发育完全的腺泡上皮细胞表达少量阳性颗粒(图6F);14 d,少量上皮细胞表达阳性颗粒,间质增宽区域可见成纤维细胞表达阳性颗粒(图6G);感染21 d,大量炎性细胞和成纤维细胞中可见表达阳性颗粒(图6H)。
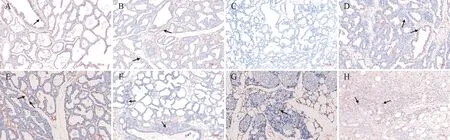
A.空白对照组;B.PBS对照组;C.组内阴性对照组;D~H.E.coli感染后1、3、7、14、21 d乳腺组织。箭头所指为阳性颗粒。
A.空白对照组;B.E.coli感染组;C.PBS组
2.2 Leptin、OB-R mRNA 转录水平及相应蛋白表达结果
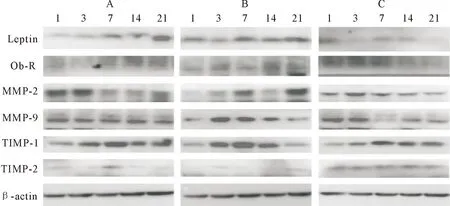
E.coli感染小鼠乳腺组织后,结果显示,感染组小鼠乳腺组织中Leptin mRNA的转录水平极显著高于对照组(P<0.001),感染后1 d、7 d和14 d极显著上升(P<0.001),21 d时Leptin mRNA转录水平回落,与对照组相比,差异不显著(P>0.05),PBS组与对照组比较,感染后1 d和7 d其转录水平极显著上升(P<0.01),3 d显著上升(P<0.05),14 d和第21 d Leptin mRNA转录水平回落,与对照组基本持平,差异不显著(P>0.05)。Ob-R的mRNA转录水平也呈现相似的趋势,感染后1 d、7 d、14 d极显著上升(P<0.001),21 d mRNA转录水平与空白组基本持平,差异不显著(P>0.05),PBS组Ob-R的mRNA转录水平在感染后1 d极显著上升(P<0.001),3 d显著上升(P<0.05),7 d和14 d差异不显著(P>0.05),21 d显著下降(P<0.01)。
Western blot试验检测Leptin蛋白的表达,与空白对照组比较,E.coli感染后1 d其蛋白表达水平极显著上升(P<0.001),3 d和7 d均显著上升(P<0.05),14 d与空白对照组基本持平,差异不显著(P>0.05),21 d极显著下降(P<0.001);PBS处理组处理后1 d与空白对照组比较极显著上升(P<0.001),3 d和7 d差异不显著(P>0.05),14 d显著上升(P<0.05),21 d时极显著下降(P<0.001)。E.coli感染组中Ob-R的蛋白表达水平在处理后期(7~21 d)呈现上升趋势,处理后1 d与空白对照组比较有上升趋势,但差异不显著(P>0.05),3 d表达稍有下调,差异不显著(P>0.05),处理7 d表达再次上升,差异极显著(P<0.01),14 d和21 d持续上升,差异极显著(P<0.001);PBS组在不同时间点均有不同程度上升,处理后1 d差异极显著(P<0.01),3 d、14 d和21 d均差异显著(P<0.01)。
2.3 MMP-2、MMP-9mRNA转录水平及相应蛋白表达结果
MMP-2 mRNA转录水平先上升后下降,在3 d、14 d极显著上升(P<0.001),21 d,虽mRNA转录水平升高,但差异不显著(P>0.05),PBS组处理后1 d MMP-2 mRNA转录水平显著上升(P<0.01),7 d达到峰值,极显著上升(P<0.01),7 d、14 d与对照组基本持平,差异不显著(P>0.05),21 d其转录水平下降,但差异不显著(P>0.05)。MMP-9 mRNA转录水平1 d极显著升高(P<0.001),3 d略下降差异不显著(P>0.05),7 d再上升且差异显著(P<0.05),14 d和21 d MMP-9 mRNA转录水平极显著升高(P<0.001),PBS组MMP-9 mRNA转录水平1 d极显著上升(P<0.01),3 d和7 d显著上升(P<0.05),14 d与对照组基本持平,差异不显著(P>0.05),21 d略下降,差异不显著(P>0.05)。
MMP-2蛋白的表达与其mRNA转录水平基本一致。E.coli感染后1 d显著上升(P<0.05),3 d、7 d、14 d均极显著上升(P<0.01)或(P<0.001),21 d呈现上升峰值,与对照组相比差异极显著(P<0.001);PBS组MMP-2蛋白表达水平1 d和3 d均极显著上升(P<0.001),7 d显著上升(P<0.05),14 d和21 d与对照组基本持平,差异不显著(P<0.05)。MMP-9蛋白表达水平在E.coli感染后1 d未见明显变化,与对照组相比差异不显著(P>0.05),3 d其表达水平极显著上升(P<0.001),7 d其蛋白表达水平与对照组比较基本持平,差异不显著(P>0.05),后期(14~21 d)再次上升,并且均差异极显著(P<0.001);PBS组MMP-9蛋白表达水平1 d和3 d均上升,且差异极显著(P<0.001),7 d和14 d均显著上升(P<0.05),21 d其蛋白表达水平虽升高,但差异不显著(P>0.05)。
2.4 TIMP-1、TIMP-2 mRNA转录水平及相应蛋白表达结果
与空白组比较,TIMP-1 mRNA转录水平1 d表现为下降,但差异不显著(P>0.05),3 d显著性下降,7 d逐渐升高且差异显著(P<0.05),14 d极显著升高(P<0.001),21 d mRNA转录水平回落,与空白组相比无显著性差异(P>0.05),PBS处理组1 d TIMP-1 mRNA转录水平显著上升(P<0.05),3 d和7 d略有上升,差异不显著(P>0.05),14 d再次上升,差异极显著(P<0.01),21 d表现出下降趋势,且差异显著(P<0.05)。TIMP-2的mRNA转录水平在1 d、3 d均表现出极显著下降(P<0.001),7 d稍有上升但差异不显著,14 d、21 d的mRNA转录水平与空白组基本持平无显著性差异(P>0.05),PBS组前期(1~7 d)TIMP-2的mRNA转录水平基本与对照组持平,差异不显著(P>0.05),后期其转录水平略上升,但差异不显著(P>0.05)。
Western blot试验检测各组TIMP-1的蛋白表达水平,整体表达水平与其mRNA转录水平相吻合。感染后1 d其蛋白表达水平极显著上升(P<0.01),3 d其蛋白表达下调,且差异极显著(P<0.01),7 d再次极显著上升(P<0.001),14 d极显著上升(P<0.01),21 d与对照组基本持平,差异不显著(P>0.05);PBS组TIMP-1的蛋白表达水平1 d和3 d均极显著上升(P<0.01),7 d到达上升峰值,差异极显著(P<0.001),14 d仍显著上升(P<0.05),21 d蛋白表达水平虽上升,但差异不显著(P>0.05)。检测TIMP-2的蛋白表达水平,E.coli感染组中TIMP-2的蛋白表达水平在感染前期(1 d~7 d)极显著下降(P<0.001),14 d有所回升,并且差异显著(P<0.05),21 d其表达水平基本与对照组持平,差异不显著(P>0.05),PBS组的TIMP-2的蛋白表达水平在1 d极显著上升(P<0.01),3 d与对照组基本持平,差异不显著(P>0.05),7 d显著下降(P<0.05),之后各时间点与对照组比较,其蛋白表达水平均无显著差异性(P>0.05)。
3 讨论
早在瘦素与纤维化关系的研究中,已有研究表明瘦素在肝纤维化进程中发挥作用。同时大量文献表明瘦素通过促进基质金属蛋白酶和组织抑制因子参与基质重塑[9-10],为研究大肠埃希氏菌感染致乳腺组织发生纤维化过程中Leptin的作用,本试验检测了Leptin及其受体,MMPs和TIMPs的表达水平。
本试验中,小鼠乳腺纤维化模型建立过程中,Leptin在感染前期(1~7 d)mRNA和蛋白表达均不同程度上升,Ob-R的蛋白表达主要在感染后期(14~21 d)上升。免疫组织化学染色结果显示在上皮细胞和炎性细胞观察到Leptin及其受体有明显的阳性颗粒表达,这与Sayed-Ahmed A[11]等人在奶牛乳腺组织腺泡上皮细胞定位到瘦素和瘦素受体的结果相似。Aoki N[12]等人在小鼠中报告的观察结果提到在整个哺乳期,乳腺中的瘦素表达显著低于未怀孕小鼠,这与本试验中观察到哺乳期小鼠瘦素在感染初期(1~7 d)表现出升高的mRNA转录水平和蛋白表达水平形成明显对比。机体针对细菌感染的宿主防御机制是通过先天免疫反应和适应性免疫反应发生的,而一些研究表明[13],瘦素在涉及先天或获得性免疫反应的炎症过程中发挥着相关的作用。由于瘦素具备激素和细胞因子的双重性质,其在感染和炎症过程中表达增加,表明这种脂肪因子是细胞因子网络的一部分,该网络调节炎症/免疫反应和宿主防御机制。另外,Sayed-Ahmed A[11]等人还通过RT-PCR检测了干奶期与泌乳期奶牛乳腺组织中的瘦素表达水平,结果显示两者差异不显著,作者认为其原因是干奶期奶牛乳腺退化,脂肪组织大量增生,从而增加了瘦素蛋白表达。本试验中感染组与对照组相比,小鼠乳腺退化期瘦素蛋白显著下降,结合小鼠乳腺组织Masson染色结果(数据未显示),其乳腺退化期有大量胶原纤维沉积在乳腺间质,脂肪组织含量较少,从而瘦素蛋白表达相对下降,然而瘦素受体在乳腺退化期显著上升的蛋白表达,仍提示了瘦素在乳腺组织的外周作用。
人类和啮齿动物的研究均证实瘦素受体在受损血管壁和动脉粥样硬化斑块中的表达增加[14],瘦素与其受体的相互作用被认为是动脉粥样硬化形成的第一个关键步骤[15]。之前的众多研究显示瘦素有助于ECM重塑和胶原蛋白合成,与其他脏器纤维化密切相关,例如,在心外膜肥胖患者中,发现心肌纤维化生物标志物与血浆瘦素水平呈正相关[16],在HFD诱导的肥胖小鼠中可检测到血浆瘦素水平升高、心脏纤维化加重和心脏胶原表达上调,而喂食HFD的ob/ob小鼠,虽然存在严重肥胖,但观察到这些变化减弱[17]。这些结果都指出瘦素在纤维化过程中的作用。
MMPs长期以来被认为是调节ECM的主要因子,在本研究中,在E.coli感染组和未感染组,MMP-9定位于腺泡和导管上皮细胞的胞浆以及中性粒细胞的胞浆,MMP-2定位于基底肌上皮细胞和腺上皮细胞,表明这些细胞是基质金属蛋白酶的来源。108CFU/mLE.coli感染组中MMP-9大量表达,并且在哺乳中后期腺上皮细胞、成纤维细胞和炎性细胞被MMP-9抗体强烈标记,这与之前的研究中,金黄色葡萄球菌感染引起奶牛乳腺炎观察到的结果类似[18]。有研究表明在小鼠乳腺组织中的MMP-9水平在哺乳期较低,在退化期显著增加[19],这与本试验中未感染组小鼠哺乳期MMP-9的表达基本一致,这些结果提示MMP-9在小鼠乳腺退化过程中可能是必要的,然而本试验中E.coli感染组的MMP-9 mRNA转录水平和蛋白表达水平均显著高于对照组,在整个试验过程中表现为持续升高,MMP-9具有分解IV胶原的能力[4],E.coli感染的乳腺组织持续高表达MMP-9可能加剧组织的损伤。也有研究认为MMP-9的表达是炎症过程中炎性细胞跨基底膜迁移的重要因素,有相关研究表明MMP-9的表达与炎性细胞的募集密切相关,通过介导炎性细胞积聚改变趋化因子和细胞因子活性参与ECM重塑和炎症反应的调节[20]。此外,在肺纤维化模型中,已经报道了MMP-9的促纤维化作用[21]。具体来说,MMP-9激活了潜在的TGF-β1,这是一种强有力的促纤维化介质,使用野生型小鼠与MMP-9-/-小鼠相比,结果显示,MMP-9-/-的小鼠的纤维化程度显著下降。关于肾纤维化,Wang X[22]等在侧输尿管梗阻引起的模型中表明,缺乏MMP-9(Mmp9-/-)的小鼠纤维化水平降低,并伴有肌成纤维细胞的显著下调。这一结果可能表明,MMP-9调节成纤维细胞的活化及其向肌成纤维细胞的分化。
MMP-2在E.coli感染组中的炎性细胞和上皮细胞被强烈标记,qPCR数据显示MMP-2 mRNA转录水平在各时间点上调,但整体差异不显著,其蛋白表达水平在各时间点均显著上升,可能与基质金属蛋白酶不仅在基因水平受到调节外,同时也受到其特异性抑制剂和酶原活性的精细调控有关。Onozuka I[23]等在CCl4和BDL对MMP-2-/-小鼠的研究中,与野生型对照相比敲除小鼠的纤维化程度更高,表明MMP-2具有抗纤维化作用。另外一些研究中认为,为了降解过多的ECM并用正常组织替代纤维化病灶,这一阶段通常称为再上皮化。部分MMPs在此阶段增加其表达以实现组织修复,而最终纤维化组织中MMP-2表达升高,可能是再上皮化失败的结果[24]。
金属蛋白酶组织抑制剂(TIMP)是金属蛋白酶的内源性组织特异性抑制剂,通常TIMPs能抑制所有已知的MMPs,但存在亲和性的差异[4]。根据Beccaria C[18]等在金黄色葡萄球菌感染和未感染奶牛乳腺中的研究,本试验中TIMP-1和TIMP-2在未感染和感染组的乳腺实质和间质结构中均有表达,虽然使用菌种不同,但观察的结果是相符的,表明TIMPs在生理状态下结构性表达,维持与MMPs的平衡状态。qPCR数据显示,感染组中TIMP-1 mRNA转录水平在感染前期略有下调,后期表达升高,Western blot检测其蛋白表达水平,数据显示与mRNA转录水平基本一致。TIMP-2的mRNA转录水平和蛋白表达水平前期极显著下降,后期回升但与未感染组差异不显著。有文献表明在瘢痕组织的形成、肺纤维化[25]等病理状态中,都与导致纤维化的ECM成分过度沉积有关,在这些促纤维化环境中都显示TIMP-1表达水平升高,这表明TIMP-1在限制ECM蛋白水解中的作用。Jamie L[26]在特发性肺纤维化患者循环基质金属蛋白酶和组织金属蛋白酶抑制剂的研究中,除TIMP-2外,所有分析的MMP/TIMP在IPF患者中的水平均显著高于对照组,路军[27]等的研究中,大肠埃希氏菌内毒素LPS诱导平滑肌细胞表达MMP-9和TIMP-1的同时下调了TIMP-2的表达,有文献表明TIMP-2与其特异性底物MMP-2的激活有关,TIMP-2的下调,可能与MMP-2的表达量相关[28]。
本试验中E.coli感染小鼠后,qPCR及Western blot结果显示MMP-2、MMP-9和TIMP-1在不同时间点以不同程度上调其表达,TIMP-2前期(1~7 d)表达水平显著下降,后期逐渐回升(14~21 d)。有研究表明瘦素参与MMPs/TIMPs的调节,如颈动脉粥样硬化斑块的研究中表明瘦素通过瘦素受体/MAPK/ERK信号转导通路,上调血管内皮细胞MMP-9表达,参与ECM重塑[29]。在心脏纤维化的研究中,将心脏成纤维细胞(CFs)与肥胖大鼠心外膜脂肪组织(EAT)条件培养基以及各种抑制剂一起孵育。EAT来源的瘦素通过JAK2/STAT3-ROS-NKA信号通路和JAK2/STAT3-TGF-β1/Smad3信号通路促进肥胖大鼠CFs的增殖,并诱导MMPs/TIMPs失衡,从而刺激CFs中Ⅰ型胶原的上调[30]。这些研究虽然在不同的模型或细胞中进行,但其结果可能同样揭示了瘦素与不平衡的MMPs/TIMPs在小鼠乳腺纤维化过程中的可能作用机制。
本试验中观察到所有检测因子中PBS注射组在前期(1~7 d)内与未处理组比较,均有显著性差异,后期差异不显著。PBS主要含有Na2HPO4、KH2PO4、NaCl和KCl等缓冲成分和盐离子,可能一定范围内改变了泌乳期这一特殊时期的乳腺内环境,从而损伤细胞,触发机体应答机制。
本研究表明,Leptin及其受体表达上调,MMPs/TIMPs表达失衡,最终乳腺发展为纤维化,初步表明Leptin在此过程中发挥了作用。然而,在这种纤维化环境中,瘦素的响应机制以及瘦素与基质金属蛋白酶及其抑制剂的关系仍未阐明,仍需深入研究。

