大肠埃希氏菌噬菌体swi2裂解系统的表达及协同抑菌活性测定
邹 玲,赵天祎,王馨锐,甄建瑜,刘文华,张 灿
(青岛农业大学动物医学院,山东青岛 266109)
噬菌体(phage)以及噬菌体的编码产物作为抗生素替代品应用于耐药菌的防控具有其独特的优势,成为新型抑菌制剂研究的热点[1]。绝大多数噬菌体都是通过穿孔素-裂解酶(holin-lysin)系统裂解细菌,释放子代噬菌体[2]。与其来源的噬菌体相比,裂解酶通常具有更宽的裂解谱,并且不易产生耐受性[3]。研究表明,少数裂解酶具有体外裂解革兰氏阴性菌的天然活性,通过工程化改造也能使裂解酶获得体外裂解革兰氏阴性菌的能力[4-5]。实验室前期分离到1株大肠埃希氏菌噬菌体swi2,其裂解系统含有1个穿孔素(holin)和2个裂解酶(lysin1、lysin2)。与大多数噬菌体裂解系统不同,其holin无菌内裂解活性,而lysin1和lysin2表现出对大肠埃希氏菌的天然菌外裂解活性[6]。为了进一步探究噬菌体swi2的holin在裂解系统中的作用及其与lysin1、lysin2之间是否存在协同抑菌活性,本研究分别将穿孔素和裂解酶基因两两串联,并在大肠埃希氏菌原核系统中分别表达holin-lysin1、holin-lysin2、lysin1-lysin2蛋白,测定其对大肠埃希氏菌的菌内外抑菌活性,明确holin与lysin1、lysin2之间的相互作用,以期为阐明噬菌体swi2裂解机制提供理论支持。
1 材料与方法
1.1 材料
1.1.1 质粒及菌株 质粒pCold-TF、pCold-holin、pCold-lysin1、pCold-lysin2和大肠埃希氏菌DH5α、大肠埃希氏菌BL21均由青岛农业大学微生物实验室保存。
1.1.2 主要试剂 质粒提取试剂盒(FastPure Plasmid Mini Kit),琼脂糖凝胶纯化回收试剂盒(FastPure Gel DNA Extraction Mini Kit),天根生化科技有限公司产品;同源重组试剂盒(ClonExpress Ⅱ One Step Cloning Kit),生物科技股份有限公司产品;蛋白纯化试剂盒(His-Tagged Protein Purification Kit),北京康为世纪生物科技有限公司产品。
1.1.3 主要仪器 超净工作台(SW-CJ-2F),苏净集团安泰公司产品;电热恒温培养箱(HH·B11·360-s),上海跃进医疗器械厂产品;电热恒温水浴锅(HWS-24262812),上海一恒科学仪器有限公司产品;PCR仪(SC46-TP600),宝日医生物技术有限公司产品;凝胶成像仪(K8300),北京科创锐新生物技术有限公司产品;超声波细胞破碎仪(Scientz-IID),宁波新芝生物科技股份有限公司产品;高速冷冻离心机(3-18KS),默克公司产品;蛋白电泳仪(YCZ-25D)北京六一生物科技有限公司产品;恒温振荡培养箱(ZHP100M),扬州三发电子有限公司产品。
1.2 方法
1.2.1 噬菌体holin-lysin裂解系统序列特征分析 根据噬菌体swi2全基因组序列(MT768060)获得其裂解系统中的holin、lysin1、lysin2的序列信息,利用在线分析工具Protparam(https://web.expasy.org/protparam/)分析holin、lysin1、lysin2蛋白的分子量、等电点等基本特征;利用在线分析工具TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)分别对holin、lysin1、lysin2蛋白进行跨膜区预测;利用在线分析工具CD-search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析holin、lysin1、lysin2蛋白的保守功能域。通过以上分析确定噬菌体swi2裂解系统各蛋白的分子特征。同时,分别将 holin、lysin1、lysin2的氨基酸序列提交到GenBank数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对,分别选取数据库中同源性较高的10条序列,在MEGA 5软件中用Neighbor-joining法采用默认参数绘制进化树。
1.2.2 PCR扩增及重组质粒的构建 根据噬菌体swi2的holin、lysin1、lysin2基因序列,设计引物(表1)。以质粒pCold-holin、pCold-lysin1、pCold-lysin2为模板,通过搭桥PCR方法串联holin、lysin1、lysin2基因。为了防止串联表达蛋白分子间的相互干扰,在两个基因之间添加编码15个甘氨酸的序列作为连接序列。PCR反应体系为:模板0.5 μL,上、下游引物各0.5 μL,Premix 10 μL,ddH2O补至20 μL。PCR反应条件为:95℃预变性5 min;94℃变性1 min,54.8℃退火1 min,72℃延伸30 s,共30个循环;72℃延伸5 min。用同源重组试剂盒将扩增得到的PCR产物连接到pCold-TF载体,构建重组质粒pCold-holin-lysin1、pCold-holin-lysin2、pCold-lysin1-lysin2,热激法转化大肠埃希氏菌DH5α感受态细胞,涂布含有Amp(100 μg/μL)的LB平板,于37℃条件下倒置培养过夜。随机挑取平板上生长的单菌落进行PCR鉴定,鉴定正确的质粒送擎科生物科技有限公司测序。

表1 引物序列信息
1.2.3 重组质粒的表达及纯化 鉴定正确的重组质粒pCold-holin-lysin1、pCold-holin-lysin2、pCold-lysin1-lysin2以及实验室保存的质粒pCold-holin、pCold-lysin1、pCold-lysin2、pCold-TF分别用热激法转入大肠埃希氏菌BL21感受态细胞中,涂布于含有Amp(100 μg/μL)的平板,于37℃条件下静置培养过夜。挑取单菌落,加入含有Amp(100 μg/μL)的5 mL LB培养液,于37℃条件下振荡培养至对数生长期。菌液中加入终浓度为0.5 mmol/L 的IPTG,在 16℃条件下过夜诱导重组蛋白的表达。诱导后的菌液12 000 r/min离心2 min,收集菌体沉淀,PBS(pH7.2)重复洗涤3次后重悬菌体沉淀。在冰浴条件下,超声破碎细胞(超声3.0 s,间隙3.0 s)直至菌体悬液澄清,12 000 r/min离心30 min,取上清,获得蛋白粗提液。SDS-PAGE电泳检测holin、lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2蛋白的表达情况,蛋白粗提液用His-镍蛋白纯化试剂盒按照说明书进行纯化。
1.2.4 裂解相关蛋白菌内抑菌活性的测定 将携带holin、lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2、pCold-TF质粒的大肠埃希氏菌BL21菌液分别于37℃振荡培养至对数生长期,加入终浓度为0.5 mmol/L的IPTG,在16℃条件下诱导蛋白表达,分别于0 h、16 h各取200 μL菌液至96孔板上,设3个平行,酶标仪测定每孔的OD600值。各孔取100 μL菌液,分别进行10倍比稀释至适宜浓度,倾注法在NA平板上进行细菌计数。以携带pCold-TF质粒的大肠埃希氏菌 BL21为对照,对各组OD600值的变化及细菌计数的结果进行t检验,比较各蛋白的菌内抑菌活性。根据菌落计数结果,设诱导前的细菌数为N0,诱导后的细菌数设为N1,按照公式(N0-N1)/N0×100%计算各组蛋白的相对抑菌率,通过方差分析确定holin、lysin1、lysin2之间的协同作用。
1.2.5 裂解相关蛋白菌外裂解活性的测定 取增殖至对数期的新鲜大肠埃希氏菌BL21菌液,进行10倍比稀释至105CFU/mL,取100 μL菌液,分别加入等体积的holin、lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2蛋白(0.69 mg/mL)混匀,同时设相同浓度的pCold-TF蛋白为对照,于37℃条件下孵育30 min。各取50 μL混合液,倾注法进行细菌计数,设置3个平行,测定各蛋白的菌外裂解活性。对各组细菌计数结果进行t检验或方差分析,比较各蛋白的菌外裂解活性。根据菌落计数结果,设pCold-TF组的细菌数为Np,各蛋白的细菌数设为N,按照公式(Np-N)/Np×100%计算各组蛋白的相对抑菌率,通过方差分析确定holin、lysin1、lysin2之间的协同作用。
2 结果
2.1 穿孔素及裂解酶特征分析
2.1.1 穿孔素及裂解酶的分子特征 噬菌体swi2的裂解系统包含1个穿孔素和2个裂解酶分子。穿孔素holin(orf49)的分子质量为9 ku;CD-search分析未发现其保守功能域(图1A);TMHMM软件预测其分子存在两个跨膜区(图2),属于Ⅱ型穿孔素[7]。lysin1(orf50)分子质量为17 ku,lysin1具有转糖基酶活性,关键催化活性位点为18位谷氨酸E,糖结合位点位于68-70、73、76-77、98、101、122-125、132位(图1B);未预测到跨膜区的存在。lysin2(orf51)的分子质量为10 ku,其分子无跨膜区,CD-search分析发现,lysin2分子属于裂解酶家族,12-88位为其活性区域(图1C)。
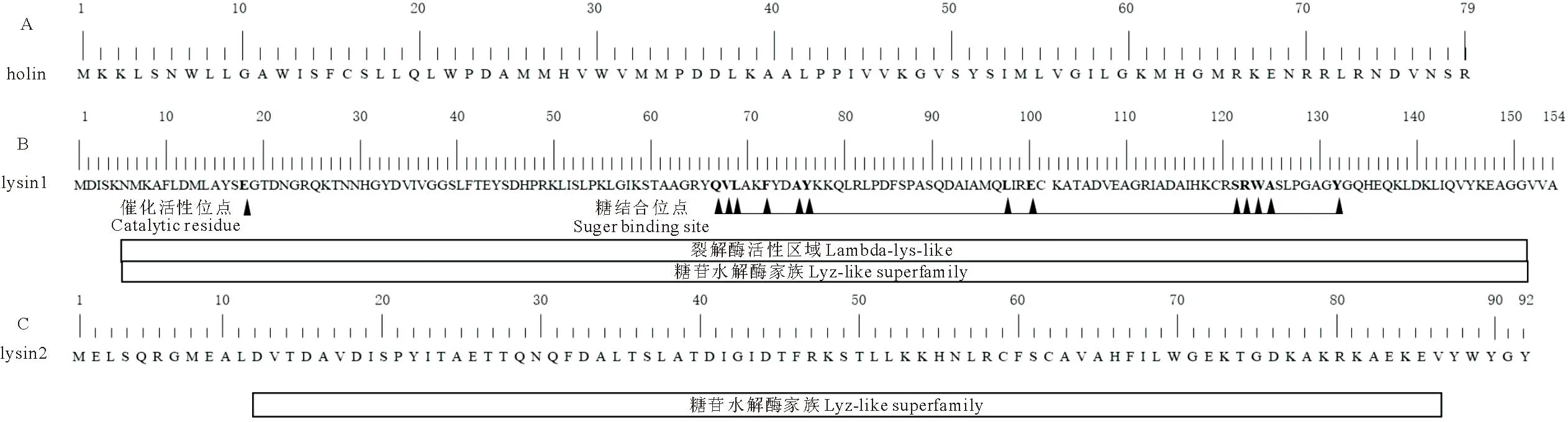
图1 噬菌体swi2裂解系统功能域分析
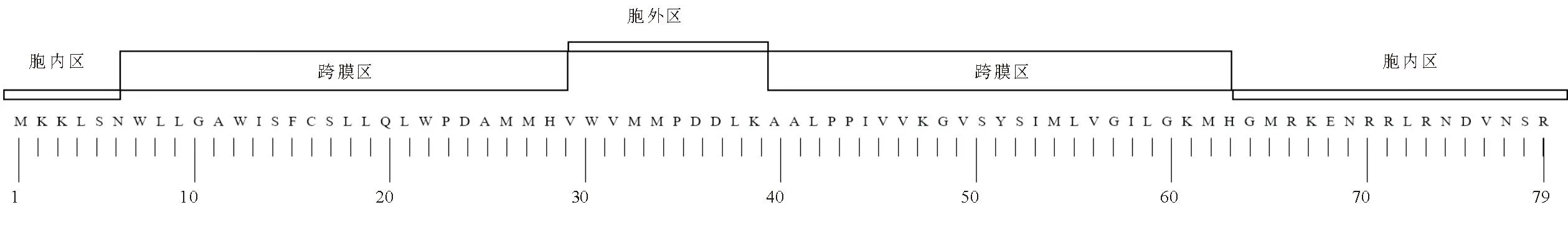
图2 噬菌体swi2裂解系统跨膜区预测
2.1.2 穿孔素及裂解酶的同源性分析 对holin、lysin1、lysin2蛋白进行同源性分析,分别选择数据库中同源性较高的10株噬菌体构建进化树,结果见图3。holin与其中5个噬菌体的同源序列同属一个分支,与沙门氏菌噬菌体vB-Se STGO-35-1的holin(YP010054040.1)序列同源性最高,为97.47%(图3A)。lysin1位于一个独立分支,与沙门氏菌噬菌体Skate裂解酶(YP010053299.1)同源性最高,为97.40%,所有裂解酶均属于糖苷水解酶家族(图3B)。lysin2位于一个独立分支,与沙门氏菌噬菌体裂解酶VB StyS BS5(YP010053933.1)的序列同源性最高,为93.48%,所有裂解酶均属于裂解酶家族(图3C)。

图3 裂解系统同源性分析
2.2 holin-lysin1、holin-lysin2、lysin1-lysin2基因的PCR扩增及重组质粒构建
以噬菌体swi2为模板,用15个甘氨酸作为linker,搭桥PCR扩增holin-lysin1、holin-lysin2、lysin1-lysin2基因,构建重组表达质粒pCold-holin-lysin1、pCold-holin-lysin2、pCold-lysin1-lysin2,进行PCR鉴定,结果见图4。由图4可知,holin-lysin1、holin-lysin2以及lysin1-lysin2分别在大约699 bp、513 bp、738 bp处出现目的条带,与预期片段大小一致。送至擎科生物技术有限公司进行测序,测序结果表明,linker成功两两串联了噬菌体swi2裂解系统各基因。
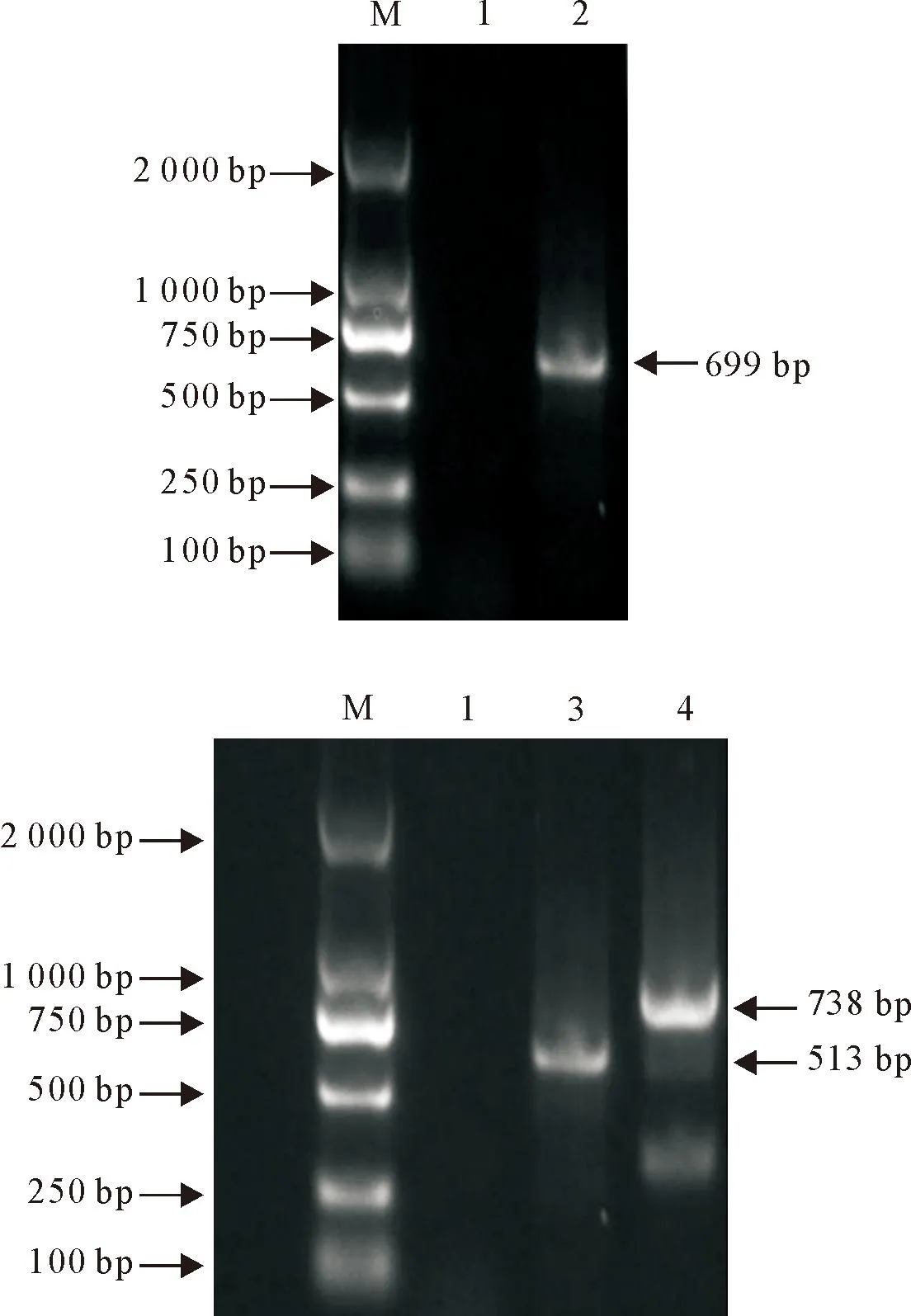
M.DNA标准DL 2 000;1.阴性对照;2.pCold-holin-lysin1;3.pCold-holin-lysin2;4.pCold-lysin1-lysin2
2.3 holin-lysin1、holin-lysin2、lysin1-lysin2蛋白的表达和纯化
携带holin、lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2各基因的重组质粒在大肠埃希氏菌中经IPTG诱导表达,SDS-PAGE电泳检测各重组蛋白的表达情况,结果见图5。holin、lysin1、lysin2蛋白分子质量分别为61 ku、69 ku、62 ku(图5A),holin-lysin1(h-l1)、holin-lysin2(h-l2)、lysin1-lysin2(l1-l2)蛋白分子质量分别为79 ku、72 ku、80 ku(图5B),与预期蛋白大小一致,所有蛋白均实现了可溶性表达,亲和层析法获得了纯化蛋白(图5)。

图5 重组蛋白的SDS-PAGE鉴定
2.4 裂解系统各组分的菌内抑菌活性测定
将携带holin、lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2质粒的大肠埃希氏菌BL21菌液IPTG诱导融合蛋白的表达,同时设未诱导对照。分别于0 h和16 h测定诱导菌液的OD600值,结果见图6。由图6可知,与未诱导的对照组比较,经IPTG诱导后,除holin组外,lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2各组的菌液OD600值均显著下降(P<0.01),因此lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2均具有菌内抑菌活性。

图6 浊度法测定菌内抑菌活性
进一步对各组菌液进行细菌计数,结果见图7(A)。如图7所示,与未诱导的对照组比较,单独的holin未表现出菌内抑菌活性(P>0.05),其余各组蛋白诱导表达16 h后,细菌数量均出现明显下降(P<0.05),与OD600值的测定结果一致,表明lysin1、lysin2、holin-lysin1、holin-lysin2、lysin1-lysin2具有菌内抑菌活性。根据菌落计数结果,计算各组蛋白诱导后的相对抑菌率,结果见图7(B)。如图7所示,与lysin1组比较,holin-lysin1组相对抑菌率略有升高(P>0.05);与单独的lysin1、lysin2组比较,holin-lysin2、lysin1-lysin2组的相对抑菌率显著降低(P<0.05),表明holin与lysin1、lysin2两两联用,均不能提高lysin1、lysin2的菌内抑菌活性,因此,在菌内抑菌活性上,holin lysin1、lysin2之间不存在协同作用。

图7 细菌计数法测定菌内抑菌活性
2.4 holin-lysin1、holin-lysin2、lysin1-lysin2的菌外裂解活性测定
以大肠埃希氏菌BL21为目标菌,通过细菌计数法测定各蛋白的菌外裂解活性,结果见图8(A)。与pCold-TF对照组比较,各组蛋白处理30 min后,lysin2、holin-lysin1处理组的细菌数下降0.5个数量级,lysin1-lysin2细菌数下降一个数量级,lysin1、holin-lysin2处理组的细菌数下降两个数量级,均表现出明显的菌外裂解活性(P<0.01)。
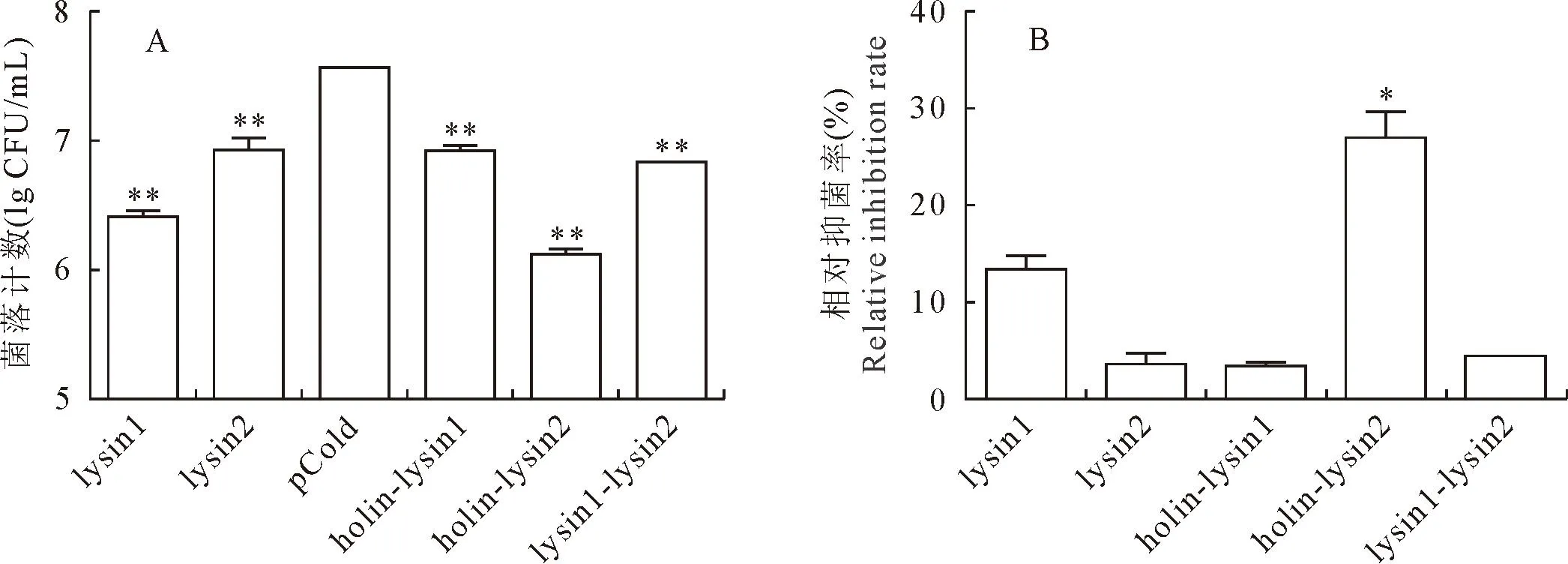
图8 菌外活性测定
根据菌落计数结果,计算各组蛋白的相对抑菌率,结果见图8(B)。如图8所示,与lysin1组比较,holin-lysin1组的相对抑菌率显著降低(P<0.05),lysin1-lysin2组的相对抑菌率与lysin2组无显著差异(P>0.05),因此,holin与lysin1、lysin1与lysin2之间在菌外裂解活性上不存在协同作用;与lysin2组比较,holin-lysin2组相对抑菌率显著升高(P<0.05),表明holin与lysin2之间存在协同作用,可以显著提高lysin2的菌外裂解活性。
3 讨论
在全球范围内细菌耐药性日益严重,研发新型抗菌制剂成为研究的热点,噬菌体及其裂解酶作为抗生素替代品展现出良好的应用潜力[8]。噬菌体是地球上最丰富多样的生物体,其数量约为1030~1031,每天可以裂解50%新增殖细菌,对维持自然界生态系统和菌群平衡至关重要[9]。近年来,噬菌体以其不受耐药性影响、特异性强、无残留、不影响动物体内正常的菌群平衡、能与多种抗生素协同作用等优势,已逐渐应用于医药卫生、动物养殖、环境消毒等多个领域[10-11]。
与抗生素的作用机制截然不同,噬菌体主要通过其裂解系统裂解宿主菌释放子代个体。噬菌体最经典的“holin-lysin”裂解系统至少由穿孔素和裂解酶各一种构成。在子代噬菌体增殖后期,穿孔素形成多聚体在宿主菌内膜上形成穿孔,释放胞内裂解酶至肽聚糖层,发挥水解作用导致细菌裂解[12]。holin可破坏细胞膜,在原核系统诱导表达holin蛋白导致表达菌大量死亡,从而表现出菌内抑菌活性。实验室前期分离到1株大肠埃希氏菌噬菌体swi2,其裂解系统由1个holin和2个lysin1和lysin2组成。然而生物学活性测定发现holin无菌内抑菌活性,反而lysin1和lysin2表现出天然的菌内和菌外裂解活性,这意味着噬菌体swi2可能具有不依赖于穿孔素的裂解机制[6]。为了明确holin在噬菌体swi2裂解宿主菌的过程中的作用,本研究分别将裂解系统的3个关键基因两两串联表达,验证holin和lysin1和lysin2之间的相互作用。抑菌活性测定结果发现噬菌体swi2的裂解系统各组分之间在菌内裂解能力上并无协同作用,holin与lysin1或lysin2联用反而导致裂解酶的菌内抑菌活性降低;由此推测噬菌体swi2裂解宿主菌释放子代过程中,lysin1和lysin2替代了holin的作用,可以直接穿过细菌内膜水解肽聚糖层,从而表现出菌内天然抑菌活性。以上研究充分表明了lysin1和lysin2在噬菌体裂解过程中至关重要,两者之间不存在协同作用,噬菌体swi2的裂解机制及裂解系统中holin的作用有待深入研究。同时,氨基酸序列分析显示lysin1和lysin2分子富含带正电荷/亲水性氨基酸残基[8]。由于革兰氏阴性菌的外膜成分主要为带负电的疏水性脂多糖,裂解酶可以通过其分子本身携带的正电荷和亲水性氨基酸残基与大肠埃希氏菌外膜作用发生去电势效应[13],从而穿过外膜水解肽聚糖层,因此lysin1和lysin2表现出天然的菌外裂解活性。然而,lysin1和lysin2联用并未表现出更高的菌外裂解能力,但是当holin 和lysin2联用时,可以显著提高lysin2的菌外裂解效果,其作用机制尚不明确,有待深入研究。本试验对噬菌体swi2裂解系统中的holin与lysin1和lysin2之间的相互作用开展研究,确定了裂解系统3种关键蛋白的分子特征和酶活特性,并且证实lysin1和lysin2是裂解宿主菌的关键分子,两者之间不存在协同作用,holin仅能够在菌外协同提高lysin2的裂解活性,可为阐明噬菌体swi2的裂解机制提供理论基础。

