鸡毒支原体TaqMan实时荧光定量PCR检测方法的建立
孙 宇,苗立中,程立坤,赵家磊,赵修报,沈志强,王敬茹,李书光*,余 燕
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.河南科技学院动物科技学院,河南新乡 453003;3.山东绿都生物科技有限公司,山东滨州 256600;4.滨城区畜牧兽医服务中心,山东滨州 256600)
鸡毒支原体(Mycoplasmagallisepticum,MG)能引起鸡的慢性呼吸道疾病[1],在鸡有明显的呼吸道症状时病原分离的成功率较高[2]。目前规模化养殖群体密度高[3],鸡群支原体感染造成了巨大的损失。鸡毒支原体感染的诊断方法主要有血清学检测、病原分离鉴定和分子生物学检测[4]。病原分离鉴定过程复杂、成本高、耗时长[5]。血清学鉴定仅可用于疾病的初步筛选[6]。酶联免疫吸附试验(ELISA)[7]和普通PCR检测方法[8]灵敏性比实时荧光定量PCR低[9]。荧光定量PCR检测方法具有快速、灵敏性高、特异性好等优点,该技术已应用于细菌、病毒、衣原体、支原体、寄生虫等多种病原体的检测[10]。论文根据鸡毒支原体的保守基因序列设计特异性引物和探针,建立一种鸡毒支原体TaqMan荧光定量PCR检测方法,为预防鸡毒支原体的感染和明确其流行趋势提供技术支持。
1 材料与方法
1.1 材料
1.1.1 菌种及样品 鸡毒支原体R株(Mycoplasmagallisepticum,MG)、滑液囊支原体(Mycoplasmasynoviae,MS)YBF-MS1株、猪鼻支原体(Mycoplasmahyorhinis,Mhr)WH-C株、绵羊肺炎支原体(Mycoplasmaovipneumoniae,MO)HS2017株、牛支原体(Mycoplasmabovis,M.bovis)PG45株、新城疫病毒(Newcastle disease virus,NDV)、传染性支气管炎病毒(Infectious bronchitis virus,IBV)等菌株均由山东绿都生物科技有限公司保存。临床样品由山东绿都生物科技有限公司收集保存。
1.1.2 主要试剂 Simply P病毒DNA/RNA 提取试剂盒、BioEasy多重荧光qPCR预混液(含UDG)试剂盒,杭州博日生物科技有限公司产品;改良Frey氏培养基,青岛海博生物技术有限公司产品;马血清,天津康源生物技术有限公司产品。
1.1.3 主要仪器 微量分光光度计(Thermo Scientific NanoDrop 2000),美国Thermo Fisher Scientific公司产品;鲲鹏基因荧光定量PCR仪(Archimed X4),鲲鹏基因(北京)科技有限公司产品;电热恒温培养箱(DRP-9272),上海森信实验仪器有限公司产品;生物安全柜(BSC-130ⅡA2),苏州安泰空气技术有限公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中鸡毒支原体 R株的磷酸丙酮酸水合酶基因的基因序列,利用Beacon Designer 7软件设计其引物和探针(表1)。引物和探针均由通用生物(安徽)股份有限公司合成。
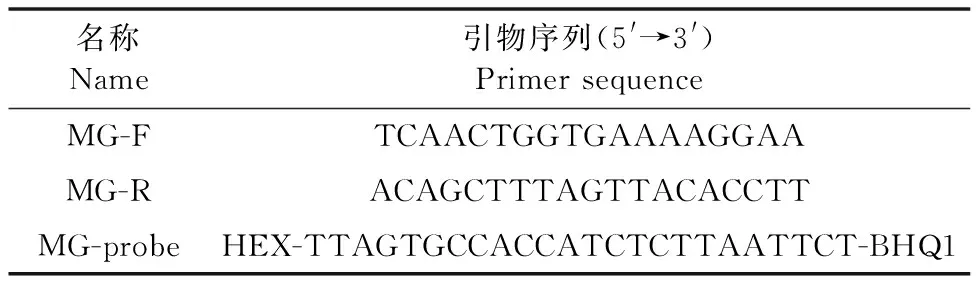
表1 引物及探针序列
1.2.2 鸡毒支原体标准模板的制备 鸡毒支原体冻干菌种接种于改良Frey氏液体培养基,按10%接种量接种于100 mL玻璃瓶,传代3次后用于试验。取200 μL培养后的鸡毒支原体按病毒基因组提取试剂盒说明书提取,洗脱后使用微量分光光度计(OD260/280)测定基因组浓度和纯度并作为标准品,将其稀释后于-20℃保存。
1.2.3 鸡毒支原体荧光PCR反应条件的优化 PCR反应程序:50℃ 5 min;95℃ 2 min,95℃ 15 s,退火温度设置为(45℃、50℃、54℃、57.4℃、60℃)15s,共40个循环,筛选最佳退火温度。将引物和探针分别稀释10 μmol/L、5 μmol/L、2.5 μmol/L进行实时荧光定量PCR。实时荧光定量PCR反应体系20 μL:2×PCR Master Mix 10 μL,上、下游引物各1 μL,阳性模板2 μL,探针0.5 μL,ddH2O 5.5 μL。
1.2.4 建立鸡毒支原体PCR标准曲线 选取1×107copies/μL、1×106copies/μL、1×105copies/μL、1×104copies/μL、1×103copies/μL等5个稀释度作为荧光定量PCR的阳性模板,每个稀释度3个重复,建立标准曲线。
1.2.5 敏感性试验 选取1×104copies/μL、1×103copies/μL、1×102copies/μL、1×101copies/μL、1×100copy/μL等5个稀释度,每个稀释度3个重复;同时设置F:阴性对照。进行荧光定量PCR检测。
1.2.6 特异性试验 选取鸡毒支原体、猪鼻支原体、山羊支原体、牛支原体、滑液囊支原体、新城疫病毒、传染性支气管炎病毒的阳性模板进行荧光定量PCR检测,同时设置H:阴性对照,验证其特异性。
1.2.7 重复性试验 选取1×107copies/μL、1×106copies/μL、1×105copies/μL、1×104copies/μL、1×103copies/μL等5个稀释度作为荧光定量PCR的阳性模板,进行重复性试验并分析其变异率。
1.2.8 临床样品检测 用建立的荧光定量PCR检测方法和文献[11]中普通PCR检测方法对26份临床病料(来源于病鸡组织样品)进行检测并分析。
1.2.9 荧光定量PCR与CCU的相关性检测 将鸡毒支原体传代3次后,将其按10%接种量接种于100 mL玻璃瓶,并于0 h、12 h、18 h、24 h、30 h取样进行荧光定量PCR检测和CCU检测,每个时间点的样品3个重复,并分析两者对应关系。
2 结果
2.1 核酸标准品
鸡毒支原体核酸标准品测得其浓度为65 ng/μL,计算其拷贝数为5.85×107copies/μL,将其稀释为1×107copies/μL~1×100copy/μL。
2.2 反应条件
对荧光定量PCR反应中的退火温度、引物浓度和探针浓度3种条件进行试验优化。结果表明,退火温度50℃、引物浓度为10 μmol/L、探针浓度5 μmol/L时为最优选。优化后荧光定量PCR反应体系20 μL:2×PCR Master Mix 10 μL,上、下游引物各1 μL,阳性模板2 μL,探针0.5 μL,ddH2O 5.5 μL。PCR条件:50℃ 5 min;95℃ 2 min,95℃ 15 s,50℃ 15 s,共 40 个循环。
2.3 标准曲线
选取浓度为1×107~1×103copies/μL核酸标准品作为模板进行荧光定量PCR扩增,获得其标准曲线。标准曲线斜率:-3.646,相关系数R2=0.998,扩增效率为88.056%(图1)。

图1 鸡毒支原体荧光定量PCR标准曲线
2.4 敏感性试验结果
选取浓度为1×104~1×100copy/μL核酸标准品作为模板进行荧光定量PCR扩增,结果显示,荧光定量PCR最低检出浓度为1 copy/μL,阴性对照无扩增,本试验的检测方法灵敏性较高(图2)。

A.104拷贝/μL;B.103拷贝/μL;C.102拷贝/μL;D.101拷贝/μL;E.100 拷贝/μL;F.阴性对照
2.5 特异性试验结果
试验结果表明,鸡毒支原体核酸标准品模板有荧光扩增(图3),其他病原与阴性对照无荧光扩增,表明该方法特异性较好。

A.鸡毒支原体;B.猪鼻支原体;C.绵羊支原体;D.牛支原体;E.滑液囊支原体;F.新城疫病毒;G.传染性支气管炎病毒;H.阴性对照
2.6 重复性试验结果
选取浓度为1×107~1×103copies/μL核酸标准品作为模板进行荧光定量PCR扩增(图4),荧光定量PCR检测结果显示组内和组间CV值均小于3%(表2),结果表明该方法重复性较好。

A.107拷贝/μL;B.106拷贝/μL;C.105拷贝/μL;D.104拷贝/μL;E.103拷贝/μL
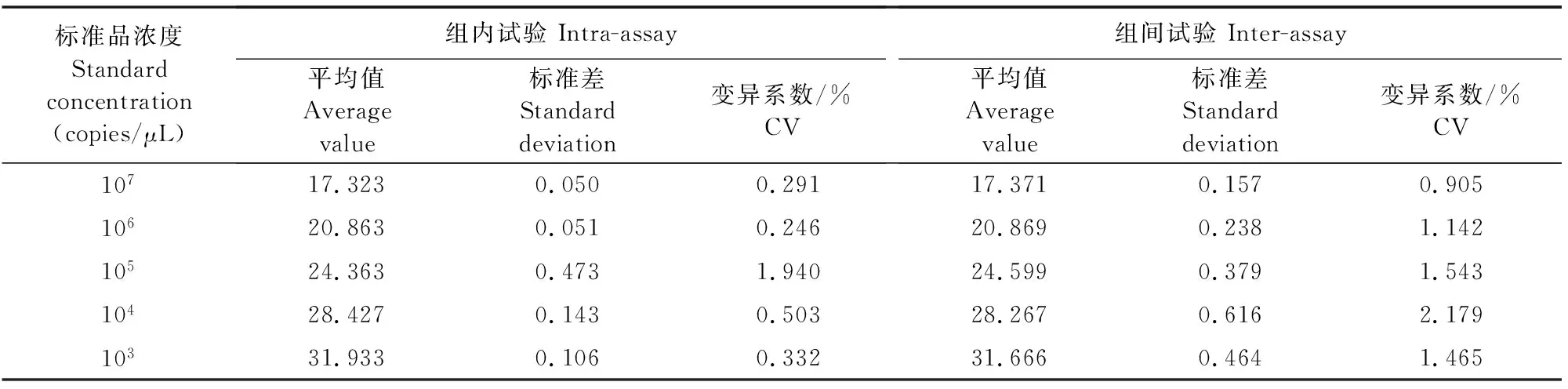
表2 荧光定量PCR重复性试验结果
2.7 临床样品检测结果
对26份疑似呼吸道症状的组织样品进行荧光定量PCR和普通PCR检测,结果显示,荧光定量PCR检测阳性率(30.8%)高于普通PCR检测阳性率(15.4%),二者阳性符合率为100%(4/4),阴性符合率为81.8%(18/22),总符合率为 84.6%(22/26)。结果表明,荧光定量PCR检测方法灵敏性更高(表3)。

表3 临床样品的检测结果
2.8 荧光定量PCR与CCU的相关性检测结果
用TaqMan荧光定量PCR与CCU对接种后任意5个时间点的样品进行定量检测,结果如图5所示。荧光定量PCR与CCU结果显示,在0~18 h,鸡毒支原体处于对数生长期,且两种定量检测方法存在一定的对应关系,在18 h时,鸡毒支原体拷贝数为109.67copies/mL,CCU结果为109;在18~30 h荧光定量PCR检测结果呈下降趋势,在24~30 h CCU检测结果呈下降趋势。
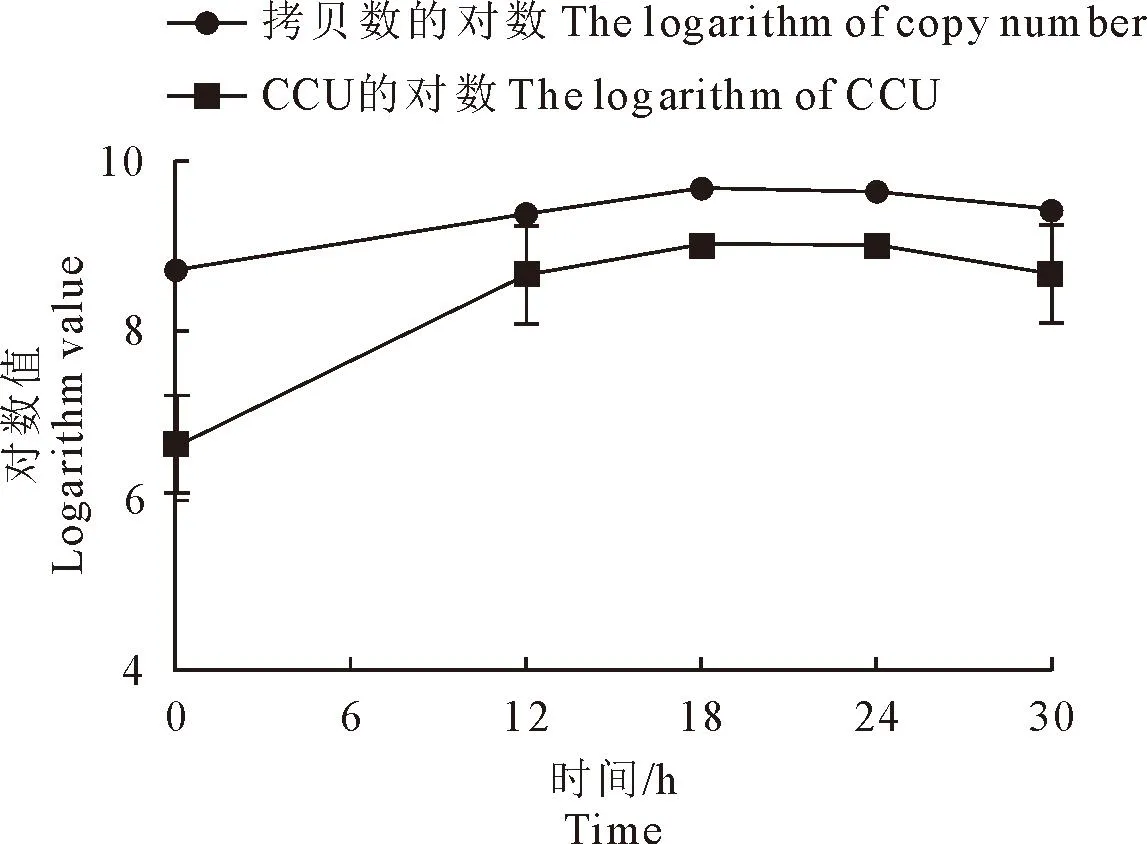
图5 鸡毒支原体生长曲线
3 讨论
鸡毒支原体使养禽业遭受严重的经济损失[12-14]。随着生物技术的发展,更加快速、简便的分子生物学检测方法,如PCR检测、核酸探针技术、荧光定量PCR检测、环介导等温扩增(LAMP)等技术相继被用于支原体的检测。16SrRNA、mgc2、GapA、LP、PvpA基因扩增常用于鸡毒支原体PCR检测。许鹏[15]通过对16SrRNA基因、黏附蛋白PvpA基因和抗原蛋白TM-1基因设计引物进行测试,发现以16SrRNA基因为靶标时检出率最高,但并不能排除非特异性扩增的干扰。高以明等[16]用探针杂交法同时检测鸡毒支原体和滑液囊支原体,虽然此方法成本更低且不需要昂贵的设备,但敏感性低于PCR。罗思思等[17]建立的鸡毒支原体LAMP检测方法对DNA的最小检测限是10 fg/μL,是常规PCR的100倍,此法引物设计较为困难,易受试剂与环境等的污染。荧光定量PCR检测比普通PCR的灵敏性更高、特异性更好,操作简便,是监测鸡群感染情况的重要手段。
本试验建立了鸡毒支原体TaqMan 实时荧光定量 PCR检测方法,与CCU相比将检测时间从7~14 d缩短至1 h左右;本试验最低检出浓度可达1 copy/μL,灵敏性高于已报道的鸡毒支原体荧光定量检测方法[18],可用于鸡毒支原体培养物和组织样品的快速定性定量检测;该方法特异性良好,与其他病原无交叉反应,但临床上存在鸡毒支原体和滑液囊支原体混合感染的情况,双重荧光定量PCR检测方法的应用能够缩短临床检测时间[19];对3次重复性试验进行分析,组内和组间变异系数均小于3%,说明该方法具有良好的重复性。该方法对26份组织样品进行检测,结果表明,荧光定量 PCR检测阳性率(30.8%)高于普通PCR检测阳性率 (15.4%),结果表明鸡毒支原体在山东某养殖场感染率较高。鸡毒支原体培养过程中CCU与荧光定量PCR检测方法之间存在一定的相关性,结果显示,在0~18 h,鸡毒支原体处于对数生长期,在18 h时鸡毒支原体拷贝数为109.67copies/mL,CCU结果为109;在18~30 h荧光定量结果呈下降趋势,24~30 h CCU结果呈下降趋势。试验结果表明这两种定量检测方法在对数生长期存在一定的对应关系。由于CCU检测方法采用10倍稀释法进行检测,最高稀释度为1 CCU/mL,存在检测值低于实际值的问题[20],而荧光定量PCR则是对鸡毒支原体核酸进行检测,较CCU方法更加精确,本试验对两种试验方法进行初步比较,但两种方法的具体联系还需进一步探索。总的来说,实时荧光定量PCR具有检测速度快、灵敏性高、特异性和重复性好的优点,可为鸡毒支原体的预防和检测提供技术支持。

