TGF-β1和Collagen-Ⅲ在牦牛感染细粒棘球蚴肝纤维化中的表达
陈欣怡,严得刚,梁 宏,李菊英,加央次仁,王登云,赵海龙*,唐文强
(1.青海大学医学院基础医学部,青海西宁 810001;2.青海省大通回族土族自治县人民医院,青海大通 810100;3.西藏那曲聂荣县农牧业科学技术服务站,西藏那曲852000;4.西藏自治区农牧科学院畜牧兽医研究所,西藏拉萨 850000)
棘球蚴病(hydatid disease)亦称包虫病,是由于感染棘球属中绦期幼虫(棘球蚴)引起的人兽共患寄生虫病,世界卫生组织(WHO)已将棘球蚴病列为截止到2050年控制或消除的17种被忽视疾病之一[1-3]。目前在中国境内主要分布的是细粒棘球绦虫和泡型棘球绦虫,前者幼虫引起细粒棘球蚴病 (cystic echinococcosis,CE),又称囊性包虫病;后者引起多房棘球蚴病(alveolar echinococcosis,AE),又称泡型包虫病[2-4]。CE对人类健康和畜牧业的发展构成严重威胁[5]。在我国主要流行于西藏、青海及新疆等地区[6-7]。牦牛作为中间宿主,细粒棘球蚴在其肝脏内寄生,压迫周围组织,囊液连续刺激肝组织从而致使肝细胞变性、坏死和纤维化等一系列病理变化,在此过程中释放的毒素进一步损害肝实质,最后导致肝脏功能障碍,不利于牦牛的健康养殖。
肝纤维化(liver fibrosis)是一个复杂的病理变化,肝纤维化主要由于活化的肝星状细胞(hepatic stellate cell,HSC)引发的,HSC通过分泌肝细胞外基质(extracellular matrix,ECM)的增加,同时释放各种细胞因子等物质,与炎症细胞一起构建一种有利于纤维生成环境,而从对肝脏造成伤害[8-9]。转化生长因子β1(transforming growth factor-beta 1,TGF-β1)是关键的促纤维化因子,它能够通过激活肝星状细胞进而促进成纤维细胞的增殖和ECM的分泌,导致肝纤维化的发生[10]。胶原主要来源于成纤维细胞,TGF-β1通过刺激成纤维细胞分泌Ⅲ型胶原(Collagen-Ⅲ),而Ⅲ型胶原在病变肝脏中含量较高,可能与肝纤维化的形成密切相关。
TGF-β1和Collagen-Ⅲ是肝纤维化形成的主要致病因子,在血吸虫和AE引起的肝损伤中报道较多[11]。为研究细粒棘球蚴引起的肝纤维化的形成机制和意义,本研究通过对TGF-β1、Collagen-Ⅲ在肝细粒棘球蚴病组织的表达进行测定和分析,探讨其在肝纤维中形成的意义,为CE引起的肝纤维化的治疗和研究提供参考。
1 材料与方法
1.1 材料
1.1.1 组织和血清 2021年西藏自治区拉萨、墨竹工卡、日喀则和林芝等地利用牧户存储冬储肉宰杀自家草山放养的牦牛,通过肉眼观察牦牛肝脏及血清学鉴定,筛选仅感染细粒棘球蚴的牦牛肝脏组织和血清40份。同时,收集未感染肝组织和血清作为对照。
1.1.2 主要试剂 伊红染液、苏木素、中性树胶、改良天狼星红染色试剂盒,北京索莱宝科技有限公司产品;TGF-β1、Collagen-Ⅲ免疫组化一抗,北京博奥森生物技术有限公司产品;反转录试剂盒,天根生化科技(北京)有限公司产品;牛转化生长因子β1(TGF-β1)酶联免疫吸附试验(ELISA)试剂盒,牛胶原蛋白Ⅲ(Collagen-Ⅲ)ELISA检测试剂盒,江苏酶免实业有限公司产品。
1.1.3 主要仪器 PCR扩增仪,实时荧光定量PCR仪,iMark酶标仪,Bio-Rad公司产品。
1.2 方法
1.2.1 样品处理
(1)血液样本处理:在4℃环境下以3 000 r/min速度离心15 min,保留血清供后续测试。
(2)组织样本处理:将牦牛肝脏组织用10%福尔马林固定,然后通过石蜡包埋后,制成3 μm厚的连续切片,用于HE和天狼猩红染色。
1.2.2 HE及天狼猩红染色 取10%福尔马林固定处理过的肝脏内含病变部分的组织样本以及正常肝脏组织,采用组织切片技术进行脱水、包埋和切片(厚度为3 μm),进行HE染色和天狼猩红染色,在显微镜下观察研究肝组织的病理变化,是否存在肝纤维化,如果存在肝纤维化,评估纤维化的程度并评分。根据纤肝维化程度与检测区域的比值,进行纤维化评分并分级:0(无)、1(轻度:<10%)、2(中度:10%~30%)、3(重度:>30%)[12]。
1.2.3 ELISA检测血清TGF-β1、Collagen-Ⅲ含量 使用牛胶原蛋白Ⅲ(Collagen-Ⅲ)ELISA检测试剂盒和牛转化生长因子β1(TGF-β1)酶联免疫分析(ELISA)试剂盒,测定血清中Collagen-Ⅲ、TGF-β1水平。用酶标仪在450 nm波长下测定吸光度。
1.2.4 免疫组化检测TGF-β1、Collagen-Ⅲ分布 石蜡切片进行梯度脱水,二氨基联苯胺的显色按照两步免疫组化试剂盒的说明进行。在显微镜下随机采集5个视野的图像,并使用ImageJ软件对阳性和阴性染色所占据的面积进行分析。
1.2.5 RT-PCR检测TGF-β1、Collagen-Ⅲ基因mRNA的相对表达水平 从冷冻的肝脏样本中提取总RNA,以RNA为模板转化为cDNA。检测TGF-β1、Collagen-Ⅲ mRNA,利用特异性引物进行RT-PCR。用GAPDH作为内参基因。牦牛的目的基因TGF-β1、Collagen-Ⅲ和内参基因GAPDHmRNA序列来源于GenBank,采用DNAMan软件进行设计引物,引物详情见表1。引物由北京华大基因有限公司合成。

表1 RT-PCR引物信息

2 结果
2.1 感染牦牛肝组织的采集与观察
肉眼观察,感染牦牛肝脏表面可见大小不等的包囊隆起,包囊直径为3.12 cm±2.05 cm。细粒棘球蚴呈白色近球形囊状物,有部分突出于肝表面呈结节状,触之较坚韧,实验室剖检发现肝脏感染细粒棘球蚴的包囊大多呈现炎症感染或钙化状态,囊液多呈赤褐色粘稠脓液状;部分囊内含较疏松豆腐渣样物或较硬石灰质样粗大颗粒,少部分囊液清亮无色。与未感染囊相比,棘球蚴与其周围宿主形成的结缔组织膜粘连紧密,不易剥离。美蓝染液染色囊液镜下观察,无原头蚴,脓液状囊内多见梭形结构小体,结晶物。其内含物内未发现原头蚴,受标本条件限制,未进行动物接种试验。
2.2 肝组织细粒棘球蚴肝纤维化病理观察
2.2.1 HE染色 未感染细粒棘球蚴的牦牛肝组织结构正常,肝小叶结构完整,细胞边界清晰,排列整齐,无细胞变性、坏死及炎症细胞浸润;感染细粒棘球蚴的其囊壁的外围肝组织纤维化,肝小叶结构被破坏,汇管区和肝小叶出现胶原纤维增生和沉积,肝细胞坏死,炎症细胞淋巴细胞浸润,小叶间质纤维增多,肝界板细胞破坏,呈虫蚀状(图1)。
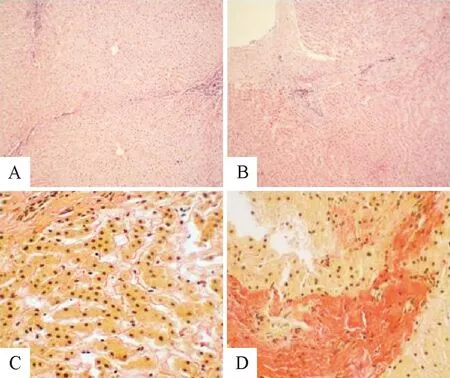
A、B.正常肝脏组织和感染细粒棘球蚴肝脏组织(HE染色10×);C、D.正常肝脏中的纤维组织和感染细粒棘球蚴肝脏中的纤维组织。(天狼猩红染色40×)
2.2.2 天狼猩红染色 纤维被染成红色,感染细粒棘球蚴胶原纤维比未感染明显增多。未感染细粒棘球蚴的牦牛肝组织中的纤维,呈现细小、均匀、排列整齐的特点;感染细粒棘球蚴的肝组织出现组织增生,纤维化,其增生的纤维呈现粗大、杂乱无章、着色较深。细粒棘球蚴感染后肝脏的损害及纤维化多发生在血管周围(图1)。同时,对肝病变组织进行肝纤维化评分(图2)。

图2 天狼猩红染色肝纤维化评分
2.3 TGF-β1、Collagen-Ⅲ在肝组织中的表达水平
感染组和未感染组Collagen-Ⅲ血清水平分别为(2.675±0.5975)μg/L、(1.578±0.0743)μg/L,感染组血清Collagen-Ⅲ含量明显超过了未感染组,其结果差异有统计学意义(P<0.01)(图3)。

与未感染组相比较,**为差异极显著P<0.01
感染组和未感染组血清TGF-β1水平分别为(55.51±7.465)ng/mL、(47.51±6.538)ng/mL(P<0.01),感染组血清TGF-β1水平高于未感染组差异性显著(图4)。

与未感染组相比较,**为差异极显著P<0.01
2.4 TGF-β1、Collagen-Ⅲ在肝组织的分布
TGF-β1在正常肝组织组极少表达,感染组的TGF-β1在肝细胞内表达,阳性表达明显强于正常肝组织组,主要定位于细胞基质,Collagen-Ⅲ在正常肝组织组呈散在分布,感染组的Collagen-Ⅲ在肝细胞内表达,阳性表达明显强于正常肝组织组,主要定位于细胞基质(图5)。

A、C:正常肝组织组;B、D:感染细粒棘球蚴组肝组织
2.5 TGF-β1、Collagen-Ⅲ基因表达水平
TGF-β1、Collagen-Ⅲ基因表达水平的结果如图6所示。TGF-β1和Collagen-Ⅲ基因的mRNA相对表达量相比未感染组升高,差异极显著(P<0.01)。

与未感染组相比较,**为差异显著P<0.01
3 讨论
细粒棘球蚴病属人兽共患寄生虫病,同时危害人类健康和畜牧业的发展。2012-2016年全国棘球蚴调查显示,我国棘球蚴威胁人口达到6 000万,感染家畜高达3 000万只(头),每年新感染牲畜达到700余万只(头),造成很大经济损失[13]。西藏家畜棘球蚴检出率是全国最高的省份,为13.31%;其中牛检出率为9.15%。此次研究标本均采自西藏地区散养的牦牛,牛龄均在6年以上,自然状态下其接触细粒棘球绦虫虫卵机会较多,感染几率较大,细粒棘球蚴感染后,可引起宿主免疫系统的免疫应答的发生,因受各种因素影响,散养牦牛生长周期较长,有肝纤维化的发生时间周期。肝纤维化是细粒棘球蚴慢性感染的主要病变过程,细粒棘球蚴在宿主体内寄生,促进和活化肝星状细胞,从而产生大量胶原纤维,引起细胞外基质的过量积累,从而引起了肝纤维化[14]。肝纤维化危害肝脏的正常机能,如果继续发展可以引起肝硬化,以至肝脏功能衰竭[15]。西藏为我国牦牛主要产地之一,棘球蚴病是牦牛体内常见的寄生虫病,牦牛感染棘球蚴后体重、产肉率、繁殖力、产奶力下降,不利于牦牛健康养殖产业的发展。
TGF-β存在3种类型,分别为TGF-β1、TGF-β2和TGF-β3,近年来研究证明TGF-β1与肝纤维化关系最为密切,是肝纤维化、肝硬化中发展中的主要细胞因子[16]。肝星状细胞、贮脂细胞(FSC)、kupffes细胞、肝窦内皮细胞及肝纤维化附近的炎症细胞均可分泌TGF-β1。关于细胞因子对肝纤维化形成的影响,在人和多房棘球绦虫感染的动物模型报道较多,动物实验研究表明,在肝纤维化形成中期即炎症期,TGF-β1和各型前胶原mRNA水平上升。本研究通过病理组织学、免疫组化、ELISA和RT-PCR对感染细粒棘球蚴牦牛肝组织和血清的研究,分别证实在细粒棘球蚴对宿主的感染中,TGF-β1在细粒棘球蚴感染形成肝纤维化起关键作用。与TGF-β1在多房棘球绦虫和血吸虫感染形成肝纤维化的作用研究结果一致[11,17-18]。Ⅲ型胶原的检测对于肝纤维化的发生发展有一定的临床意义,Ⅲ型胶原主要存在与肝脏的汇管区、小叶中央区,参与网状纤维的组成,是肝纤维化形成后导致器官变硬的主要成分,在肝纤维化发生过程中,其含量明显增多,分布由细小变成粗大的纤维形态。本研究Collagen-Ⅲ在感染细粒棘球蚴牦牛血清呈现高表达,同时肝脏组织中的Collagen-Ⅲ基因mRNA相对表达水平亦呈现高表达。文献报道AE病人肝纤维化主要发生在浸润部位及病灶周围组织,胶原沉积以Ⅲ胶原为主,与本研究一致[19]。
本研究在HE染色中,与通常熟知的寄生虫感染不同之处,在所观察的标本中几乎没有观察到嗜酸性粒细胞,但淋巴细胞在肝细胞周围浸润,证明存在长期的抗原刺激[20]。在天狼猩红染色观察到细粒棘球蚴造成牦牛肝纤维化造成的纤维粗大,杂乱无章,着色较深,以血管为中心所产生,正常肝脏纤维细小、均匀,排列整齐。本研究通过对牦牛血清和患病肝组织的TGF-β1和Collagen-Ⅲ检测,发现细粒棘球蚴感染的肝组织和血清中TGF-β1和Collagen-Ⅲ的表达显著增加,可能与牦牛感染细粒棘球蚴的时间长有关。牦牛感染细粒棘球蚴病体内建立的局部免疫反应的研究报道较少,本研究通过对细粒棘球蚴感染的牦牛肝脏发现在感染期间,TGF-β1和Collagen-Ⅲ的表达升高,可能是与肝纤维化密切相关。结合本实验标本病理特点本研究发现:细粒棘球蚴感染宿主后,因其囊壁较厚且完整,包隔致密,与宿主组织分界清楚易形成免疫逃避。因棘球蚴生长缓慢,寄生时间较长,仍可引起免疫系统的识别、反应,在细胞因子的调控下囊内钙化,棘球蚴死亡,这是一个缓慢的过程,对宿主是有利的一方面。同时,细胞因子参与棘球蚴囊外宿主组织发生纤维化,替代正常组织,形成不可逆的硬化,这对宿主是不利的。在未来的广泛研究的基础上,如果能够预测细胞因子的水平作为肝纤维化诊断的辅助指标,就值得进一步研究其表达水平及其在肝纤维化诊断中的价值。肝纤维化形成影响的研究大多数是在体外细胞培养和动物试验中进行,肝纤维化形成的机制较为复杂,各种细胞因子通过自分泌和旁分泌相互协同作用,形成细胞因子网络调控肝纤维化的发生发展,并非单一细胞因子孤立发挥作用。细胞因子网络对肝纤维化的形成机制和调控有待进一步研究。
综上所述,在细粒棘球蚴感染的过程中,宿主与寄生虫的免疫作用是多方面的,宿主的免疫应答是十分复杂的。TGF-β1和Collagen-Ⅲ是在感染细粒棘球蚴后导致肝纤维化的重要细胞因子,需要进一步的研究它们与肝纤维化之间致病机制和关系,对于早期肝纤维化的诊断和药物治疗方案的制定具有重大作用。

