牛3种妊娠相关糖蛋白可视早孕试剂盒检测效果比较
张传强,鲁 静,张铁柱,王子馨,,赵高平,,温 慧,王景霖,律登元,苏晓凤,祁晓霞,,王丽霞,曹贵方,3,李喜和,,*
(1.内蒙古赛科星家畜种业与繁育生物技术研究院有限公司,内蒙古呼和浩特 011517;2.国家乳业技术创新中心,内蒙古呼和浩特 010080;3.内蒙古农业大学,内蒙古呼和浩特 010018;4.内蒙古大学生命科学学院,内蒙古呼和浩特 010070)
高效繁殖是奶牛终身高产的先决条件[1],及时、准确地开展奶牛妊娠早期诊断,识别未孕牛只,再次开展同期处理和人工授精,可以缩短产犊间隔[2],提高终身产量,增加牧场经营效益。通常,奶牛妊娠早期诊断的直接方法有直肠触诊法、超声诊断法,间接方法有检测孕酮、早期受孕因子(early conception factor,ECF)、妊娠相关糖蛋白(pregnancy associated glycoproteins,PAGs)检测法等。直肠触诊法,最佳时间是51~56 d[3],且受操作者经验等因素影响,该方法也可能是胎儿损失的重要医源性原因[4]。超声诊断法,其检测敏感性分别在青年牛和成母牛的人工授精后26 d和29 d均可以达到100%[5],也有报道奶牛的敏感性在35 d时才能达到 100%[6],但是该方法存在购买仪器设备的投资过高问题。孕酮测试法,缺点是孕酮属脂溶性物质,其含量随采样方法和时间不同有较大差异,判断标准很难确定,至今未得到广泛推广[7]。ECF特异性仅达50%左右,且同一头牛反复测试的结果尚不一致,也不足以作为妊娠检测物质[8]。
妊娠特异性蛋白B(pregnancy specific protein B,PSPB)是1982年在牛胎盘中发现的妊娠特异性蛋白[9-11],PAG是在牛子叶中发现的妊娠相关糖蛋白[12],妊娠血清糖蛋白60(pregnancy serum proteins 60,PSP60)是依据分子量命名的妊娠血清糖蛋白[13,14],有人将三者统称为PAGs[12,15-17]。PAGs属于天冬氨酸蛋白酶家族[18],牛的PAGs家族约有 21 个成员,它们由滋养外胚层的单核及双核细胞分泌[19]。虽然这些成员的氨基酸序列、分子量大小有所不同,但均在妊娠期间表现出一系列的时间和空间表达模式[19]。奶牛人工授精后,未怀孕牛血液中PAGs含量维持在较低水平;而怀孕牛的PAGs含量在人工授精后25 d开始升高,27 d显著高于未孕牛只[20]。水牛在人工授精后23 d时,怀孕牛显著高于未怀孕牛,以后持续增加直至妊娠结束[21]。PSPB在人工授精后22 d就显著高于未孕牛只[20],也随着妊娠进程逐渐升高,至产前2 d达到峰值,分娩后开始下降[10]。PSP60从人工授精后27 d开始呈上升趋势,最后2周达峰值,一直持续到妊娠结束[13]。总之,PAGs在妊娠初期被分泌到母体外周循环中,其分泌量随妊娠的进展而逐渐增多,分娩前达到峰值,分娩后下降。通过检测PAGs作为判断牛的妊娠的标准具有较高的灵敏性和特异性[14,22]。因此,可以将PAGs视为是成熟的妊娠标志物[23]。通过开展PAGs可视试剂盒检测奶牛妊娠状态,具有可现场操作、步骤简单、快速得到结果等优点。
尽管国内大型牧场普遍利用超声诊断法开展妊娠检查,但是受经费情况、操作人员技术成熟度等条件限制,不依赖专业技术、不依赖人工经验的妊娠检查方法显得格外重要。虽然牛PAGs可视早孕检测试剂盒在国外已上市多年,具有操作简单、快速等优点,但是存在准确性不能达到100%、准确性判定依据模糊等问题,导致使用者存在疑虑,推广范围不大。因此,有必要开展准确性分析,更有必要比较国产试剂盒的效果。
本研究针对牛3种PAGs可视早孕检测试剂盒开展对比研究,分析检测准确性、对比各试剂盒的异同,以期为奶牛繁殖行业标准化提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 选取2021年2月至2021年9月期间,华北地区、东北地区等10个牧场,人工授精后27~34 d(人工授精当天记为0 d)的荷斯坦奶牛369头。
1.1.2 主要试剂 纽勤(NEOGEN)奶牛快速目视孕检试剂盒,爱德士(IDEXX)快速可视孕检试剂盒,易瑞生物早孕28 d快速检测试剂盒。出于商业机密要求,试验过程并不出现厂家名称,仅标记为试剂盒1、2、3,且不与以上顺序一致。
1.1.3 主要仪器 智能兽用B型超声诊断仪,法国卡苏Easi-Scan公司产品;200 μL移液器,Eppendorf公司产品。
1.2 方法
1.2.1 采集血液 利用一次性使用真空采血管采集牛尾根静脉血液5 mL,采血管上记录牛号,记录簿上同时记录牛号和采血管号。10 min内带到牧场适宜之处进行可视早孕诊断试剂盒妊娠检测。
1.2.2 牛PAGs可视早孕检测试剂盒检测步骤 第一步,加样孵育:首先对包被板的加样孔进行检测编号、标记,将检测编号和牛号一一对应。吸取血液样品100 μL,添加到包被板孔中。所有样品添加完毕后再添加标准品,用封口膜密封,轻轻振动混匀,室温下孵育10 min。第二步,检测反应:孵育结束后,取下封口膜,添加检测缓冲液50 μL,封口,轻轻振动混匀,室温下孵育10 min,纯净水洗4次。第三步,增强反应:加入增强试剂(即酶标抗体)100 μL,封口,轻轻振动混匀,室温下孵育10 min,纯净水洗4次。第四步,显色反应:增强反应结束后,每孔加入底物试剂100 μL,室温反应10 min。第五步,终止反应:每孔加入100 μL终止液;第六步,结果判定:将每孔的颜色与标准品的颜色对比,颜色同于/深于怀孕标准品颜色者为“怀孕”,颜色同于/浅于未怀孕标准品颜色者为“未孕”,颜色介于怀孕/未怀孕标准品之间的颜色者“需要重新检测”。3种不同厂家早孕诊断试剂盒操作步骤基本一致,所添加试剂量略有不同,不再赘述。
1.2.3 超声诊断确认 在人工授精后第30天~第42天,由牧场繁育人员进行B型超声检查确认试剂盒的检测结果,以超声图像见到胚胎为怀孕确认,并以此作为检验早孕检测试剂盒的特异性和灵敏性。
1.2.4 数据分析 采用SPSS22.0软件对试剂盒的妊娠诊断结果与B型超声诊断结果数据,进行显著性分析。卡方值小于0.05水平的卡方值,差异不显著。反之,差异显著。
2 结果
2.1 牛3种PAGs可视早孕试剂盒检测结果与B型超声诊断的显著性分析
试剂盒1检测的160头牛中,有129头怀孕,31头未孕/需要重新检测;以上牛只经B型超声诊断,有134头怀孕,26头未孕。经检验,卡方值为0.34,小于0.05水平下的3.84临界值,说明试剂盒1与B型超声诊断无显著性差异。试剂盒2检测的85头牛中,有78头怀孕,7头未孕/需要重新检测;以上牛只经B型超声诊断,有79头怀孕,6头未孕。经检验,卡方值为0,小于0.05水平下的3.84临界值,说明试剂盒2也与B型超声诊断无显著性差异。试剂盒3检测的124头牛中,有91头怀孕,33头未孕需要重新检测;以上牛只经B型超声诊断,有88头怀孕,36头未孕。经检验,卡方值为0.08,小于0.05水平下的3.84临界值,说明试剂盒3同样与B型超声诊断无显著性差异。
2.2 牛3种PAGs可视早孕试剂盒需重新检测情况对比分析
牛PAGs可视早孕试剂盒由于自有特征的原因,其检测结果有 “怀孕”或“未孕”或“需要重新检测” 3种类型,这不同于超声诊断。若出现“需要重新检测”的牛头数较多/比例较高时,会增加牧场的检测成本。3种试剂盒“需要重新检测”的结果如表1所示。

表1 试剂盒检测结果中需重新检测头数情况
由表1可知,3种试剂盒需要重新检测的比例分别为10.00%、5.88%、7.25%。其中,试剂盒1需要重新检测的比例居3种试剂盒中之首、试剂盒3居中、试剂盒2最低。即生产应用中,牧场对3种试剂盒投资比例高低依次为:试剂盒1>试剂盒3>试剂盒2。
2.3 牛3种PAGs可视早孕试剂盒检测特异性对比分析
尽早检出“未孕”牛只可以减少空怀天数,降低饲养成本,尽早启动新一轮同期发情流程。而同期发情流程中通常使用前列腺素,具有一定的致流产风险。因此,100%准确地判断“未孕”及其重要。为了更详细地剖析试剂盒对“未孕”的检准程度,本研究从整体和细分角度研判了试剂盒的“未孕”结果与超声诊断的一致性、变化规律,结果如表2和图1所示。

图1 3种早孕诊断试剂盒检测未孕与超声诊断一致性

表2 试剂盒的未孕检测结果与超声诊断的一致性
由表2可知,试剂盒1检测未孕的15头牛只中,有4头经超声检测为怀孕,该试剂盒检测“未孕”的一致性仅为73.33%。如果牧场按照试剂盒1的检测结果执行新的同期流程,必将会导致26.67%的母牛流产。非但不为牧场带来效益,反而会造成新的、更大损失。由图1可知上述情况主要分布第30 d之前,说明在30 d之前试剂盒1检测特异性不足,据此作为判定结果,会给牧场带来经济损失。但是,从31 d开始每天的特异性均为100%,表明试剂盒1只有在31 d以后才达到检测特异性100%准确,而31 d前的检测特异性还有待确认。
试剂盒2、3自27 d开始,检测未孕的结果均与超声检测的结果一致,一致性达100%,即试剂盒2、3的检测特异性从27 d开始就为100%,不存在误检,牧场可以根据此检测结果执行新的同期流程。此外,此两款试剂盒还可以将准确识别未孕的时间提前至人工授精后的27 d,意味该试剂盒可以减少空怀天数,缩短产犊间隔。
2.4 牛3种PAGs可视早孕试剂盒检测灵敏性对比分析
同2.3一样,试剂盒的“怀孕”结果与超声诊断的一致性和变化规律,本研究也是从整体和细分角度分别了进行研判,结果如表3和图2所示。
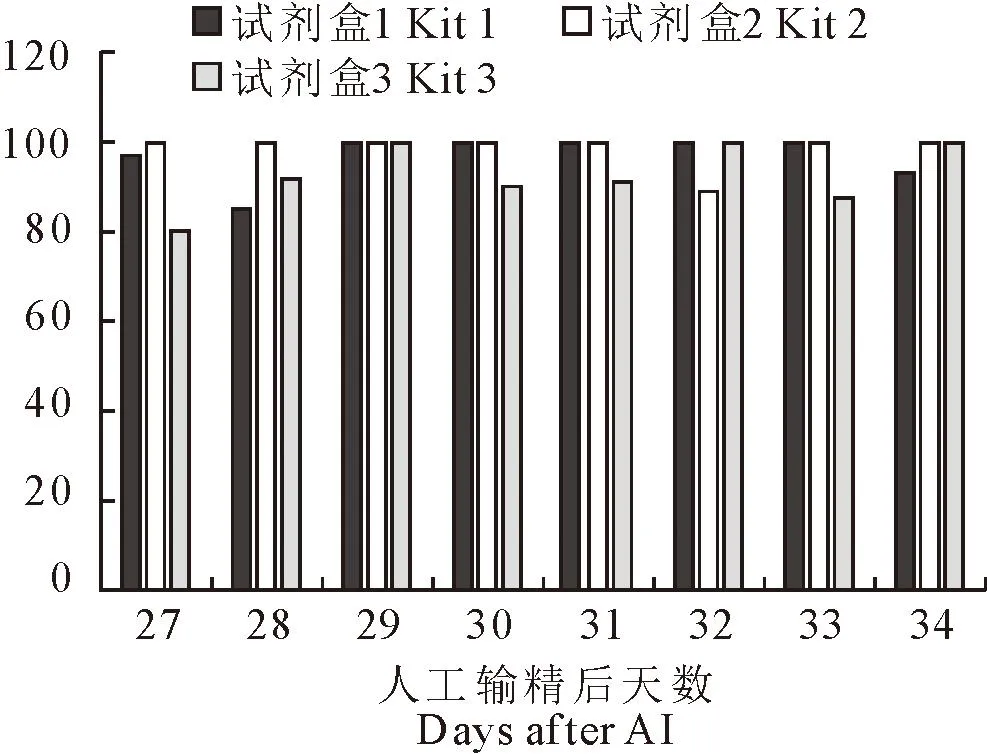
图2 3种早孕诊断试剂盒检测怀孕与超声诊断一致性

表3 试剂盒检测结果怀孕与超声诊断的一致性
由表3可知,在人工授精后的27~34 d内,对怀孕牛检测的整体灵敏性,3种试剂盒均在93% 以上。
由图2可知,在人工授精后的27~34 d内,试剂盒1的检测灵敏性,在人工授精后的29~33 d达100%,但在27、28、34 d则居于85.00%~96.97%之间,表现出较大的不稳定性。试剂盒2的检测灵敏性,在人工授精后的8 d内,有7 d为100%,仅在32 d为88.89%,虽然也存在一定的不稳定性,但是低于试剂盒1。试剂盒3的检测灵敏性,在人工授精后的29、32、34 d达100%,但在27、28、30、31、33 d则居于80.00%~91.97%之间,也表现出较大的不稳定性。
3 讨论
3.1 牛PAGs可视早孕试剂盒检测特异性
未怀孕牛的PAGs维持在低水平,其分泌量随妊娠的进展而逐渐增多[20],胚胎早期损失、流产及妊娠结束时,PAGs水平开始下降[10,13,17]。本研究选择的时间阶段只有胚胎早期损失一种可能,胚胎损失后,超声检测也不会发现胚胎影像,其结果同样为“未孕”。即PAGs试剂盒对“未孕”的检测结果应与超声波检测检查100%一致,本研究中3种试剂盒均达到了此水平。因此,可以将PAGs早孕试剂盒的“特异性”称为其“准确性”。
Green等人[17]研究认为人工授精后28~30 d妊娠牛PAGs含量显著高于未妊娠母牛,推荐将人工授精后28~30 d作为检测PAGs判断母牛妊娠与否的最早时间点。但是,各种PAGs在妊娠期间的表达并不协调,有早有晚[17],因此检测的特异性和灵敏性也不尽相同。本研究中3种试剂盒分别自人工授精后31、27、27 d均做到了100%准确,也就是说3种试剂盒虽然均具有高特异性特征,但是试剂盒2、3的特异性检准时间早于试剂盒1,比超声检测时间(通常在人工授精后35 d)提前了8 d,意味试剂盒2、3可以减少空怀天数,缩短产犊间隔,增加经营效益,市场价值更高。
3.2 牛PAGs可视早孕试剂盒检测灵敏性
PAGs的半衰期为7~8 d,产后100 d左右仍然可以检测到[13,17]。如果胚胎早期死亡或流产事件发生时间较短,PAGs可视早孕检测试剂盒存在“假阳性”,与超声波检测结果可能会出现不一致的情况,该情况是由于时间差及方法局限所致。所以,不能笼统地将PAGs早孕试剂盒的“灵敏性”视为“准确性”。因此,也不能据此比较该类试剂盒之间“灵敏性”的优劣。
综上所述,3种试剂盒的检测特异性与超声检测的一致性均可达100%,该类试剂盒可以作为“准确性”最终判断依据。3种试剂盒中,试剂盒2、3可以在人工授精后27 d达到100%,比试剂盒1提前4 d。

