山羊源贝氏柯克斯体抗体间接ELISA检测方法的建立与应用
张锐铮,于皓同,王凯茸,张 琪,许信刚
(西北农林科技大学动物医学院,陕西杨凌 712100)
Q热是由贝氏柯克斯体(Coxiellaburnetii)引起的一种自然疫源性人兽共患传染病,主要的临床症状表现为支气管肺炎、高热以及流产等,是一种严格的胞内寄生微生物。C.burnetii属于变形军团菌目贝氏柯克斯体属[1],宿主范围广泛,节肢动物是野生动物与家养动物间主要的传播媒介[2]。C.burnetii通过感染动物的粪便、尿液、阴道分泌物及气溶胶进行传播,其中气溶胶是其传播的主要方式,传播范围广泛,根据贝氏柯克斯体血清流行病学调查显示,我国Q热分布范围广泛[3-5]。
血清学检测是诊断Q热及一些流行病的主要手段,在大规模流行病学调查中ELISA因灵敏度高、操作简单则最为常用,现今C.burnetii的ELISA检测抗原主要由全菌及重组抗原组成[6],C.burnetii全菌抗原需要在高等级生物安全实验室对C.burnetii进行繁殖纯化,制备风险较大,难以批量生产,相比全菌抗原,重组抗原制备风险适宜大批量制备,而com1基因是C.burnetii的外膜蛋白基因,在不同菌株均具有高度的保守性,无论是急性Q热菌株和慢性Q热菌株均存在com1基因[7]。本研究拟通过基因克隆、原核表达等方法纯化复性C.burnetii外膜抗原com1蛋白,并将重组com1蛋白作为包被抗原,建立一种Q热间接ELISA检测试剂盒,进一步丰富Q热的检测技术,为Q热的流行病学调查提供技术支持。
1 材料与方法
1.1 材料
1.1.1 病料、菌株和血清 Q热阳性病料是临床出现流产母山羊,阴道分泌物通过PCR检测Q热为阳性,流产羊血清通过虎红平板凝集试验为布鲁氏菌血清阴性,阴道分泌物衣原体PCR检测为阴性。羊Q热阳性血清、羊Q热阴性血清、山羊流产衣原体阳性血清、山羊支原体阳性血清、牛支原体阳性血清由中国动物卫生与流行病学中心国家动物血清库提供;Pet-28a(+)菌株由西北农林科技大学动物医学院兽医微生物实验室保存。307份山羊血清样品采自陕西省部分地区羊场。
1.1.2 主要试剂 DNA/RNA提取试剂盒、DH5α感受态细胞、BL21(DE3)感受态细胞、琼脂糖凝胶DNA胶回收试剂盒、LB培养基,北京天根生物科技有限公司产品;Ni-NTA His Bind Resin镍柱、考马斯亮蓝染色液、酶标板、快速质粒小提试剂盒,海基生物科技有限公司产品;2×TaqMaster Mix,艾科瑞生物工程有限公司产品;HindⅢ、BamHⅠ内切酶,NEB公司产品。
1.1.3 主要仪器 高压蒸汽灭菌锅,LS-35HJ,江阴滨江医疗设备有限公司产品;恒温振荡器,THZ-C,苏州培英实验设备有限公司产品;蛋白电泳仪,164-5050,Bio-Rad公司;超声破碎仪,JY92-ⅡN,宁波新芝生物科技股份有限公司产品;酶标仪,AMR-100,杭州奥盛仪器有限公司产品;琼脂糖水平电泳仪,DYCP-31DH,北京六一生物科技有限公司产品。
1.2 方法
1.2.1 引物设计 由NCBI收录的C.burneti的com1基因序列(CP115461.1)使用SnapGene进行特异性引物设计(表1)。
1.2.2com1基因扩增及原核表达载体的构建 利用DNA组织提取试剂盒提取Q热病料中DNA,并使用所设计特异性引物对目标基因进行扩增,PCR反应体系为:2×TaqMaster Mix10 μL,上、下游引物各1 μL,模板2 μL,其余用ddH2O补足至20 μL。反应程序为:95℃ 5 min;95℃ 30 s,56℃ 30 s,72℃ 60 s,共循环30次;72℃延伸10 min。扩增产物胶回收后对回收产物和Pet-28a表达载体进行双酶切,胶回收产物16 ℃金属浴连接12 h。重组质粒进行酶切鉴定后送至奥克鼎盛生物科技公司进行测序,将其鉴定结果为阳的质粒命名为Pet-28a-com1。
1.2.3 重组com1蛋白表达条件的优化 将Pet-28a-com1转化至BL21(DE3)中,经Kan+抗性平板筛选优势单菌落后增菌培养,按照1∶100比例转接于Kan+抗性的LB中,2 h后检测菌液吸光值,当至OD600为0.6~0.8时,加入适量浓度IPTG(1.0 mmol/L)诱导表达,分别在2、3、4、5、6、7 h时收菌离心保存,菌液超声破碎后经SDS-PAGE以确定不同诱导时间蛋白表达量并确定最佳诱导时间,使菌液IPTG终浓度分别为0.2、0.4、0.6、0.8、1.0 mmol/L。37 ℃恒温摇床培养至最佳诱导时间离心收集菌体,菌液超声破碎后经SDS-PAGE来确定最佳诱导浓度。
1.2.4 重组com1蛋白表达形式分析、纯化及复性 经1.2.3蛋白表达条件优化,在已知最优表达条件进行大量菌液诱导,诱导结束后离心,弃去上清用菌液体积1/25 的PBS重悬,超声裂解后收集上清及沉淀,对收集的菌液上清、裂解液上清及沉淀水煮制样,SDS-PAGE后确定重组蛋白最优表达形式。采用Ni-NTA His Bind Resin镍柱对com1重组蛋白进行纯化,以多梯度尿素透析法对com1重组蛋白复性,并置于-80℃保存。
1.2.5 重组com1蛋白的Western blot分析 复性com1重组蛋白SDS-PAGE凝胶电泳后,切下目的蛋白所在区域凝胶,进行转膜,将膜封闭4 h后加入稀释至1∶200 Q热阳血清性孵育液于4℃ 过夜孵育,次日洗膜后加入1∶5000稀释HRP标记的酶标二抗,室温孵育2 h,经显色液曝光后分析。
1.2.6 间接ELISA检测方法的建立与应用
1.2.6.1 抗原包被量、一抗稀释度和酶标二抗稀释度的确定 采用三因素正交法来探索ELISA最佳工作条件,com1重组抗原包被浓度分别为300、400、500、600 mg/mL;Q热阳性血清稀释倍数为1∶50、1∶100、1∶200;二抗稀释倍数为1∶2 500、1∶5 000、1∶10 000;参照文献[8]进行间接ELISA检测,并以P/N值为依据来确定抗原包被量、一抗稀释度和酶标二抗稀释度最优工作条件。
1.2.6.2 其他试验条件的优化 在1.2.6.1最优工作条件下,分别对脱脂奶粉封闭时间、一抗、二抗孵育时间、TMB显色时间工作条件进行优化,以60 min、90 min、120 min 3个梯度以确定脱脂奶粉最优封闭时间;以10 min、20 min、30 min 3个梯度以确定一抗、二抗孵育时间最优孵育时间;以10 min、20 min、30 min 3个梯度以确定TMB显色最优时间。
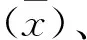
1.2.6.4 特异性试验 以ELISA最优工作条件为基础,对山羊支原体阳性血清、牛支原体阳性血清、山羊流产衣原体阳性血清进行ELISA检测,分别以Q热阳性血清和阴性血清为阳性对照和阴性对照,分析ELISA检测结果,评价该方法特异性。
1.2.6.5 敏感性试验 以Q热阳性血清为检测样本进行2倍倍比稀释,以探索该方法最低检出限,同时分别以的Q热阳性血清和阴性血清作为阳性对照和阴性对照,评价该方法敏感性。
1.2.6.6 重复性试验 以同批次纯化复性的com1重组蛋白为抗原包被ELISA酶标板,以3组阴性和阳性血清为检测样本进行重复检测,评价该方法批内重复性;以3组不同批次的com1重组蛋白为抗原包被ELISA酶标板,分别对阴阳血清重复检测,评价其批间重复性。
1.2.6.7 临床样品检测 利用本研究所建立的间接ELISA检测方法,对实验室保存的陕西部分地区羊场采集的307份样品进行检测,评估该方法的临床应用效果。
2 结果
2.1 com1基因的扩增及重组质粒的构建
以Q热阳性病料的DNA为模板,扩增得到696 bp的目的片段,符合预期(图1)。所构建的重组质粒Pet-28a-com1经Hind Ⅲ、BamH Ⅰ酶切后进行凝胶电泳,出现目的条带与载体条带,表明载体构建成功(图2)。

M.DNA标准DL 5 000;1.com1基因扩增
2.2 重组com1蛋白表达条件的优化
当IPTG终浓度为0.8 mmol/L时,重组蛋白表达量最高(图3);在IPTG诱导6 h时,重组蛋白表达量最高(图4)。

M.预染蛋白Maeker;1.诱导的Pet-28a;2~6.分别为37℃、0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG终浓度条件下诱导8 h的重组Pet-28a-com1;8.未诱导的重组Pet-28a-com1
2.3 重组com1蛋白表达形式的分析与纯化
在上述条件下诱导表达收集菌液超声破碎后,经SDS-PAGE后考马斯亮蓝染色分析,com1重组蛋白主要存在于沉淀中,纯化后获得了大小为27 ku的目标蛋白(图5)。

M.预染蛋白Marker;1.Pet-28a-com1全菌;2.Pet-28a-com1菌液上清;3.Pet-28a-com1超声裂解菌体上清;4.Pet-28a-com1超声裂解菌体沉淀;5.纯化蛋白
2.4 重组蛋白的Western blot分析
以Q热阳性血清作为一抗进行Western blot分析,曝光后于27 ku处出现重组com1蛋白的特异性条,表明com1重组蛋白能作为抗原与Q热阳性血清发生特异性反应(图6)。
2.5 抗原包被量、一抗稀释度和酶标二抗稀释度的确定
由方阵滴定法结果表2可知,当com1重组蛋白的抗原包被量为4 μg/mL,一抗稀释倍数为100 倍,酶标二抗稀释倍数为2 500倍时,此时P/N值达到最大,其为该方法最佳工作条件。
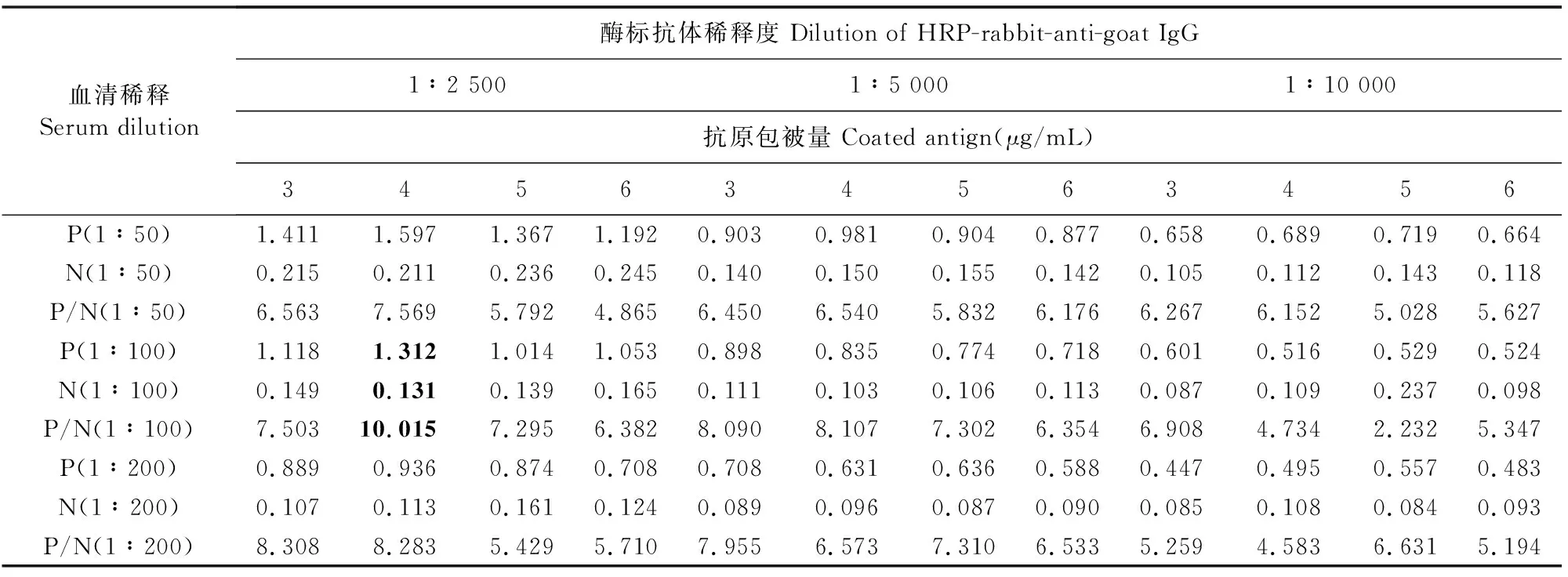
表2 最佳抗原包被量、血清稀释度、酶标二抗稀释度的确定
2.6 其他试验条件优化
试验结果显示当封闭时间为60 min、一抗阳性血清孵育120 min、酶标二抗孵育60 min、TMB显色时间20 min时,P/N值最大。确定此为最佳工作条件。
2.7 间接ELISA临界值的确定
以上述ELISA最佳工作条件检测40份Q热阴性血清样品,统计40份Q热阴性血清OD450,其平均值为0.167,标准差为0.037,即临界值为0.278,当待检血清OD450≥0.278时判定为阳性;当待检血清OD450≤0.278时判定为阴性。
2.8 特异性试验
以上述最佳工作条件对山羊支原体、牛支原体、山羊流产衣原体、山羊贝氏柯克斯体的阳性血清进行ELISA检测,结果显示仅有山羊立克次氏体阳性血清OD450大于临界值,判定为阳性,其余均为阴性(表3)。表明该方法特异性良好。

表3 特异性试验结果
2.9 灵敏性试验
利用该方法检测倍比稀释后的Q热阳性血清,当Q热阳性血清稀释至1∶2 048时其OD450为0.291仍大于临界值 0.278(表4),表明该方法灵敏性良好。

表4 灵敏性试验结果
2.10 重复性试验
利用优化好的ELISA检测方法对样品进行检测,结果显示该方法批内试验变异系数为2.3%~4.8%,批间试验变异系数为2.6%~6.1%,两者的变异系数均小于10%,表明该方法试验结果稳定,重复性良好。
2.11 临床样品检测
用本试验所建立的检测方法检测陕西及其周边羊场收集到的307份临床山羊血清样品,结果显示,有27份血清样本OD450≥0.278,判定为阳性,阳性率为9.12%。
3 讨论
贝氏柯克斯体(C.burnetii)是一种专性胞内寄生微生物,自1935年澳大利亚屠宰场中引发Q热后,相继在全世界范围流行,已成为当前分布最为广泛的人畜共患病之一。C.burnetii在兽医临床上主要引起牛、羊等孕畜流产,孕畜感染C.burnetii早期无明显症状,其主要症状是感染后期出现流产或死产。患畜可通过气溶胶感染易感人群,也是人类Q热的主要感染源。急性Q热可通过抗生素进行治疗,未及时治疗转为慢性便很难治愈。因此,提前预防是避免Q热流行最有效措施。
Q热早期临床症状缺乏特异性,在临床上无法根据症状对其准确辨别。由于C.burnetii病原分离复杂,培养周期长,PCR等分子生物学技术代替C.burnetii病原分离作为Q热早期诊断方法。PCR检测具有高特异性的优点,但其对试验条件的要求较高,不利于临床检测,而ELISA检测方法操作简单且对设备需求较低,更适用于对C.burnetii的大范围筛查。com1基因作为C.burnetii的主要外膜抗原蛋白在不同菌株中均具有高度同源性,且在急性和慢性Q热菌株中均存在[9]。Zhang G Q等[10]对分离自不同区域病人的21株C.burnetii中的com1基因进行序列比对,com1基因的同源性均在98.8%~100%。这说明com1基因具有高度的保守性,可作为ELISA检测方法的包被抗原[11]。本研究通过对C.burnetiicom1基因克隆、原核表达,建立了一种间接ELISA检测方法。结果表明,该检测方法特异性强、敏感性高;批内重复性试验和批间重复性试验结果稳定,重复性良好,变异系数均小于10%;对307份临床血清样品进行检测时有28份为阳性,阳性率为9.12%,本结果与谭启东等[2]在宁夏回族自治区贝氏柯克斯体的血清流行病学调查结果中的总体阳性率11.37%较一致,说明贝氏柯克斯体在国内部分地区有流行趋势。综上说明,本研究所建立的贝氏柯克斯体com1抗体间接ELISA检测方法可为Q热的血清流行病学检测提供技术支持。

