食品微生物检验方法的技术验证
◎ 刘胤璇,李春江,杨蕊银,白秀珍
(红河哈尼族彝族自治州质量技术监督综合检测中心,云南 蒙自 661199)
方法技术验证是实验室在使用新标准进行检验前或在用标准实质性变更时,用以证实能够正确运用这些方法的技术性验证过程,是实验室质量管理体系中至关重要的一环[1-3]。检验检测机构通过方法验证,可以对方法的适用性进行评价,以确保检验数据准确可靠。运用不经验证的新方法进行食品检验工作,会对结果造成严重影响,轻则发生数据偏差,重则对产品判定结果造成影响[4]。
目前,仍有很多检验检测机构对食品微生物检验方法的技术验证缺乏认识,引用新标准时,仅通过对标准的培训、人员能力评价,对照评价设备、培养基、试剂、环境等是否符合标准要求来评价该标准的适用性,缺乏技术性验证过程[5-6]。本文以《食品安全国家标准 食品微生物学检验 副溶血性弧菌检验》(GB 4789.7—2013)方法验证为例,根据标准适用范围及副溶血性弧菌污染海产品的特性,结合《食品安全国家标准 预包装食品中致病菌限量》(GB 29921—2021)[7]及《食品安全国家标准 散装即食食品中致病菌限量》(GB 31607—2021)[8]要求,选择水产制品和水产调味品两种基质[9-11]作为分析样本,阐述微生物检验方法技术验证全过程,从食品微生物检验方法验证技术参数、要素的控制,探讨微生物检验方法验证工作程序,结合实例,建立食品微生物检验方法技术验证基本模式,为食品检验检测机构提供借鉴和参考。
1 材料与方法
1.1 材料与试剂
选取水产制品和水产调味品海鱼和耗油作为样品基质,样品称量后加入副溶血性弧菌(编号ATCC17802,第2 代工作用菌种)菌悬液,按标准要求加入稀释液,用拍击式均质器拍击2 min 制备样品匀液。
3%氯化钠碱性蛋白胨水、TCBS 平板、弧菌显色培养基、3%氯化钠胰蛋白胨大豆琼脂、氧化酶试剂、革兰氏染色剂和干制生化鉴定试剂盒,均由北京陆桥技术有限责任公司提供。
1.2 仪器与设备
T500 电子天平(常熟市双杰测试仪器厂)、PREVI Color Gram 全自动革兰氏染色仪(法国梅里埃公司)、1 mL/10 mL 移液器(德国普兰德公司)、BD115 培养箱(德国BINDER 公司)、HBM-400C 样品均质器(天津恒奥科技发展有限公司)及数显温湿度计(德国testo 公司)。
1.3 实验与方法
根据定性检验和定量检测要求的不同,选择方法验证需要控制的验证要素。定性检验,对方法的检出水平LOD50进行验证;定量检测,从估计偏差、精密度、不确定度评定3 方面进行验证。实验定性检验、定量检测流程参考《食品安全国家标准 食品微生物学检验 副溶血性弧菌检验》(GB 4789.7—2013)[12]。
2 结果与分析
2.1 定性检验
因没有方法的确认资料,估计LOD50≤3 CFU/测试单元。取副溶血性弧菌标准菌种制备0.5 麦氏浊度菌液,稀释至10-7,每个稀释度菌液各取1 mL 至两个培养皿,加入3%氯化钠胰蛋白胨大豆琼脂平板,36 ℃培养48 h 后计数,得到10-6培养皿上菌落数为19 CFU,按高(10×LOD50)、中(5×LOD50)、低(1×LOD50),3 个接种水平接种量应为30 CFU、15 CFU、3 CFU,制备8 个样品后,两个高接种水平样品中加入1.5 mL 稀释度10-6菌液,两个中接种水平样品中加入0.75 mL 稀释度10-6菌液,两个低接种水平样品中加入0.15 mL 稀释度10-6菌液,剩余两个为空白样品。加入标准菌种后,按GB 4789.7—2013 标准要求进行定性检验。参考《微生物检测方法确认与验证指南》(RB/T 033—2020)要求,根据不同污染水平阳性结果估计LOD50,结果如表1 所示。

表1 副溶血性弧菌定性检出水平检测结果表
2.2 定量检测
2.2.1 估计偏差
本次验证针对水产制品和水产调味品两种基质中副溶血性弧菌进行定量检测。每种基质选择3 个不同生产企业的不同产品,因所选产品中未检出目标菌,故进行人工污染。3 个产品称样后分别添加10-2、10-3、10-4共3 个稀释度的菌液0.1 mL,按照GB 4789.7—2013 标准要求进行检验。同时,每个稀释度各取0.1 mL至两个培养皿,加入3%氯化钠胰蛋白胨大豆琼脂平板,36 ℃培养48 h 后计数,得到10-4培养皿上菌落数为205 CFU、197 CFU,样品取样量为25 g,即加入样品后样品中含有副溶血性弧菌量分别为800 CFU·g-1、80 CFU·g-1、8 CFU·g-1。计算检测结果与加入量的差值(表2),结果与对照结果之差在0.5 lgCFU·g-1以内,估计偏差符合要求。

表2 副溶血性弧菌定量检测估计偏差检测结果表
2.2.2 精密度
水产制品和水产调味品两种基质各取10 个样品,称量后各加入10-3稀释度的菌液0.1 mL,每个样品取两个检验单元,分别由检验人员A 与B 完成检验,定义为检验单元A、检验单元B。按照GB 4789.7—2013标准要求进行检验,检验结果见表3。取对数结果求重复性标准偏差,分别为0.113 8%(水产制品A)、0.113 8%(水产制品B)、0.113 8%(水产调味品A)、0.113 8%(水产调味品B)。参考《食品微生物定量检测的测量不确定度评估指南》(RB/T 151—2016)[13]给出的好氧嗜温性菌冻虾的再现性标准偏差为0.18%,此次试验两种基质所有检验单元检测结果的重复性标准偏差均小于0.18%,故精密度符合要求。
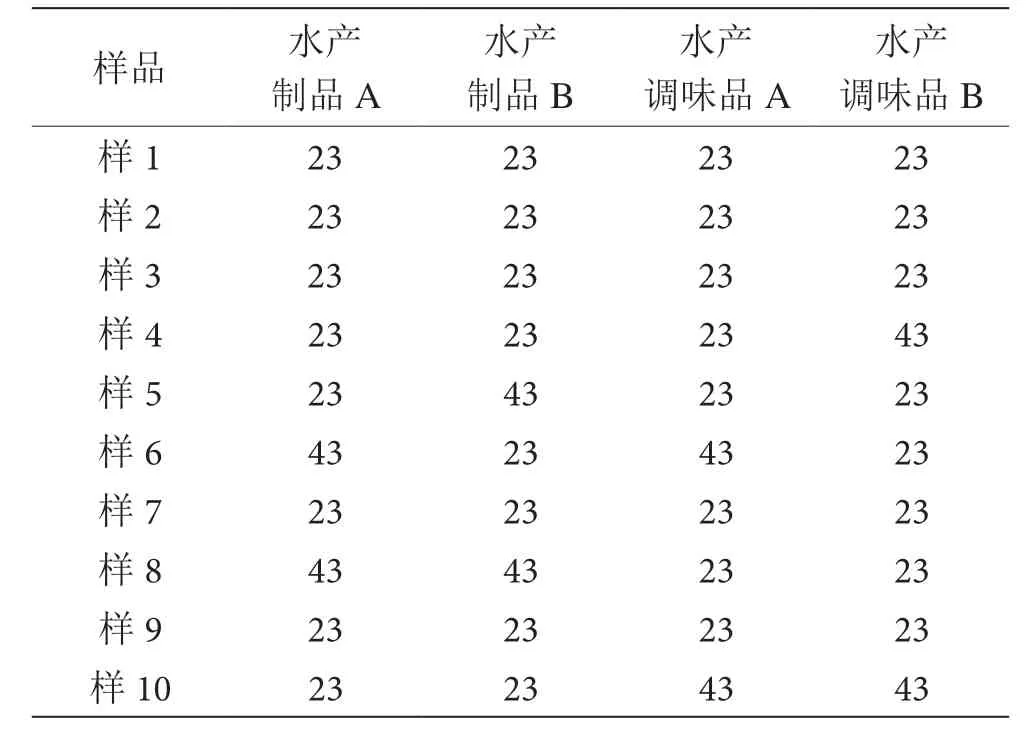
表3 副溶血性弧菌精密度检测结果表 单位:MPN·g-1
2.2.3 不确定度评定
参考李珍等[14]和朱夕涛等[15]的方法,分析副溶血性弧菌定量检测不确定度分量的来源,见表4。根据检验结果及不确定度分量来源,计算测量不确定度[15]。检测结果对数值见表5,各不确定度分量结果见表6。水产制品、水产调味品中副溶血性弧菌的合成不确定度均为0.110 7,取包含因子k=2,置信概率95%[16],得到扩展不确定度均为2×0.110 7=0.22 lgMPN·g-1。副溶血性弧菌含量对数均值均为1.41,则结果报告为101.41±0.22MPN·g-1。

表4 标准不确定度分量列表

表5 水产制品和水产调味品副溶血性弧菌定量检测对数结果表 单位:lgMPN·g-1

表6 副溶血性弧菌定量检测不确定度评定表
3 结论
本次方法验证给出水产制品和水产调味品定性检验检出水平分别为2 CFU/测试单位、3 CFU/测试单位,不高于预估检出水平,满足要求。水产制品3 种污染水平定量检测副溶血性弧菌的估计偏差分别为0.35 lgCFU·g-1、0.27 lgCFU·g-1、0.24 lgCFU·g-1,水产调味品的估计偏差为0.35 lgCFU·g-1、0.27 lgCFU·g-1、0.24 lgCFU·g-1,均小于0.5 lgCFU·g-1,符合要求;重复性标准偏差均为0.113 8%,小于《食品微生物定量检测的测量不确定度评估指南》(RB/T 151—2016)给出的再现性标准偏差0.18%,符合要求;方法的扩展不确定度为0.22 lgMPN·g-1(k=2,置信概率95%)。实验从检出水平、估计偏差、精密度、不确定度评定等方面构建了副溶血性弧菌检测方法验证的基本模式,验证结果满意,同时给出了不确定度评定方案,为实验室制定判定规则提供了参考。
食品微生物检验实验室正确地实施方法验证,可以有效控制方法使用过程中的风险[5]。根据本研究中实例分析,建立微生物方法技术验证的基本模式,首先根据方法范围和实验室申请扩项范围,选定合适的基质,针对不同基质进行技术验证,做到基质全覆盖;定性检验时对检出水平进行验证;定量检测时从估计偏差、精密度、不确定度评定3 方面进行验证。除此之外,还可根据实验室需要,增加能力验证[17]、实验室间比对等方式,辅助完成方法验证,从而提升实验室检测能力,确保出具的数据准确可靠。

