外周血新型炎症指标与2型糖尿病周围神经病变的相关性及其预测价值
贺袁 彭彩碧
糖尿病周围神经病变(DPN)是糖尿病最常见的慢性并发症之一[1]。DPN可累及感觉神经、运动神经,起病比较隐匿,早期可能无明显症状,随着病情进展,常出现疼痛、麻木、感觉减退,严重者可导致糖尿病足的发生,危害极大。因此,DPN的预防和早期诊断对于提高糖尿病患者的生活质量至关重要。目前DPN的发病机制可能与细胞氧化应激、炎症反应、异常的信号通路、血管内皮功能障碍等病理生理改变有关,而其中慢性低度炎症加剧在DPN的发生和发展中起重要作用[2]。已有研究发现通过廉价、简单和更易获得的外周血炎性标记物如中性粒细胞计数/淋巴细胞计数比值(NLR)、PLT计数/淋巴细胞计数比值(PLR)与DPN及糖尿病其他慢性并发症密切相关[3-5]。而系统免疫炎症指数(SII)作为近期发现的一种新型炎症指数,由中性粒细胞、淋巴细胞及PLT 3种细胞综合组成[6],有研究证实其较NLR、PLR能更好地反映机体内炎症状态,且作为全身炎症预测指标其诊断效能及稳定性更佳[7-9]。目前有关于SII的研究报道主要集中在肿瘤、冠心病等相关领域[10-11],而在糖尿病及相关并发症方面有待进一步深入。因此本研究旨在探讨SII与DPN的相关性及其预测价值。
对象与方法
1.对象:选取2021年1月~2021年8月于我院住院治疗的2型糖尿病(T2DM)患者243例,其中男122例、女121例,年龄30~80岁,平均年龄(55.71±8.64)岁。根据是否合并糖尿病周围神经病变(DPN)将所有患者分为DPN组(133例)和单纯T2DM组(NDPN组,110例)。纳入标准:(1)均符合2020年版《中国2型糖尿病防治指南》[12]中T2DM的诊断标准;(2)DPN组患者均符合《糖尿病神经病变诊治专家共识(2021年版)》[13]中DPN的临床诊断标准。排除标准:(1)1型糖尿病、冠状动脉疾病、心肌梗死、心力衰竭;(2)非糖尿病所致的神经病变(如遗传性、酒精性、代谢性和毒性因素);(3)慢性酗酒、甲状腺疾病、脑梗死、颈腰椎疾病;(4)肝功能不全(肝酶增高2倍以上)、肾功能不全[估算的肾小球滤过率(eGFR)<60 ml·min-1·(1.73 m2)-1];(5)急慢性感染、严重的组织损伤及急性大出血或中毒;(6)恶性肿瘤、其他神经系统疾病、自身免疫性疾病及合并精神或心理疾病;(7)影响中性粒细胞、PLT、淋巴细胞等的血液疾病及服用可能影响中性粒细胞、PLT及淋巴细胞的药物。本研究经我院伦理审查委员会审核批准(2022-KY-09),所有患者均签署知情同意书。
2.方法:收集所有患者的一般资料(性别、年龄、BMI)及实验室检查指标[ALT、AST、总胆红素(TBil)、肌酐(Cr)、尿素氮(SUN)、尿酸(UA)、胱抑素C(Cys-C)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、WBC计数、中性粒细胞计数(NEUT)、淋巴细胞计数(LYM)、PLT计数、单核细胞计数(MONO)],计算SII、NLR、PLR。SII=NEUT×PLT计数/LYM。
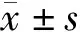
结 果
1.两组患者一般资料及实验室检查指标比较:两组患者性别、年龄、BMI及HbA1c、MOMO、HDL-C、LDL-C、TG、TC、Cr、UA、ALT、AST水平比较差异均无统计学意义(P>0.05)。DPN组患者WBC计数、NEUT、PLT计数、Cys-C、BUN、SII、NLR及PLR均显著高于NDPN组,LYM、TBil均显著低于NDPN组(P<0.05)。见表1。
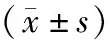
表1 两组患者一般资料及实验室检查指标比较
2.不同SII水平患者DPN患病率分析:根据SII水平将所有入组患者进行四分位分组[S1组(≤333.69×109/L)62例、S2组(333.69×109/L~435.45×109/L)60例、S3组(435.45×109/L~565.84×109/L)60例、S4组(≥565.84×109/L)61例],S1组、S2组、S3组患者合并DPN的患病比例均低于S4组[9.7%(6例)、36.7%(22例)、76.7%(46例)比96.7%(59例),P<0.01]。
3.T2DM患者发生DPN的影响因素分析:以有无合并DPN为因变量,剔除共线性变量NLR、PLR、NEUT、LYM及PLT计数的影响,校正WBC计数、BUN、TBil后,二元logistic回归分析结果显示SII(OR=1.015,95%CI1.011~1.019)、Cys-C(OR=6.403,95%CI1.195~34.305)均是DPN发生的危险因素(P<0.05)。
4.SII对DPN的预测价值:SII、NLR及PLR对T2DM合并DPN均具有一定的预测价值(P<0.001),其中SII预测DPN的曲线下面积(AUC)高于NLR及PLR。见表2。
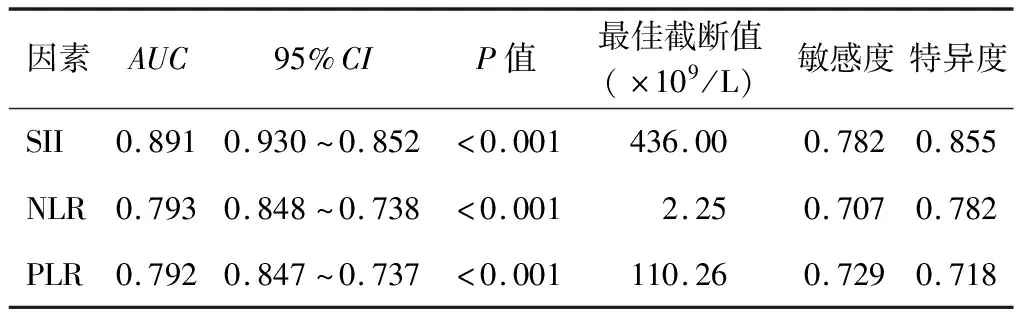
表2 SII、NLR及PLR预测DPN的ROC曲线分析结果
讨 论
目前临床上用于DPN的辅助筛查方法较多,如神经电生理检查、密歇根及多伦多评分量表、定量感觉检查等[14];近年来研究发现的血清炎症标志物如IL-6、肿瘤坏死因子(TNF)-α也可用于DPN的辅助筛查[15]。但这些DPN的筛查方法费时、费力、成本较高,且基层医院不能普遍开展,资源的可及性等限制了这些方法在临床广泛应用。因此,寻求一种有效便捷的筛查方法具有一定的临床意义。
在本研究中,DPN组患者SII水平较单纯T2DM组显著增高;以SII水平将患者进行四分位组,发现随SII水平的升高,T2DM患者发生DPN的患病率增加;二元logistic回归分析结果显示SII为DPN发生的独立危险因素,这些结果均表明DPN患者和单纯T2DM患者之间的体内炎症程度不同,且SII在DPN的发生发展中有重要作用。DPN患者出现较高水平的SII,反映在血细胞层面,则是NEUT、PLT计数增加或LYM减少。其原因主要是在长期慢性高血糖刺激下,细胞炎症基因的表达增加,产生大量的促炎细胞因子和趋化因子,导致粒细胞、单核细胞等炎症细胞的聚集,从而释放更多的细胞因子以招募更多的炎性细胞,这些炎症反应的级联反应最终会导致中性粒细胞的增加。高PLT计数与增加的PLT活性有关;研究表明,在DPN患者中存在PLT活性增加,且PLT可与WBC及血管内皮细胞结合,影响这些细胞的炎症成分释放,从而增强局部炎症反应,这一过程在DPN中起重要作用[16]。而LYM减少,反应机体免疫调控相对不足,可能是由于周围神经组织长期慢性低度炎症,导致淋巴细胞的凋亡增加[17]。
本研究中DPN组患者外周血炎症指标NLR及PLR水平较NDPN组显著增高,差异有统计学意义,这与Chen等[18]的研究结果一致。为探讨SII与NLR及PLR对DPN预测价值的优劣性,本研究通过单一指标的ROC曲线分析,结果显示三者用于判别DPN的最佳截断值分别为436.00×109/L、2.25×109/L、110.26×109/L,AUC分别为0.891、0.793和0.792,AUC值均介于0.7~0.9之间,提示这三项指标对DPN的预测均具有一定价值,而SII的AUC更接近1,同时其特异度及敏感度也均优于NLR及PLR。因此,可见SII≥436×109/L在预测DPN具有的潜在的临床价值,且其预测效能优于NLR及PLR。本研究存也在一定的局限性:(1)是一项横断面、单中心研究设计,样本量相对较小,无法建立因果关系,需要后期更大样本、多中心研究来论证;(2)没有探讨SII水平与DPN严重程度之间的关系,以及SII高水平时予以早期药物干预的效果,需要后续进一步研究。
综上所述,外周血SII高水平的T2DM患者,发生DPN的风险将大大增加,SII有望成为临床上DPN筛查及早期干预的预警指标。

