基于重症监护医学信息数据库-Ⅳ分析低三碘甲状腺原氨酸综合征与脓毒症患者病死率的相关性
徐跃文 陈福进 赵晶晶 姚莉
脓毒症是严重感染引起的宿主反应失调导致的致命性器官功能障碍[1],发病率及死亡率均较高,根据拯救脓毒症运动指南,脓毒症的早期诊断和干预对于提高生存率和改善患者预后至关重要[2]。由于脓毒症患者的不良应激状态引起神经内分泌及代谢功能改变,患者会出现正常甲状腺功能病态综合征(ESS)[3],临床上以低三碘甲状腺原氨酸(T3)综合征最为多见。有研究发现,甲状腺激素水平的下降程度与感染性疾病的严重程度相关[4-5],但结果为小样本临床研究,可靠性不足。重症监护医学信息数据库-Ⅳ(MIMIC-Ⅳ)是一个大型的单中心数据库[6],收录了2008~2019年间美国贝斯以色列女执事医疗中心重症患者全面的数据,包括人口统计学、生命体征、诊断信息、实验室指标等。本研究基于MIMIC-Ⅳ进行回顾性分析,进一步明确低T3综合征对脓毒症患者病情严重程度及预后的影响。
对象与方法
1.对象:纳入MIMIC-Ⅳ中的脓毒症患者963例。纳入标准:(1)根据sepsis 3.0诊断为脓毒症;(2)入ICU 24 h内至少有1次甲状腺功能检查结果;(3)年龄≥18岁。排除标准:(1)ICU住院时间<24 h;(2)甲状腺疾病;(3)下丘脑-垂体相关疾病;(4)恶性肿瘤;(5)妊娠;(6)存在疑似数据错误的记录。数据库中T3的正常范围为80~200 ng/dl,因此本研究中对于低T3的所用分界点为T3水平正常值的下限(80 ng/dl),据此将963例患者分为低T3组488例(T3<80 ng/dl)及非低T3组475例(T3≥80 ng/dl)。本研究已获得对该数据库的访问及数据提取权限(证书编号:47770180)。
2.方法:采用Postgre SQL(v12.0)中的数据库查询语言(SQL)对纳入患者进行数据提取,包括一般资料(性别、年龄、入住ICU时间、住院时间)、合并症[高血压病、糖尿病、脑血管疾病、慢性心力衰竭(简称慢性心衰检查)、慢性阻塞性肺疾病(COPD)、慢性肾脏病]、实验室检查指标[T3、甲状腺素(T4)、游离甲状腺素(FT4)、促甲状腺激素(TSH)、WBC计数、PLT计数、中性粒细胞与淋巴细胞比值(NLR)、血肌酐(SCr)、血乳酸(Lac)、氧合指数]、危重度评分[序贯器官衰竭评估(SOFA)评分、急性生理学评分(APS)Ⅲ]及入ICU 24 h内是否接受机械通气或肾脏替代治疗。对于多次入住ICU患者,仅纳入首次入住ICU住院信息进行分析。记录患者预后情况,包括28 d、365 d、ICU、院内死亡情况。本研究的主要结局指标为28 d死亡率。
3.统计学处理:应用Stata 15.0软件进行统计分析。非正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon秩和检验或单因素方差分析;计数资料以例和百分比表示,组间比较采用χ2检验。采用局部加权回归(Lowess)拟合整体死亡率的趋势曲线。采用多因素logistic回归分析评估影响脓毒症合并低T3综合征患者死亡的危险因素。构建预测模型,采用受试者工作特征(ROC)曲线分析该模型的预测效能,采用Hosmer-Lemeshow(H-L)检验对列线图模型的拟合度进行验证。以P<0.05为差异有统计学意义。
结 果
1.两组患者一般资料及临床资料比较:低T3组年龄、慢性心衰、机械通气、肾脏替代治疗患者比例、SOFA评分、APSⅢ、WBC计数、NLR、SCr、Lac均显著高于非低T3组,T3、T4、FT4及氧合指数均显著低于非低T3组(P<0.05)。其他指标两组间比较差异均无统计学意义(P>0.05)。见表1。
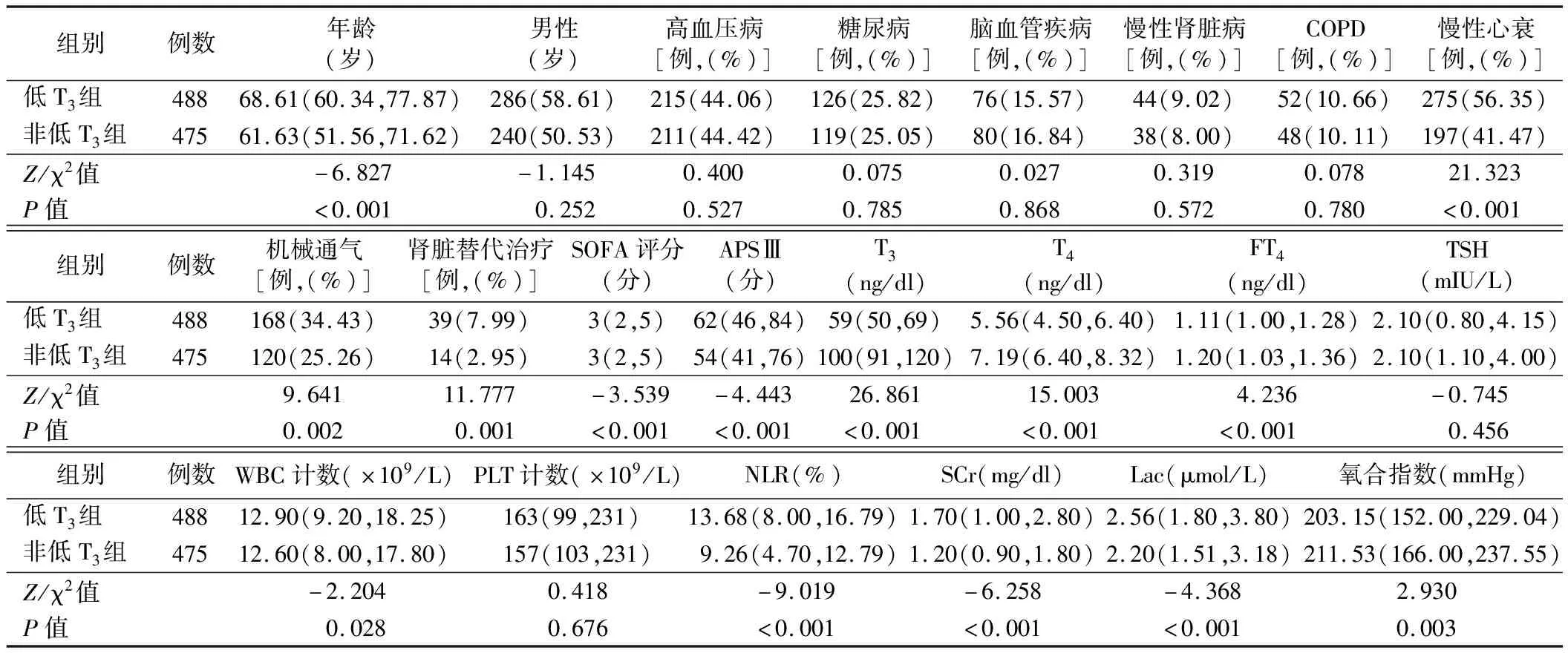
表1 两组患者一般资料及临床资料比较[M(P25,P75)]
2.两组患者预后情况比较:低T3组28 d死亡、365 d死亡、ICU死亡、院内死亡患者比例及入住ICU时间、住院时间均高于非低T3组(P<0.05)。见表2。
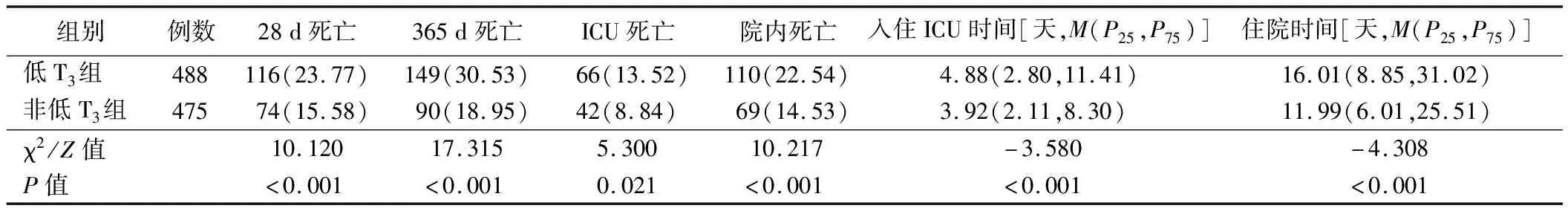
表2 两组患者预后情况比较[例,(%)]
3.血清T3水平与脓毒症患者死亡率的关系:Lowess曲线显示,T3水平越低,脓毒症患者28 d死亡率、365 d死亡率、ICU死亡率及院内死亡率越高。见图1。

图1 血清T3水平与脓毒症患者死亡率的Lowess曲线(A:28 d死亡率;B:365 d死亡率;C:ICU死亡率;D:院内死亡率)
4.脓毒症合并低T3综合征患者死亡的影响因素分析:多因素logistic回归分析结果显示,低T3水平、SOFA评分、APSⅢ及年龄均是脓毒症合并低T3综合征患者的独立危险因素(P<0.05)。见表3。血清T3水平每升高1 ng/dl,脓毒症合并低T3综合征患者死亡风险降低1%;SOFA评分每升高1分,死亡风险增加14.4%;APSⅢ每升高1分,死亡风险增加3.1%;年龄每增加1岁,死亡风险增加3.1%。
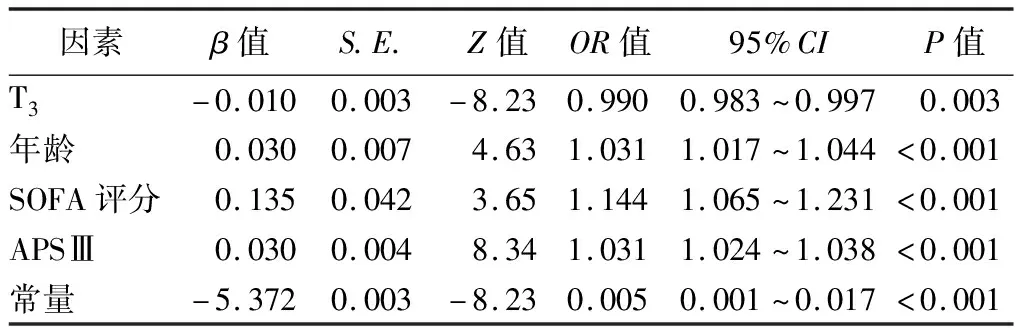
表3 脓毒症合并低T3综合征患者死亡影响因素的多因素logistic回归分析
5.预测模型的建立及验证:根据多因素分析结果,以T3、SOFA评分、APSⅢ及年龄构建预测模型,并生成列线图,见图2。绘制预测模型ROC曲线,敏感度为79.5%,特异度为70.1%,ROC曲线下面积(AUC)为0.806(95%CI0.774~0.838,P<0.05),优于各独立危险因素单独预测的效能,见图3。H-L检验结果显示χ2=12.80,P=0.119,提示模型拟合度良好,具备较高的预测价值,见图4。

图2 脓毒症患者28 d死亡的预测模型列线图
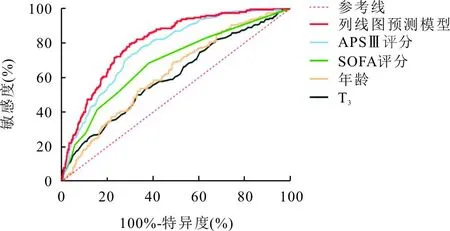
图3 脓毒症患者28 d死亡列线图预测模型及各危险因素单独预测的ROC曲线

图4 列线图预测模型校准曲线
讨 论
甲状腺激素在血液动力学和新陈代谢功能等方面起着重要作用。上世纪80年代,Wartofsky等[7]发现危重症患者通常伴随甲状腺激素水平的下降,提出了低T3综合征的概念,其典型改变为T3水平降低,T4、FT4及TSH血清水平降低或正常。研究表明,甲状腺激素水平降低可能是成人脓毒症患者死亡率的一个预测因素[8]。因此,早期认识低T3综合征,对于危重症患者严重程度的评估及临床治疗具有十分重要的意义。本研究基于重症医学大数据,回顾性分析发现入院T3水平与脓毒症患者预后密切相关,是反映其预后的良好生物标志物,联合年龄、SOFA评分、APSⅢ可进一步提高其预测效能。
结合既往研究发现,低T3与脓毒症患者死亡率之间的联系可能是复杂多样的。脓毒症引起的细菌毒素、炎性介质、细胞因子、微循环障碍等多种因素作用会造成甲状腺功能损伤以及甲状腺激素结合、转运障碍,使甲状腺激素水平降低,而低甲状腺激素水平可导致呼吸、循环、免疫等多个系统功能紊乱,最终引起多器官功能障碍综合征[9-10]。本研究中,低T3组患者在反映各个器官功能的SOFA评分及APSⅢ上得分更高,也证实了这一点。
脓毒症患者呼吸功能障碍的主要原因是肺泡表面活性物质减少,其机制包括炎症因子、细胞焦亡、氧化应激等原因造成肺泡上皮损伤,以及血管内皮损伤引起微血管渗漏等[11],而T3水平的降低不仅阻碍肺泡表面活性物质的生成[12-13],降低了其保护作用,还影响呼吸肌功能,引起呼吸肌无力,严重者可致呼吸衰竭[14]。本研究也表明,低T3组脓毒症患者的呼吸机使用率更高且氧合指数更低。
低T3综合征对脓毒症患者循环功能也有一定的影响。相关研究发现,低水平的甲状腺激素一方面减少了SERCA2a基因的表达,使受磷蛋白表达增加,细胞内钙离子再摄取障碍,心肌收缩减弱,引起心室结构和功能病变[15];另一方面使得血管平滑肌中一氧化氮生成减少,导致全身血管阻力增加[16],加重组织缺氧和灌注不足。在本研究中,低T3组患者Lac水平明显高于非低T3组,与既往研究结果相符。
甲状腺激素对机体免疫功能有着极其重要的作用。相关研究表明,甲状腺激素的降解可增加中性粒细胞中碘化物的浓度,增强中性粒细胞的吞噬活性[17]、刺激T淋巴细胞的活化和扩增[18]等,脓毒症患者由于免疫反应失调,细胞因子IL-6、肿瘤坏死因子(TNF)-α等大量分泌,既抑制了脱碘酶活性,减少T4向T3的转变,也直接抑制下丘脑-垂体-甲状腺轴,减少T3的分泌[19],使炎症级联反应进一步放大。因此,低T3综合征患者由于甲状腺激素水平的下降,合并脓毒症后,其死亡风险会明显增加。在本研究中,低T3组WBC计数和NLR较高也反映了这一点。
本研究亦具有一定的局限性:首先,本研究基于国外数据库,对国内患者的指导意义还需进一步探讨;其次,本研究为回顾性研究,只能直接获取现有的数据记录,无法确定用药等相关信息,使研究结果存在一定的偏倚风险;另外,虽然研究结果可以反映低T3综合征对脓毒症患者病情严重程度和死亡率之间存在相关性,但公共数据库中无游离三碘甲状腺原氨酸(FT3)、反三碘甲状腺原氨酸(rT3)的相关数据,因此未对以上指标进行分析;后续可增加变量,以进一步验证低T3综合征对脓毒症患者预后的影响。

