血清S100钙结合蛋白A12、可溶性晚期糖基化终末产物受体水平与维持性血液透析患者骨质疏松的相关性分析
梁冰 王萌萌 张靖华
维持性血液透析(MHD)是终末期肾病患者主要的有效治疗方法[1-3]。研究表明长期接受MHD的患者骨代谢会受到多种激素和细胞因子的共同调控,影响破骨细胞的分化和功能,从而诱导骨质疏松并对患者生活质量产生严重影响[4]。近年来,可溶性晚期糖基化终末产物受体(sRAGE)在骨组织领域的作用受到广泛关注[5],但其与MHD患者骨质疏松发生的关系鲜有报道。S100钙结合蛋白A12(S100A12)是一种酸性钙离子结合蛋白,主要由中性粒细胞、单核巨噬细胞分泌[6]。研究显示S100蛋白可与多种配体结合发挥不同作用,包括sRAGE[7]。基于以上,本研究拟通过检测MHD患者血清中sRAGE、S100A12的水平变化,探讨二者与骨质疏松的关系及临床意义。
对象与方法
1.对象:选取2020年1月~2022年6月在本院血透室治疗的MHD患者110例,其中男61例、女49例,年龄54~66岁,平均年龄(59.82±5.26)岁。按照年龄、性别随机分层选择同期在我院健康体检者50例为对照组,其中男23例、女27例,年龄53~65岁,平均年龄(59.54±5.50)岁。纳入标准:(1)均符合终末期肾脏疾病相关诊断标准[8];(2)接受MHD超过3个月。排除标准:(1)进行抗骨质疏松药物治疗(双膦酸盐、特立帕肽或雌激素药物);(2)腰椎骨折或手术史;(3)患有严重的心、脑、肝病或伴有精神疾病;(4)妊娠及哺乳期;(5)腹膜透析。本研究经我院伦理委员会审核通过,所有患者均签署知情同意书。
2.方法
(1)一般资料及临床资料收集:一般资料包括性别、年龄、BMI、透析龄。采用全自动生化仪测定所有受试者的尿素氮(BUN)、血肌酐(SCr)、白蛋白(Alb)、血钙、血磷水平;采用酶联免疫法检测全段甲状旁腺激素(iPTH)、血清sRAGE及S100A12表达水平。应用双能X射线骨密度仪测量患者跟骨骨密度,并使用T值表示。根据WHO标准[9],T值≤-2.5 g/cm2为骨质疏松,而T值在-1.0~-2.5 g/cm2之间为骨量减少,T值≥-1 g/cm2为骨密度正常。根据T值将110例MHD患者分为骨质疏松组(42例)及非骨质疏松组(68例;其中骨量减少62例、骨量正常6例)。
(2)MHD治疗:采用德国FX80飓风膜透析器对MHD患者进行连续性血液透析治疗,选取碳酸盐无糖透析液,液量为500 ml/min,血流量为250~300 ml/min,每3周进行1次透析,每次4~5 h。透析期间严格控制血糖及血压,保证低盐低蛋白饮食。
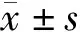
结 果
1.3组患者一般资料及临床资料比较:3组患者性别、年龄、BMI、透析龄比较差异均无统计学意义(P>0.05)。与对照组相比,非骨质疏松组与骨质疏松组患者血钙、血磷、骨密度、sRAGE水平均降低,iPTH、BUN、SCr、Alb、S100A12水平均升高(P<0.05)。与非骨质疏松组患者相比,骨质疏松患者血清中iPTH、S100A12水平升高,血磷、骨密度、sRAGE水平均降低(P<0.05)。见表1。
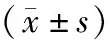
表1 3组患者一般资料及临床资料比较
2.MHD患者血清sRAGE与S100A12表达的相关性分析:Pearson相关分析结果显示,MHD患者血清sRAGE与S100A12表达呈负相关(r=-0.448,P<0.05)。
3.MHD患者血清sRAGE、S100A12与临床指标的相关性分析:Pearson相关分析结果显示,MHD患者血清sRAGE与血磷、骨密度均呈正相关,与iPTH呈负相关(P<0.05);血清S100A12与血磷、骨密度均呈负相关,与iPTH呈正相关(P<0.05)。见表2。
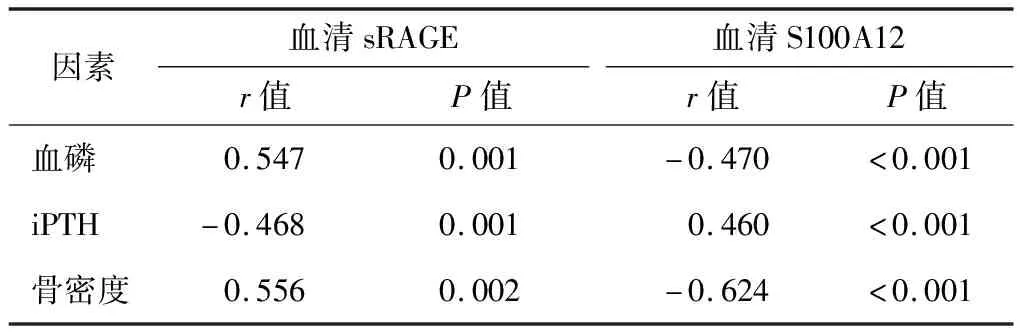
表2 MHD患者血清sRAGE、S100A12表达与临床指标的Pearson相关分析
4.血清sRAGE、S100A12水平对MHD患者骨质疏松的预测价值:ROC曲线分析结果显示,血清S100A12、sRAGE预测MHD患者骨质疏松的ROC曲线下面积(AUC)分别为0.845(95%CI0.764~0.907)、0.810(95%CI0.724~0.878),当S100A12的最佳截断值为25.46 ng/ml、sRAGE的最佳截断值为686.52 ng/ml时,对应敏感度分别为83.33%、73.81%,特异度分别为73.53%、77.94%;二者联合预测MHD患者骨质疏松的AUC为0.890(95%CI0.817~0.942),敏感度为76.19%、特异度为86.76%。
5.MHD患者发生骨质疏松的多重线性回归分析:以骨密度T值为因变量,以S100A12、sRAGE、iPTH、血磷为自变量,行多重线性回归分析,结果显示S100A12、sRAGE、iPTH均与骨质疏松发生有关(P<0.05)。见表3。
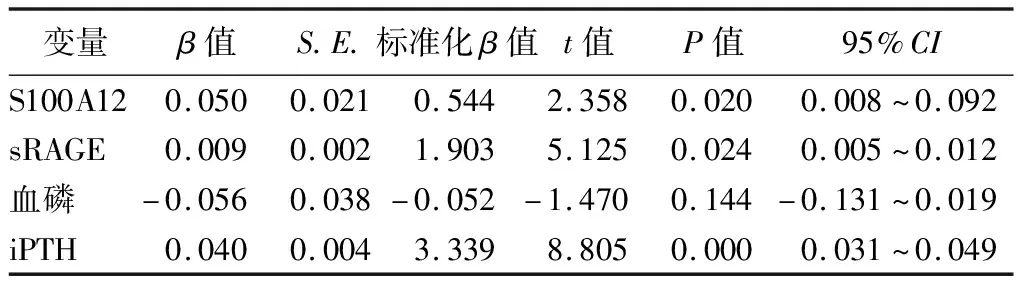
表3 影响MHD患者骨质疏松的多重线性回归分析
讨 论
慢性肾功能衰竭患者进行MHD会导致多种并发症,如感染、心血管疾病和骨质疏松症[10]。其中骨质疏松症是全身骨骼系统临床常见病[11]。目前,对患者发生骨质疏松的诊断通常采用影像学检查,但其存在费用较高、依从性较低等局限[12],因此寻找有效的血清学指标对疾病进行诊断具有重要意义。
sRAGE作为晚期糖基化终末产物受体(RAGE)的一种异构体,在机体内发挥的作用却与RAGE完全不同。相关研究报道,sRAGE在各种肾脏疾病中表达升高[13]。高俊等[5]研究表明,随着sRAGE表达水平逐渐降低,会造成患者骨量逐渐丢失,可作为临床骨质疏松症诊断的参考参数之一。在本研究中MHD患者血清sRAGE表达水平低于健康人群,且随着骨质疏松的发生sRAGE表达水平逐渐降低,提示sRAGE与MHD患者骨质疏松的发生、发展进程密切相关,其具体作用机制有待进一步完善试验方案并证实;MHD患者血清sRAGE表达与血磷、骨密度均呈正相关;ROC曲线分析结果显示,sRAGE表达水平预测MHD的AUC为0.810,对应的敏感度为73.81%,特异度为77.94%,表明sRAGE可在一定程度下预测MHD患者骨质疏松的发生,其可能作为诊断MHD患者发生骨质疏松的潜在指标。
S100A12属于S100家族,该家族与多种宿主免疫信号转导、细胞因子的产生过量及分泌有关,会导致全身炎症反应甚至继发性器官衰竭[14]。S100A12具有较强的钙离子亲和性,当机体出现感染或损伤时,S100A12可与钙离子结合,使其构象发生改变,进而发挥调控细胞迁移、伤口愈合、黏附、炎性细胞激活等多种细胞通路的作用[15-16]。目前已有多项研究结果表明血清中S100A12水平的升高与许多急性和慢性炎症疾病有关[17]。李惠琴等[18]研究结果表明,S100A12表达水平升高可促进软骨细胞的退行性改变,导致患者病情加重。此外,赵郁松等[19]研究结果表明,sRAGE可能通过与S100A12等配体结合,减轻炎症损伤。但目前尚不清楚sRAGE与S100A12是否可通过结合在MHD患者骨质疏松的发生中发挥作用。在本研究中,MHD患者S100A12表达水平较健康人群升高,且随着骨质疏松的发生其表达水平逐渐升高,表明S100A12与疾病的严重程度密切相关,其作用机制可能是因为S100A12表达水平升高,加速并刺激炎性因子的分泌,进一步增强局部免疫细胞的活性,使其不断增殖,强化了破骨细胞的活性,形成恶性循环[20],导致骨质疏松的发生。本研究进一步得到MHD患者血清S100A12、sRAGE表达与iPTH、血磷、骨密度均有相关性,提示S100A12、sRAGE表达异常可能导致患者机体内血磷、iPTH代谢异常,而iPTH可调节骨合成及代谢,在维持骨稳态中发挥重要作用,其代谢异常可能进一步导致骨质疏松的发生。本研究结果发现,血清sRAGE与S100A12表达水平呈负相关,提示S100A12、sRAGE可能通过某种负调控机制共同参与骨质疏松的发生、发展进程,推测S100A12可能通过与sRAGE结合,在MHD患者骨质疏松的发生发展中发挥作用,但具体作用机制尚不明确,有待进一步研究;ROC曲线分析结果显示,S100A12预测MHD的AUC为0.845,敏感度为83.33%,特异度为73.53%,与sRAGE二者联合预测MHD患者的AUC为0.890,敏感度为76.19%,特异度为86.76%,提示二者可能作为诊断MHD患者骨质疏松发生的血清标志物,且二者联合预测价值高于单一指标。多重线性回归分析结果显示,S100A12、sRAGE、iPTH均与MHD患者骨质疏松的发生有关,提示临床可密切检测上述异常表达指标,并及时给予治疗,降低骨质疏松的发生风险。
综上所述,MHD患者骨质疏松的发生与sRAGE、S100A12表达密切相关,sRAGE表达水平随着骨质疏松的发生而降低,S100A12的表达水平随着骨质疏松的发生而增加,二者呈显著负相关,且二者联合可作为早期诊断MHD患者骨质疏松的血清学指标,为临床预防和治疗MHD患者骨质疏松提供参考依据,具有重要的临床意义。

