终末期肾病患者心脏瓣膜钙化特点及其与25-羟维生素D缺乏的相关性
生玉平 马晓迎 杨星梦 刘烨 孙福云
据报道,终末期肾病(ESRD)患者心脏瓣膜钙化(CVC)的患病率为10%~55%[1]。CVC被认为是ESRD患者心血管死亡的独立预测因素[2-3]。ESRD患者较易发生维生素D缺乏,且与其心血管死亡密切相关[4]。目前仅有慢性肾脏病患者25-羟维生素D[25(OH)D]与CVC[5]、透析患者25(OH)D与腹主动脉钙化(AAC)[6]及ESRD患者25(OH)D与冠状动脉钙化[7]之间的独立关联报道。关于25(OH)D与CVC在ESRD患者中的报道较少,且两者之间的关系尚不明确。本研究主要比较ESRD患者主动脉瓣钙化(AVC)与二尖瓣钙化(MVC)相关因素的异同,并探讨25(OH)D与CVC的关系。
对象与方法
1.对象:2020年1月~2022年8月于我院治疗的年龄≥18岁ESRD患者。排除标准:(1)有甲状旁腺切除术史;(2)近期接受活性维生素D冲击治疗;(3)接受瓣膜置换术。本研究经我院医学伦理学委员会审核批准(2021-059-02),所有患者均签署知情同意书。
2.方法:收集所有患者的临床资料,包括年龄(高龄为年龄≥65岁)、性别、透析情况、透析龄、既往病史、血压、Hb、白蛋白(Alb)、低密度脂蛋白胆固醇(LDL-C)、血尿酸(SUA)、同型半胱氨酸(Hcy)、血钙、血磷、血镁、超敏C反应蛋白(hs-CRP)、全段甲状旁腺激素(iPTH)、碱性磷酸酶(ALP)及25(OH)D水平。在Alb<40g/L时对钙进行校正,校正钙(mmol/L)=血清总钙(mmol/L)+[40-白蛋白(g/L)]×0.02。25(OH)D缺乏定义为25(OH)D<15 ng/ml[8]。由技术熟练的同一医生应用彩色多普勒超声测量室间隔厚度(IVST)、左心室射血分数(LVEF),CVC定义为主动脉瓣、二尖瓣的瓣膜或瓣环出现1个或多个>1 mm的强回声[9]。采用腹部侧位X线片判定患者是否存在AAC。
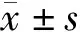
结 果
1.一般资料及分组情况:入选患者680例,排除甲状旁腺切除术者8例,近期接受活性维生素D冲击治疗者7例,资料不全者6例,拒签知情同意书者2例,最终纳入657例。其中女263例(40.0%),男394例(60.0%),年龄18~91岁,平均年龄(57.4±14.7)岁,中位透析龄24(13,48)个月;未透析357例(54.3%),血液透析174例(26.5%),腹膜透析126例(19.2%);原发性肾小球肾炎184例(28.0%),糖尿病肾脏疾病88例(13.4%),高血压肾病15例(2.3%),先天性多囊肾20例(3.0%),狼疮性肾炎7例(1.1%),梗阻性肾病7例(1.1%),病因不详336例(51.1%);合并冠心病314例(47.8%),合并糖尿病255例(38.8%);25(OH)D缺乏457例(69.6%);AAC 385例(58.6%);CVC 367例(55.9%,CVC组),其中AVC 281例(42.8%,AVC组)、MVC 158例(24.0%,MVC组)、AVC合并MVC 72例(11.0%),非CVC 290例(44.1%,非CVC组),非AVC 376例(57.2%,非AVC组),非MVC 499例(76.0%,非MVC组)。
2.CVC组和非CVC组患者临床资料比较:CVC组年龄、透析龄、Hb、hs-CRP、血磷、iPTH水平及高龄、透析治疗、冠心病、糖尿病、AAC、25(OH)D缺乏患者比例均高于非CVC组,Alb及25(OH)D水平均低于非CVC组(P<0.05),而两组患者其余资料比较差异均无统计学意义(P>0.05)。见表1。
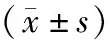
表1 CVC组和非CVC组患者临床资料比较
3.AVC组和非AVC组患者临床资料比较:AVC组年龄、透析龄、Hb、hs-CRP、血磷、iPTH水平及高龄、透析治疗、冠心病、糖尿病、AAC、25(OH)D缺乏患者比例均高于非AVC组,Alb及25(OH)D水平均低于非AVC组(P<0.05),而两组患者其余资料比较差异均无统计学意义(P>0.05)。见表2。
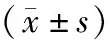
表2 AVC组和非AVC组患者临床资料比较
4.MVC组和非MVC组患者临床资料比较:MVC组女性、高龄、透析治疗、冠心病、糖尿病、AAC、25(OH)D缺乏患者比例及年龄、透析龄、hs-CRP、血磷、iPTH、LDL-C水平均高于非MVC组,Alb及25(OH)D水平均低于非MVC组(P<0.05),而两组患者其余资料比较差异均无统计学意义(P>0.05)。见表3。
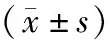
表3 MVC组和非MVC组患者临床资料比较
5.ESRD患者CVC的影响因素分析:单因素logistic回归分析结果显示,年龄、高龄、透析龄、透析治疗、冠心病、糖尿病、Alb、hs-CRP、血磷、iPTH、AAC、25(OH)D、25(OH)D缺乏、LVEF均为ESRD患者CVC的影响因素(P<0.05),见表4。以是否发生CVC为因变量,将CVC组和非CVC组比较P<0.1的指标作为协变量纳入多因素logistic回归分析,结果显示,年龄、透析龄、冠心病、糖尿病、hs-CRP、血磷、iPTH、AAC是ESRD患者CVC的独立危险因素,Alb、25(OH)D是其独立保护因素(P<0.05),见表5。
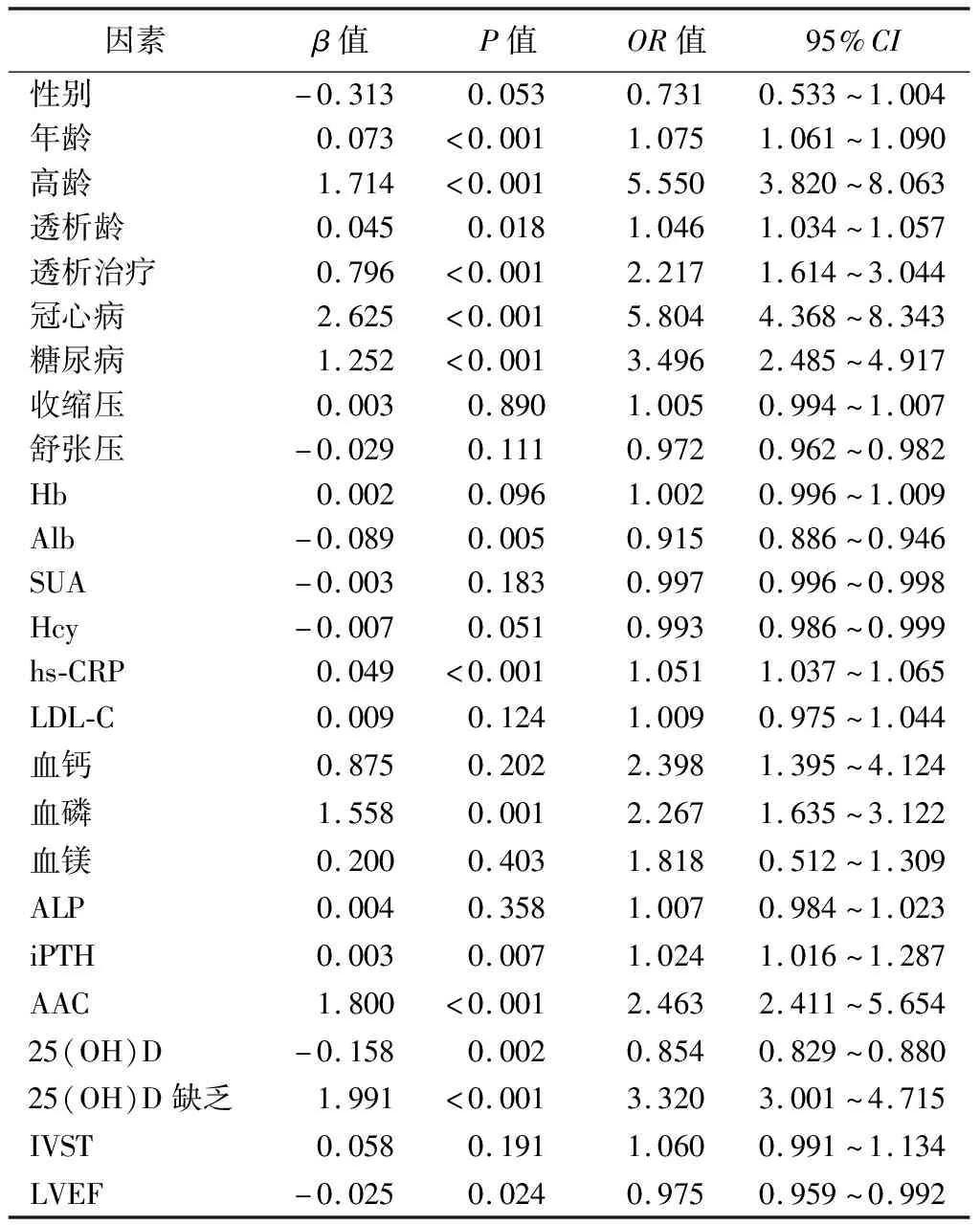
表4 ESRD患者CVC影响因素的单因素logistic回归分析
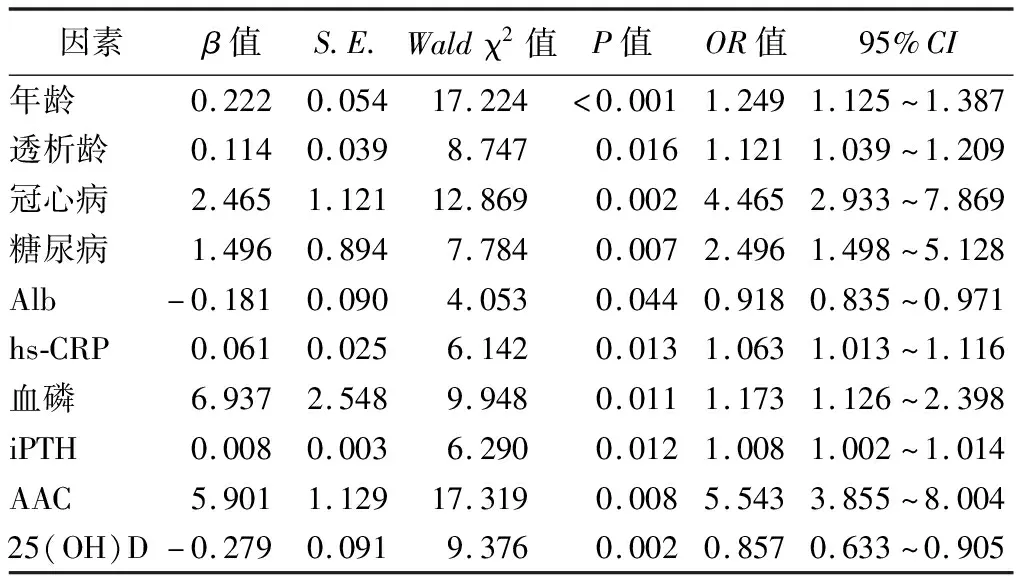
表5 ESRD患者CVC影响因素的多因素logistic回归分析
6.25(OH)D对ESRD患者CVC的预测价值:ROC曲线分析结果显示,25(OH)D预测ESRD患者CVC的ROC曲线下面积为0.722 (95%CI0.681~0.763,P<0.001),最佳截断值为12.8 ng/ml,敏感度为72.3%,特异度为76.4%。
讨 论
尽管CVC的患病率低于血管钙化[10],但CVC与ESRD患者的动脉粥样硬化及钙化、左心室肥厚等均有关[11]。据报道,ESRD患者AVC和MVC的患病率分别为30%~55%和10%~52%[12]。本研究中CVC的患病率为55.9%,低于AAC的58.6%,其中AVC占42.8%,MVC占24.0%。目前AVC与MVC的相关因素是否一致存在争议。Avila-Diaz等[13]在腹膜透析患者中发现AVC与MVC缺乏相关性,认为MVC与传统危险因素及生化指标变化有关,而AVC与循环机械压力有关。但也有研究指出ESRD患者AVC与MVC发生的机制及危险因素均相同[14]。本研究结果表明,年龄、透析治疗、透析龄、冠心病、糖尿病、AAC、Alb、hs-CRP、血磷、iPTH、25(OH)D均是AVC及MVC的相关因素,此外,Hb与AVC可能相关,LDL-C与MVC也可能相关。
多种因素已被证明与ESRD患者的CVC有关[15],包括典型因素如年龄、高血压、机械压力、糖尿病、血脂异常及非典型因素如透析龄、矿物质和骨代谢紊乱、炎症和营养不良。本研究不仅发现年龄、透析龄、冠心病、糖尿病、AAC、hs-CRP、血磷及iPTH是ESRD患者CVC的独立危险因素,还发现Alb、25(OH)D是其独立保护因素,且25(OH)D对ESRD患者CVC有一定预测价值。ESRD患者维生素D缺乏促进CVC的机制尚不明确[16]。主要机制是维生素D可能参与了瓣膜间质细胞(VICs)向成骨细胞样细胞的分化[17]。Schmidt等[18]在小鼠中发现低维生素D饮食通过促进VICs分化为成骨细胞样细胞加速了CVC,同时还发现维生素D受体缺乏可通过上调成骨细胞转录因子促进CVC。其次是维生素D缺乏可促进炎症活动[19],而炎症会促进CVC[20]。此外,有研究报道维生素D缺乏可通过降低钙化抑制剂如胎球蛋白A和基质Gla蛋白的含量及抑制klotho来促进CVC[21]。此外有组织学和基因表达分析结果表明,骨相关蛋白如骨桥蛋白、骨形态发生蛋白及Runt相关转录因子2/核心结合因子α1在病理心脏瓣膜中表达[22],而维生素D可调节上述蛋白因子[23]。
综上,ESRD患者AVC与MVC的相关因素各有异同,25(OH)D缺乏是ESRD患者CVC的独立危险因素。本研究存在如下局限性:首先,本研究为单中心横断面研究,难以得出明确结论和因果关系;其次,采用超声检查判断心脏瓣膜钙化,缺乏定量分析;再次,未探讨患者容量平衡与否与心脏瓣膜钙化是否相关;最后,吸烟、用药等因素未纳入。期待未来有更多的大规模研究来证实监测ESRD患者的25(OH)D水平有助于预测其CVC风险。

