高产HEMF酵母对酱油品质的提升
王瀚 叶鹏 李婉宁 侯丽华

DOI:10.3969/j.issn.1000-9973.2024.03.007
引文格式:王瀚,叶鹏,李婉宁,等.高产HEMF酵母对酱油品质的提升[J].中国调味品,2024,49(3):39-45,67.
WANG H, YE P, LI W N, et al. Improvement of soy sauce quality by yeast with high HEMF productivity[J].China Condiment,2024,49(3):39-45,67.
摘要:酱油风味物质中的4-羟基-2(5)-乙基-5(2)-甲基-3(2H)-呋喃酮(HEMF)是酱香风味贡献的主要成分。假丝酵母(Candida versatilis)(以下简称C酵母)是酱油发酵过程中产HEMF的重要微生物,文章使用能耐受高浓度HEMF的新菌株C-1、C-2、C-3。经过随机扩增多态DNA实验(RAPD)验证了3株优良菌株与出发菌株基因有所差异,证明基因重组成功。将其应用于发酵并进行对比分析,研究发现,C-1与出发菌株相比,氨氮和全氮含量分别增加3.20%和7.20%,HEMF含量增加29.40%。通过感官评价,酱香味有所提升。生物胺总含量低于1 000 mg/L,氨基甲酸乙酯含量低于20 μg/L,保证了酱油的安全性。综上,高产HEMF酵母提高了酱油的品质。
关键词:酱油;酵母菌;基因组重排;4-羟基-2(5)-乙基-5(2)-甲基-3(2H)呋喃(HEMF);酱香
中图分类号:TS264.21 文献标志码:A 文章编号:1000-9973(2024)03-0039-07
Improvement of Soy Sauce Quality by Yeast with High HEMF Productivity
WANG Han, YE Peng, LI Wan-ning, HOU Li-hua*
(School of Food Science and Engineering, Tianjin University of Science and
Technology, Tianjin 300457, China)
Abstract: 4-Hydroxy-2(5)-ethyl-5(2)-methyl-3(2H)-furanone (HEMF) in soy sauce flavor substances is the main component contributing to the flavor of soy sauce. Candida versatilis (hereinafter referred to as C yeast) is an important microorganism producing HEMF during soy sauce fermentation. In this paper, the new strains C-1, C-2 and C-3 that can tolerate high concentration of HEMF are used. After random amplified polymorphic DNA (RAPD) experiments, it is confirmed that the genes of the three excellent strains are different from those of the starting strain, which proves that the gene recombination is successful. They are applied to fermentation and comparative analysis, and it is found that compared with the starting strain, the content of ammonia nitrogen and total nitrogen of C-1 increases by 3.20% and 7.20% respectively, and the content of HEMF of C-1 increases by 29.40%. Through sensory evaluation, it is found that the flavor of soy sauce is improved. The total biogenic amine content is less than 1 000 mg/L, and the ethyl carbamate content is less than 20 μg/L, which ensures the safety of soy sauce. In conclusion, the yeast with high HEMF productivity improves the quality of soy sauce.
Key words:soy sauce; yeast; genomic recombination; 4-hydroxy-2(5)-ethyl-5(2)-methyl-3(2H) furanone (HEMF); soy sauce aroma
收稿日期:2023-09-06
基金項目:国家自然科学基金项目(31401678);企业科技特派员项目(21YDTPJC00650)
作者简介:王瀚(1996—),男,硕士,研究方向:食品营养。
*通信作者:侯丽华(1974—),女,教授,博士生导师,博士,研究方向:食品科学、食品营养与安全。
酱油已有2 000多年的历史[1]。现今我国酱油产业规模巨大,李松[2]通过市场调查发现,2014年我国酱油产量已经达到938.8万吨,更加证明了酱油在我国调味品中的地位之高,但随着人们日益增长的美好生活的需要,人们已经不满足于酱油的生产额达到日常生活所需要的量,普通酱油不再吸引人,大家逐渐开始追求一些高质量的酱油,如具有吸引人的香味(果香味、焦糖味等)。市面上一部分酱油无法满足这样的条件,这也间接导致酱油产业有所停滞。而HEMF是酱香型酱油主要的香味物质,构建能高产HEMF的菌株是解决该问题的关键因素[3]。
微生物育种是一种新的人工选择技术,旨在改变微生物的遗传组成,以造福植物或动物宿主[4-7],基因组重排技术结合了传统诱变技术和细胞融合技术,是一项对整个微生物基因组重排的新型育种技术。基因组重排技术通过多亲本原生质体递归融合,可以使工程菌快速获得多样复杂的优良表型,是一种常用的微生物育种方法[8-11]。
本研究将基因重组后能耐受高浓度HEMF的菌株应用于酱油发酵,提升酱油的品质,为工业微生物的构建提供了有效途径。
1 材料与方法
1.1 材料与试剂
已构建的耐受高浓度HEMF的3株优良菌株C-1、C-2、C-3。天津市利民公司供应的优质大豆、炒小麦。HEMF、磷酸缓冲液(pH 7.0)、硫代硫酸钠、山梨醇、甲醛、溴甲酚绿-甲基红混合指示剂、磷酸二氢钾、乙醇、酒石酸钾钠、3,5-二硝基水杨酸(均为分析纯)、酵母基因组提取试剂盒:北京索莱宝科技有限公司。
1.2 培养基及溶液
YPD培养基[12]:由酵母提取物、无水葡萄糖、蛋白胨和琼脂粉组成,其中酵母提取物的比例为1%,蛋白胨的比例为2%,固体另加1.5%琼脂粉;生理盐水:将0.90 g氯化钠溶解于99.1 mL蒸馏水中;EDTA·2Na:将0.05 mol/L EDTA(18.60 g EDTA·2Na)加入到蒸馏水中,使其达到1 000 mL,然后使用NaOH调节pH到7.5;ST溶液:由1 mol/L山梨醇和0.01 mol/L Tris-HCl组成,pH调至7.4;STC溶液:将0.01 mol/L CaCl2加入到ST溶液中;PTC溶液:35% PEG-6000、0.01 mol/L CaCl2、0.01 mol/L Tris-HCl(pH调至7.4);TE溶液(pH 8.0):200 mL 50 mmol/L Tris·HCl(pH 8.0),2 mL 0.5 mol/L EDTA(pH 8.0)。混合后,定容至1 000 mL。
1.3 仪器与设备
PB-10型实验室pH计 美国Sartorius公司;立式压力蒸汽灭菌器 日本雅马拓科技有限公司;SQP型分析天平 赛多利斯科学仪器(北京)有限公司;SH220N型石墨消解仪 济南海能仪器有限公司;ZDDN-11型自动凯氏定氮仪 浙江托普仪器有限公司;超高速冷冻离心机 美国Thermo Fisher Scientific公司;T5型自动电位滴定仪 梅特勒-托利多仪器(上海)有限公司;超净工作台 苏净集团安泰公司;PCR仪 美国Bio-Rad公司;QP-Ultra 2010气相色谱-质谱联用仪 日本岛津公司。
1.4 方法
1.4.1 优良菌株基本性能的测定
1.4.1.1 遗传稳定性的测定
在含1.75% HEMF的YPD固体培养基中,对获得的优良菌株进行多次传代,筛选出能稳定遗传HEMF耐受性的菌株。
1.4.1.2 RAPD验证
使用酵母基因组提取试剂盒提取基因,使用表1中的7個随机引物,在表3的PCR条件下验证筛选菌株和原始菌株之间的DNA差异。发现只有随机引物5可以扩增原始菌株和第三轮基因组重排获得的酵母菌株之间的不同RAPD条带。因此,选择使用随机引物5进行RAPD扩增实验。将原始菌株和新构建的菌株的全基因组DNA作为模板,并使用随机引物5进行扩增。PCR反应系统见表2。
1.4.1.3 优良菌株生长曲线的测定
从固体培养基中选择单个菌落保存优良的酵母菌株,然后接种到20 mL YPD液体培养基中,在30 ℃、180 r/min的条件下,摇瓶过夜。为了比较出发酵母和优良菌株在不同浓度的HEMF液体培养基中的耐受性和生长差异,将两种液体培养基分别添加5%的接种物,并在30 ℃、180 r/min的条件下培养一夜,每4 h测量一次OD660 nm。
1.4.2 新菌株应用于酱油发酵
在进行发酵前1 d用开水浸泡大豆,待大豆浸泡吸水后,过滤掉水分,按照大豆∶炒小麦为6∶4的比例混入炒小麦,再于121 ℃灭菌30 min并蒸熟,于30 ℃恒温发酵120 d。
盐水的配制:配制盐分浓度为18%的盐水,盐水体积为总物料质量的2.2倍。将172.8 g食用盐放入660 g自来水中,使其混合并完全融合。待温度达到室温后,再将300 g物质和盐水混合,继续进行发酵。
将曲料与盐水混合均匀后,用擀面杖将其搅拌均匀,然后用保鲜膜、牛皮纸和棉线将发酵罐密封,定期搅拌,以确保曲料与盐水完全混合,并添加1.0×106 CFU/g的C酵母和3轮基因重排构建的酵母。每隔5 d搅拌酱醪,使微生物和酱醪充分接触混匀,提高发酵效果(注:发酵全程尽可能保证无菌操作,防止环境中微生物混入而影响实验结果[13])。
在发酵完成后,将其置于8 500 r/min的离心机中,经过20 min的离心处理,再用6层纱布过滤,即可获得头油(即本实验中的成品酱油)。
共设置了8个发酵组,见表4。
1.4.3 氨基酸态氮含量的测定
氨基酸态氮含量根据GB 5009.235—2016[14]的方法进行测定。
1.4.4 全氮含量的测定
全氮含量根据GB 5009.235—2016的方法进行测定。
1.4.5 还原糖含量的测定
还原糖含量根据DNS法测定。
1.4.6 风味物质的测定
使用SPME-GC-MS技术[15],采用固相微萃取和气质结合的方式对样品进行检测。通过软件进行手动积峰并进行整合和对比质谱仪记载的质谱图与检索数据库系统给出的标准质谱图,检测出相似度超过80%的化学物质,通过定性分析方法,并使用面积归一化法测算出其相应浓度,以此来鉴定风味化学物质。
1.4.7 生物胺含量的测定
根据GB 5009.208—2016[16]的规定,酱油中8种生物胺的数量可以通过流动相A(乙腈)和流动相B(超纯水)的比较来确定。
1.4.8 氨基甲酸乙酯的测定
酱油中氨基甲酸乙酯按照GB 5009.223—2014[17]的方法测定。
2 结果与分析
2.1 优良菌株基本性能的测定
2.1.1 优良菌株的RAPD验证
对本研究3轮基因组重排构建的3株酵母菌和出发菌株C酵母进行RAPD验证,结果见图1。
注:泳道1代表Marker,泳道2代表出发菌株,泳道3代表C-1,泳道4代表C-2,泳道5代表C-3。
随机扩增多态性DNA(RAPD)可以有效地检测微生物中基因突变所导致的DNA多样性[18],其原理是通过将不同长度的DNA片段随机分配到10 bp的靶模板上,然后根据DNA片段的长度和数量来评估DNA的多态性,并且可以检测出相似菌株基因组DNA序列之间的微小差异,从而更好地进行分析。由图1可知,所构建的菌株与出发菌株有明显的差异性扩增条带,可以证明基因组重排的有效性。
2.1.2 优良菌株遗传稳定性的验证
使用YPD固体平板和含有1.75% HEMF的YPD固体平板,对出发菌株、3轮基因重排构建的菌株C-1、C-2、C-3进行连续传代培养,结果见图2。
由图2可知,将4种菌株同时划线培养在普通YPD培养基和含有1.75% HEMF的YPD培养基中,出发菌株C酵母只能在YPD培养基中生长,不能在含有1.75% HEMF的YPD培养基中正常生长。而进行了3轮基因组重排的菌株均能在YPD平板和含有1.75% HEMF的YPD培养基中正常生长,说明构建的菌株可以比较稳定地遗传对HEMF耐受的优良性状。
2.1.3 优良菌株的生长特性分析
取1.0×106 CFU细胞量接种到含有1.75% HEMF的液体YPD培养基中,放入30 ℃、转速180 r/min的摇床培育,每隔4 h测量一次660 nm波长下各菌液的吸光度值,最终得到的生长曲线见图3。
C-2、C-3酵母的生长曲线
genome recombination
由图3可知,出发菌株C酵母在含有1.75% HEMF的YPD液体培养基中始终无法生长,而3轮基因组重排获得的菌株C-1、C-2、C-3均可以经历迟缓期、对数期、稳定期,3株酵母在16 h左右进入对数期,28 h增加速度变慢进入稳定期,分析生长曲线可知,在含有1.75% HEMF的YPD培养基中,3轮基因组重排后的3株酵母进入对数期的时间虽然晚了近4 h,但是与出发菌株相比,對HEMF的耐受性均有所提高,其底物也会更多地被转化成HEMF。
2.2 优良菌株应用于酱油发酵
2.2.1 氨基酸态氮含量的测定
酵母发酵所得酱油中氨基酸态氮含量的测定结果见图4。
由图4可知,氨基酸态氮含量在前期迅速增长,而后期整体呈现缓慢增长的趋势。这是因为酱油醪在发酵初期,其中的酶系统,特别是蛋白酶肽酶活性极强,大部分蛋白质大分子都被有效降解,从而使得氨基酸态氮含量迅速增长。在发酵酿造初期,盐水浓度高达18%,这使得可溶性氮在渗透压的影响下被曲霉溶解,从而导致酱油醪中氨基酸态氮含量迅速提高。然而,伴随着发酵酿造进入后期,整个发酵系统的蛋白酶活性逐渐减弱,氨基酸态氮含量变化不大。
在120 d的发酵酿造工艺中,加入优良酵母菌C-1的酱油的2-1发酵组中氨基酸态氮含量最高,达到0.959 6 g/dL,相比出发菌株提高了3.20%。而且与工艺一相比,工艺二的氨基酸态氮含量更高,但是两种发酵工艺的氨基酸态氮总体水平相差不大。经过发酵处理,各个发酵组中氨基酸态氮含量均超过0.80 g/dL,满足国标GB 18186—2000中特级酱油的质量要求。
2.2.2 全氮含量的测定
酵母发酵所得酱油中全氮含量的测定结果见图5。
由图5可知,在整个发酵酿造过程中,所有发酵酿造组的全氮含量变化大致相同:前期稳步增加,中期快速增加,后期增长缓慢甚至停滞。在发酵初期,蛋白酶活性较强,大豆中的蛋白质被溶解,导致全氮含量迅速增加。随着发酵过程的进行,酵母等细胞的增殖会消耗大量氮源,而美拉德反应则会使发酵系统中的一些含氮物质被用于反应,从而导致后期出现下降的趋势。
发酵所得的酱油中,工艺二的2-1发酵组中全氮含量最高,为1.695 g/dL,高于添加了出发菌株C酵母的发酵组(7.20%),并且工艺二酱油的全氮含量整体高于工艺一酱油。
2.2.3 还原糖含量的测定
酵母发酵所得酱油中还原糖含量的測定结果见图6。
由图6可知,随着发酵的进行,还原糖含量迅速下降。工艺二的情况是由于酵母的加入时间较晚,导致原料在发酵初期受到葡萄糖淀粉酶的作用,迅速分解,从而使还原糖含量迅速升高。后期还原糖含量迅速下降是由于在高浓度盐水的作用下,酶活性逐渐降低,原料分解变慢。当酵母菌加入时,它们可以利用还原糖作为底物,产生一系列独特的风味物质,从而迅速降低还原糖含量。而且随着发酵的进行,整个环境的pH值也有所降低,酵母菌等微生物的活动受到抑制,最终还原糖含量降低缓慢。
两种发酵工艺的酱油中,添加了优良酵母菌株的发酵组中还原糖含量均低于添加了出发菌株C酵母的发酵组。其中工艺二的2-1发酵组还原糖含量最低,为1.523 5 g/dL,工艺一酱油的还原糖含量整体低于工艺二酱油。
2.2.4 铵盐含量的测定
酵母发酵所得酱油中铵盐含量的测定结果见图7。
蛋白质发酵过程中产生的异味使得酱油产品中的铵盐含量容易超出GB 18186—2000《酿造酱油》的要求,并且最高浓度不能达到氨基酸态氮的30%。由图7可知,所有发酵产品均符合国家标准的要求,因此必须严格执行这一规定。
2.2.5 风味物质的测定
在酱油发酵酿造工艺中,最主要的香味成分是醇类物质,而α-酮酸则是形成高级醇的关键中间体,它们可以与异丁醇、异戊醇、甲硫醇和2-苯基乙醇等物质相互作用,从而产生独特的香味。
邢爽等[19]的研究结果表明在pH适中的前提下,假丝酵母可以产生更多的酯类物质,而这些物质不会进一步参加反应或者分解,可以使酱油中酯类物质稳定存在并提高酱香的风味[20]。
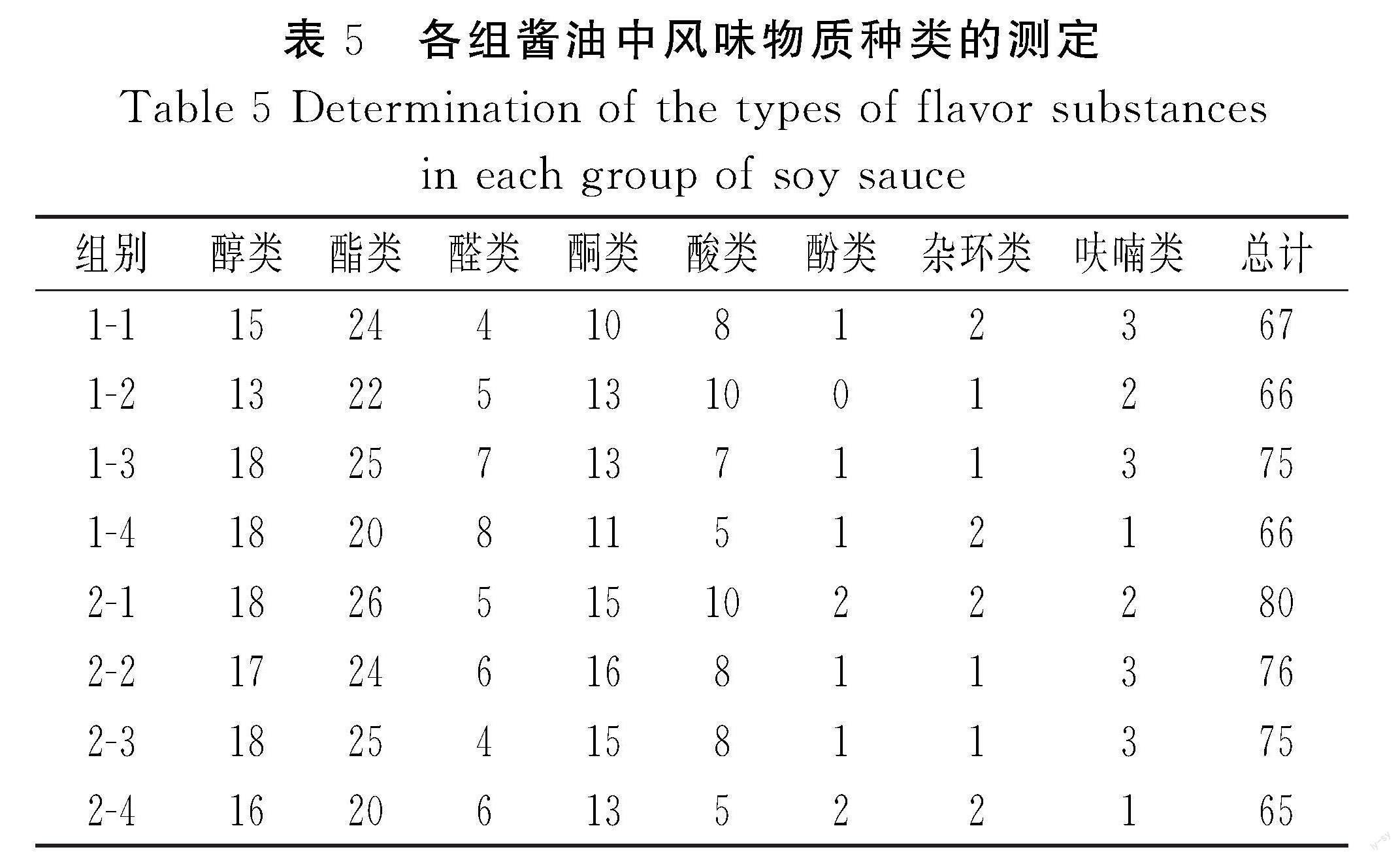
由表5可知,醇类、酸类、醛类、酯类、酮类含量较多,相对总含量达到90%左右。杂环类、呋喃类、酚类含量较少。在两组发酵酱油中,3株优良酵母菌株发酵组的酸类和酯类含量高于出发菌株C酵母发酵组。两种发酵工艺相比,添加优良菌株相比对照组增加了许多风味物质,其中发酵组2-1相比2-4增加了15种不同的风味物质。2-1发酵组的酯类含量也显著增加,达到26种,这表明45 d的酵母添加对酱油发酵中酯类的产生具有重要影响。同时证明了添加构建菌株可以改善酱油的风味(工艺二发酵组中的4组酱油风味物质种类最多)。
2.2.6 HEMF的测定
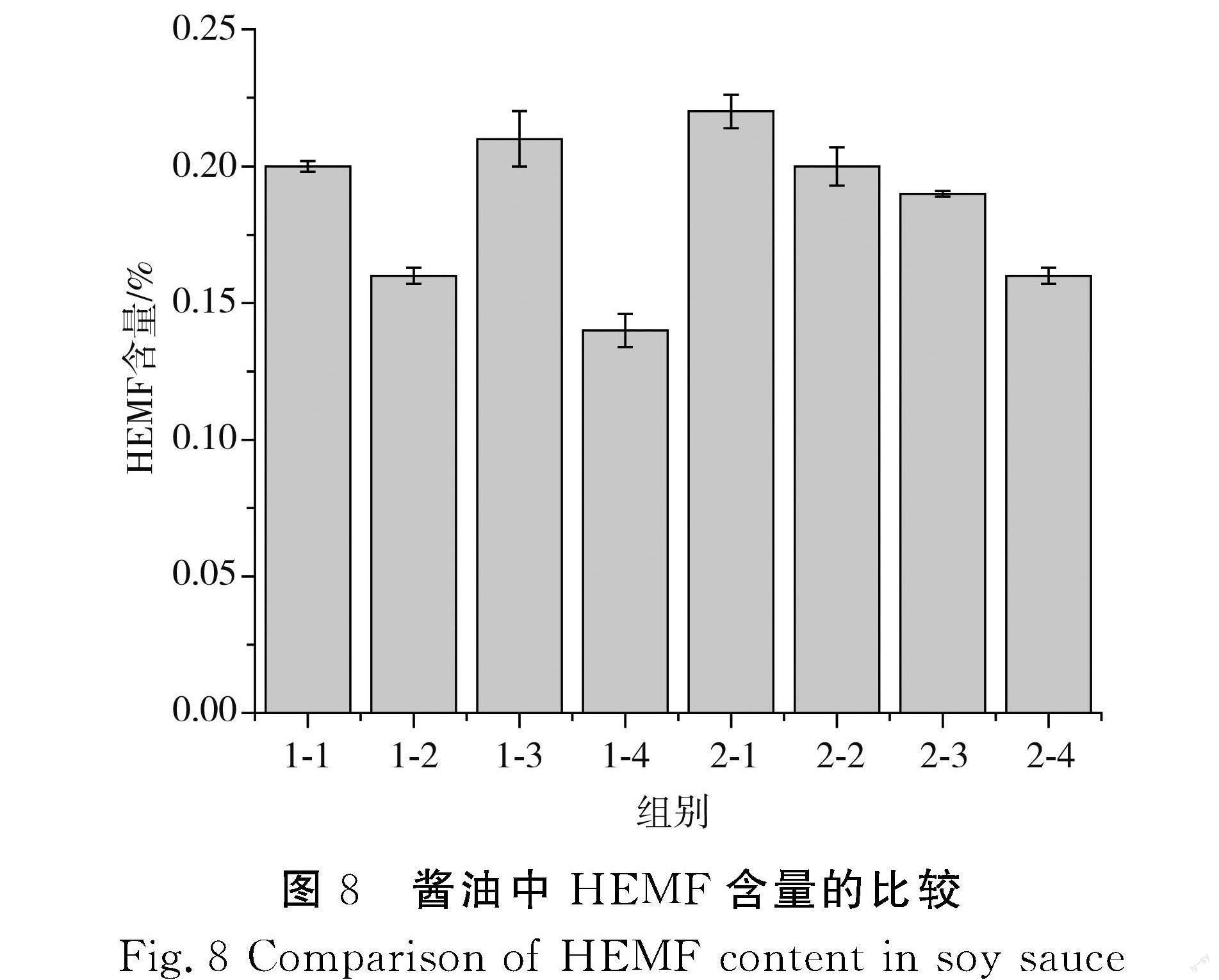
酵母发酵所得酱油中HEMF含量的测定结果见图8。
由图8可知,添加构建酵母的发酵组在相同原料比例的条件下HEMF含量高于添加出发菌株C酵母的发酵组,证明构建酵母在相同原料下可以产生更多的HEMF。最高为工艺二添加酵母C-1菌株的2-1发酵组,HEMF含量从0.17%提高到0.23%,增幅达到29.40%,表明原料中更多的戊糖与磷酸盐发生非酶促反应并形成HEMF。
2.2.7 生物胺含量的测定
本研究对酱油中可能存在的有害物质生物胺进行了检测,发酵组酱油样品中8种生物胺的含量和总含量测定结果见图9。
by different yeasts
我国尚未对酱油中生物胺的含量作出明确规定,但欧洲食品安全局(EFSA)则严格规定酱油中生物胺总含量不得高于1 000 mg/L,以确保消费者的安全。
在发酵组中,色胺的含量为4.29~10.66 mg/L,苯乙胺的含量为1.53~10.39 mg/L,腐胺的含量为1.74~28.12 mg/L,尸胺的含量为22.26~42.78 mg/L,酪胺的含量为65.06~188.14 mg/L,亚精胺的含量为7.77~9.54 mg/L,精胺的含量为3.74~13.30 mg/L。
由图9可知,经过本次实验,所有酱油的生物胺总量低于250 mg/L[21-22],表明构建的优良酵母菌株不会对人体健康造成潜在的危害。
2.2.8 氨基甲酸乙酯含量的测定
本研究还对酱油中可能存在的有害物质氨基甲酸乙酯进行了测定,酱油中氨基甲酸乙酯含量见表6。
由表6可知,所有发酵组均检测出了微量的氨基甲酸乙酯,但是它们的含量均小于20 μg/L(由联合国粮农组织推荐的最大可检出量)。但是添加了构建优良菌株的发酵组略高于添加了C酵母的发酵组。原因可能是精氨酸、尿素等作为氨基甲酸乙酯合成的前体物质被转化率更高[23-24]。
2.2.9 感官评价
在相同的灭菌条件(121 ℃蒸汽灭菌,时间10 min)下处理所得的酱油,感官评价人员从酱油的焦糖味、果香味、烟熏味、酒香味、碳烤味5个方面对这两种工艺的酱油进行风味感官评价,结果见图10。
通过对添加不同酵母菌发酵酱油的风味进行感官评价,由图10可知,添加优良酵母菌株C-1、C-2、C-3的发酵组果香味和焦糖味得分高于对照组,其中发酵组2-1的果香味得分最高,证实了随着HEMF含量的增加,酱油的风味得到了有效的改善。从焦糖味来看,2-1发酵组的焦糖味最高,而构建菌株发酵组整体上高于对照组。从葡萄酒风味和烟熏指数来看,所有发酵组的得分普遍不高。
上述研究结果表明,添加优良酵母菌株能够有效提高酱油的焦糖味与果香味,与HEMF含量呈正相关,有助于提高酱油的酱香风味。其中优良菌株C-1在各项指标上均优于其他菌株,为最优菌株。
3 结论
将出发菌株C酵母和优良菌株应用于酱油发酵。研究表明,添加构建的菌株可使酱油发酵中酸酯种类丰富度高于C酵母酱油,发酵组2-1的HEMF含量比对照组提高29.40%。根据酱油发酵过程中氨基酸态氮含量、全氮含量、感官评分等指标的测定结果,所构建的优良菌株能够提高酱油的整体品质。同时对酱油中的有害物质生物胺和氨基甲酸乙酯进行了测定,其含量均在允许范围内,表明用优良菌株发酵酱油是安全的。此外,发现工艺二在第45天添加酵母更有利于风味物质的形成,有助于增加具有水果味和焦糖味的HEMF的含量,并能进一步增强酱油的整体风味。总的来说,C-1为最优酱油发酵菌株。
参考文献:
[1]ZHU Y, TRAMPER J. Koji—where East meets West in fermentation[J].Biotechnology Advances,2013,31(8):1448-1457.
[2]李松.市售发酵酱油品质分析及模式识别研究[D].长春:吉林农业大学,2015.
[3]WANG X J, GUO M Y, SONG H L, et al. Characterization of key aroma compounds in traditional Chinese soy sauce through the molecular sensory science technique[J].LWT-Food Science and Technology,2020,128:109413.
[4]FENG J, ZHAN X B, ZHENG Z Y, et al. New model for flavour quality evaluation of soy sauce[J].Czech Journal of Food Sciences,2013,31(3):292-305.
[5]WAN S P, WANG C L, HOU L H, et al. Effect of adding salt-tolerant microorganisms on the flavor of soy-sauce mash[C]//2011 International Conference on Remote Sensing, Environment and Transportation Engineering,2011:7500-7502.
[6]MACHIDA M, ASAI K, SANO M, et al. Genome sequencing and analysis of Aspergillus oryzae[J].Nature,2005,438(7071):1157-1161.
[7]KAEWKROD A, NIAMSIRI N, LIKITWATTANASADE T, et al. Activities of macerating enzymes are useful for selection of soy sauce koji[J].LWT-Food Science and Technology,2018,89:735-739.
[8]UEHARA K, WATANABE J, MOGI Y, et al. Identification and characterization of an enzyme involved in the biosynthesis of the 4-hydroxy-2(or 5)-ethyl-5(or 2)-methyl-3(2H)-furanone in yeast[J].Journal of Bioscience and Bioengineering,2017,123(3):333-341.
[9]SUGAWARA E, OHATA M, KANAZAWA T, et al. Effects of the amino-carbonyl reaction of ribose and glycine on the formation of the 2(or 5)-ethyl-5(or 2)-methyl-4-hydroxy-3(2H)-furanone aroma component specific to miso by halo-tolerant yeast[J].Bioscience Biotechnology & Biochemistry,2007,71(7):1761-1763.
[10]GUO J, LUO W, WU X M, et al. Improving RNA content of salt-tolerant Zygosaccharomyces rouxii by atmospheric and room temperature plasma (ARTP) mutagenesis and its application in soy sauce brewing[J].World Journal of Microbiology and Biotechnology,2019,35(12):180.
[11]QI W, ZHANG W T, LU F P. Carbon metabolism and transcriptional variation in response to salt stress in the genome shuffled Candida versatilis and a wild-type salt tolerant yeast strain[J].RSC Advances,2017,7(3):1646-1653.
[12]ORDONEZ J L, TRONCOSO A M, GARCIA P, et al. Recent trends in the determination of biogenic amines in fermented beverages-a review[J].Analytica Chimica Acta,2016,939(7):10-25.
[13]張珊.耐盐酵母的添加对高盐稀态酱油的影响[D].天津:天津科技大学,2018.
[14]国家卫生和计划生育委员会.食品安全国家标准 食品中氨基酸态氮的测定:GB 5009.235—2016[S].北京:中国标准出版社,2016.
[15]鄭海燕.酱油中红色指数的测定方法[J].中国调味品,1999(1):27-30.
[16]国家食品药品监督管理总局,国家卫生和计划生育委员会.食品安全国家标准 食品中生物胺含量的测定:GB 5009.208—2016[S].北京:中国标准出版社,2016.
[17]国家卫生和计划生育委员会.食品安全国家标准 食品中氨基甲酸乙酯的测定:GB 5009.223—2014[S].北京:中国标准出版社,2014.
[18]ATIENZAR F A, JHA A N. The random amplified polymorphic DNA (RAPD) assay and related techniques applied to genotoxicity and carcinogenesis studies: a critical review[J].Mutation Research,2006,613(23):76-102.
[19]邢爽,王亚平,郭学武,等.发酵条件对5种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[20]周钰涵,崔丹瑶,闫昕,等.酿酒酵母与球拟酵母混合发酵对白酒风味物质的影响[J].食品研究与开发,2021,42(17):169-175.
[21]LU Y M, CHEN X H, JIANG M, et al. Biogenic amines in Chinese soy sauce[J].Food Control,2009,20(6):593-597.
[22]LI J, ZHOU L N, FENG W, et al. Comparison of biogenic amines in Chinese commercial soy sauces[J].Molecules,2019,24(8):1522.
[23]SHEN M Y, ZHANG F, HONG T, et al. Comparative study of the effects of antioxidants on furan formation during thermal processing in model systems[J].LWT-Food Science and Technology,2017,75:286-292.
[24]WUNDERLICHOVA L, BUNKOVA L, KOUTNY M, et al. Formation, degradation, and detoxification of putrescine by foodborne bacteria: a review[J].Comprehensive Review in Food Science and Food Safety,2014,13:1012-1030.

