基于UPLC-MS/MS 和网络药理学、分子动力学探讨红芪免疫调节机制
罗旭东,李昕蓉,李成义,齐鹏,梁婷婷,冯晓莉,2,李旭,何军刚,魏小成,周瑞娟,谢鑫明(.甘肃中医药大学,甘肃 兰州 730000;2. 敦煌医学与转化教育部重点实验室,甘肃 兰州 730000)
免疫是机体的基本生理功能,可识别和清除入侵机体的抗原及体内衰老或突变的细胞,免疫功能受损或低下会导致机体免疫系统出现缺陷,使机体更易被病原体侵袭[1]。恶性肿瘤、风湿等重大疾病的发生发展都与机体免疫失调密切相关[2-3],维持机体免疫平衡至关重要。
红芪是甘肃道地药材,味甘,性微温,归肺、脾经,具有补气升阳,固表止汗,生津养血,行滞通痹,托毒排脓,敛疮生肌的功效。红芪含有黄酮、多糖、皂苷、氨基酸等活性成分,在调节机体免疫功能、抗氧化、抗肿瘤、降血糖、抗衰老等方面具有较好的药理作用[4-6],市场应用前景广阔。
红芪对机体的免疫功能具有调节作用,可拮抗环磷酰胺等的免疫抑制作用,对正常小鼠免疫力也有一定的调节作用[7],但其免疫调节机制尚不明确。血清药物化学结合网络药理学、计算药学,可构建体内与体外、病证与疗效的桥梁[8-9]。探索中药多成分-多靶点-多通路的相关关系,对于中药的有效成分及作用机制的研究更有意义。
本研究通过UPLC-MS/MS技术对大鼠灌胃红芪水提物后的入血成分进行分析,以入血成分为基础,通过网络药理学研究红芪免疫调节的作用靶点及通路,并结合计算药学验证分析,以期阐明红芪调节免疫作用的物质基础及机制。
1 材料
1.1 药物及试剂红芪药材,采于陇南市武都区安化镇,经甘肃中医药大学李成义教授鉴定,为豆科植物多序岩黄芪Hedysarum polybotrysHand.-Mazz.的干燥根。芒柄花素、芒柄花苷、毛蕊异黄酮、槲皮素、美迪紫檀素、香草酸、腺苷、甜菜碱,均购自上海源叶生物科技有限公司,批号分别为:H06S9Z69494、P03A10F84910、Y24N9Y75652、P19D10F106420、Y12 M11H112983、H11J9Z65318、N24D11W135689、DJ06 15YA13;乙腈、甲酸,德国Merck公司;甲醇,美国Fisher公司;纯净水,广州屈臣氏食品饮料有限公司。
1.2 仪器API 5500三重四级杆UPLC-MS/MS 质谱系统、UPLC-30AD 超高效液相系统,美国ABSCIEX 公司;BT25S型1/100000电子分析天平,北京赛多利斯仪器有限公司;Centrifuge 5810R 型台式低温离心机,Eppendorf Biotechnology 上海有限公司;TDL-5 蜀科台式冷冻低速离心机,四川蜀科仪器有限公司;YRE-301 旋转蒸发仪,巩义市予华仪器有限责任公司。
1.3 实验动物SD 大鼠,雄性,SPF 级,6 周龄,体质量(200±20)g,由甘肃中医药大学实验动物中心提供。动物质量合格证号:62001000000620;动物生产许可证号:SCXK(甘)2020-0001;动物使用许可证号:SYXK(甘)2020-0009。动物于甘肃中医药大学动物实验中心标准化饲养,自由饮水饮食1周。本研究中涉及动物的实验均经甘肃中医药大学实验动物伦理委员会批准(批准号:2021-465)。
2 方法
2.1 入血成分分析检测条件
2.1.1药物成分数据库的建立 通过PubMed、Web of Science、中国知网等网络数据库检索红芪文献报道的质谱相关信息的化学成分,建立红芪药物成分数据库,用于定性红芪含药血清中药物成分。
2.1.2供试品溶液的制备 精密称取红芪样品30.0 g,置于1 000 mL 圆底烧瓶中,加入300 mL 蒸馏水,回流1 h。过滤,滤渣重复提取,合并滤液,减压浓缩,定容至50 mL 容量瓶,得药液含生药浓度为0.6 g·mL-1,备用。
2.1.3混合对照品溶液的制备 精密称取芒柄花素、芒柄花苷、毛蕊异黄酮、美迪紫檀素、香草酸对照品适量,加甲醇溶解,制备浓度分别为2 500.00、12.50、12.50、20.00、2 500.00 μg·L-1的混合对照品溶液,备用。
2.1.4内标溶液的配制 精密称取盐酸吡格列酮对照品适量,加甲醇溶解,配制成质量浓度为1.00 g·L-1的母液。实验前,量取适量内标储备液稀释至2 μg·L-1。
2.1.5含药血清与空白血清的制备 动物随机分为空白组、给药组,每组各6只大鼠,采用体表面积法及依据相关研究[10],计算给药剂量。给药组大鼠每天上午8∶00 分别灌胃给予5.4 g·kg-1的红芪(9 mL·kg-1)水提取物,给药7 d,空白组给予等量蒸馏水。末次给药前24 h 禁食禁水,末次给药1 h 后3%戊巴比妥钠溶液(1.5 mL·kg-1)腹腔注射麻醉,心脏取全血,2 980×g、4 ℃离心20 min,收集血清,-80 ℃冻存备用。
2.1.6血清供试品的制备 精密移取200 μL 血浆样品,依次加入内标溶液50 μL,50%甲醇水50 μL,涡旋30 s;加入甲醇5 mL,涡旋15 min,2 980×g;离心20 min,氮吹仪40 ℃吹干;用100 μL 50%甲醇水复溶,涡旋3 min;18 500×g、4 ℃离心20 min,取上清进样。
2.1.7UPLC条件 Waters CORTES C18色谱柱(4.6 mm×50 mm,2.7 μm);流动相0.2%甲酸水(A)-甲醇(B),梯度洗脱(0~5 min,5%~90%B;5~7.5 min,90%B;7.5~8 min,90%~5%B;8~13 min,5%B);体积流量0.3 mL·min-1,柱温40 ℃,进样量2 μL。
2.1.8质谱条件 采用MRM 正、负离子检测模式;雾化气温度(TEM):500 ℃;碰撞气(CAD):8 psi;雾化气(GSl,N2):50 psi;辅助气(GS2,N2):50 psi;气帘气(CUR):30 psi;喷雾电压(IS)4 500 eV(ESI-)、5 500 eV(ESI+)。
2.2 网络药理学分析
2.2.1入血成分靶点筛选 利用中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)、本草组鉴(HERB,http://herb.ac.cn/)数据库筛选红芪入血成分靶点,用UniProt(https://www.uniprot.org/uniprot/)校正。所得结果经去重处理,作为红芪入血成分靶点。
2.2.2免疫相关疾病靶点获取 采用OMIM(http://www.omim.org/)、TTD(https://db.idrblab.org/ttd/)、DisGeNET(http://www.disgenet.org/)、MalaCards(http://www.malacards.org/)数据库检索免疫相关疾病靶点,建立免疫调节靶点数据集。
2.2.3入血成分-疾病交集靶点的筛选 通过vlookup函数筛选红芪入血成分与免疫相关疾病交集靶点。
2.2.4“红芪-入血成分-靶点-疾病”网络构建 将所获得入血成分及交集靶点导入Cytoscape 3.7.0 软件,通过设置节点性质、颜色及形状,构建网络图。
2.2.5GO 及KEGG 富集分析采用David(https://david.ncifcrf.gov/)数据库对交集靶点进行GO 功能和KEGG通路富集分析,对靶点相关功能进行注释,以P<0.05为筛选条件。
2.2.6蛋白互作网络的构建 为进一步明确红芪治疗免疫调节靶点的相互作用,将交集靶点导入STRING11.5(https://string-db.org/)数据库对共有靶点进行蛋白互作(PPI)分析,将互作网络数据导入Cytoscape 3.7.0,通过对节点连接度(Degree)和集聚系数(Clustering Coefficient)进行分析,获取红芪调节免疫的核心靶点。
2.3 分子对接、动力学验证使用PDB(http://www.rcsb.org/)数据库对关键蛋白进行三维结构检索,从数据库PubChem 下载分子结构,Schrodinger.Suites 软件分别对大分子蛋白和配体小分子结构进行优化处理。由配体小分子准备向导模块完成小分子准备,进行对接,导出对接结果。采用Schrodinger.Suites 软件对打分较高的配体与蛋白的最佳对接模型进行分子动力学模拟研究,进一步分析核心化合物与核心靶点间的结合稳定性及结合亲和力。
3 结果
3.1 红芪入血成分鉴定分析
3.1.1药物成分数据库的建立 建立红芪共95种药物成分的数据库,包含药物成分名称、检测离子模式、特征离子对、锥孔电压、碰撞能量等信息。
3.1.2红芪入血成分鉴定结果 共鉴定出腺苷、甜菜碱、槲皮素、芒柄花素、芒柄花苷、毛蕊异黄酮、美迪紫檀素及香草酸8个原型成分。其中腺苷、甜菜碱为机体内源性成分,给药组与空白组液相图对比发现峰面积增加,而槲皮素含量较低,故定量了芒柄花素、芒柄花苷、毛蕊异黄酮、美迪紫檀素及香草酸5 个成分。5 个成分及内标的离子对扫描结果分别为:269.2→253.1/197.1、431.1→269.2、285.1→270.2、271.1→137.2、167.1→152.1及357.1→133.9。
3.1.3工作曲线的建立 将“2.1.3”项下芒柄花素、芒柄花苷、毛蕊异黄酮、美迪紫檀素、香草酸混合对照品溶液用50%甲醇水稀释成10.00、0.05、0.05、0.08、10.00 mg·L-1的系列浓度,按照“2.1.7”和“2.1.8”项下方法进样,分别以各成分质量浓度(X)为横坐标,化合物峰面积与内标峰面积比值(Y)为纵坐标,通过UPLC-MS/MS 联用系统中Analyst 1.7.3 软件对各待测成分进行线性拟合,工作曲线依次为:Y=13.30X+0.206,r=0.999 6,在78.13~2 500.00 μg·L-1范围内线性良好;Y=50X+0.016 3,r=0.998 4,在0.39~12.50 μg·L-1范围内线性良好;Y=21.10X+0.039 9,r=0.995 2,在0.39~12.50 μg·L-1范围内线性良好;Y=55.80X+0.187,r=0.995 6,在0.63~20.00 μg·L-1范围内线性良好;Y=0.082 2X+0.002 19,r=0.997 6,在78.13~2 500.00 μg·L-1范围内线性良好。
3.1.4方法学考察结果 专属性、精密度和准确度、提取回收率和基质效应、残留效应、稳定性均符合方法学规定,见图1。
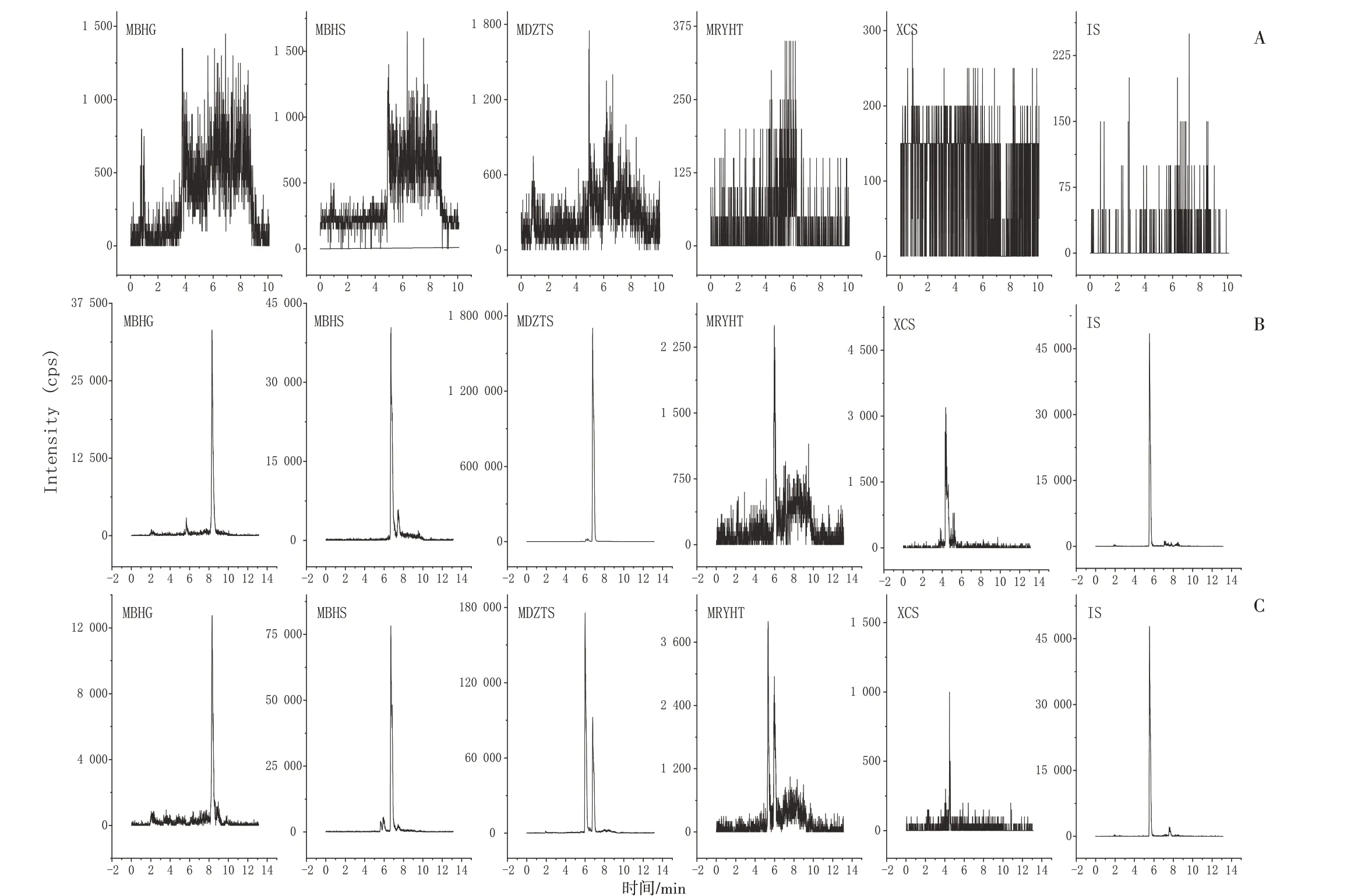
注:A.空白血浆样本;B.空白血浆加入芒柄花苷(MBHG)、芒柄花素(MBHS)、美迪紫檀素(MDZTS)、毛蕊异黄酮(MRYHT)、香草酸(XCS)对照品及IS样本;C.血浆样品图1 专属性验证Figure 1 Specificity verification
3.1.5含药血清成分测定 芒柄花素、芒柄花苷、毛蕊异黄酮、美迪紫檀素及香草酸的血清药物浓度分别为:(32.64±1.85)、(1.60±0.34)、(0.66±0.18)、(3.46±0.67)、(25.77±1.29)μg·L-1,n=6。
3.2 红芪免疫调节网络药理学分析
3.2.1免疫相关疾病靶点收集 结合TCMSP、HERB、UniProt数据库检索,经去重处理得到424个入血成分靶点,结合OMIM、TTD、DisGeNET、MalaCards 数据库检索,去重处理得到1 438 个免疫相关疾病靶点,与入血成分靶点取交集最终获取交集靶点共101个。
3.2.2“药材-活性成分-靶点-疾病”网络构建与分析 利用Cytoscape3.7.0 软件绘制“红芪-活性成分-靶点-疾病”网络,见图2,共包含111 个节点,12 210 条边。紫色菱形代表红芪药材,粉色方块代表活性化合物,淡黄色圆形代表疾病,淡蓝色矩形代表靶点,体现了红芪调节免疫多成分、多靶点协同作用的特点。
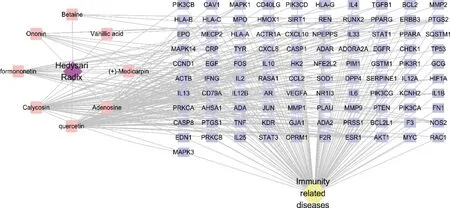
图2 红芪的“药材-活性成分-靶点-疾病”网络Figure 2 The“herbs-components-targets-disease”network of Hedysari Radix
3.2.3GO 与KEGG 通路富集分析 采用David 数据库对101 个靶点基因进行富集分析,得到GO 功能(P<0.05)676条,对各类别前8条条目进行可视化(图3)。其中包含生物过程538 个,细胞组成58 个,分子功能80 个,主要涉及免疫反应、基因表达的正调控、细胞增殖的正调控、血管生成的正调控、转录自RNA 聚合酶Ⅱ启动子的负调控、神经元凋亡过程的正调控、pri-miRNA 转录自RNA 聚合酶Ⅱ启动子的负调控、凋亡过程的炎症反应、细胞外间隙、胞外区、高分子配合物、磷脂酰肌醇3-激酶复合物、细胞质、细胞表面、细胞溶质、酶结合、相同蛋白结合、细胞因子活性、蛋白结合、受体结合、生长因子活性等生物过程。
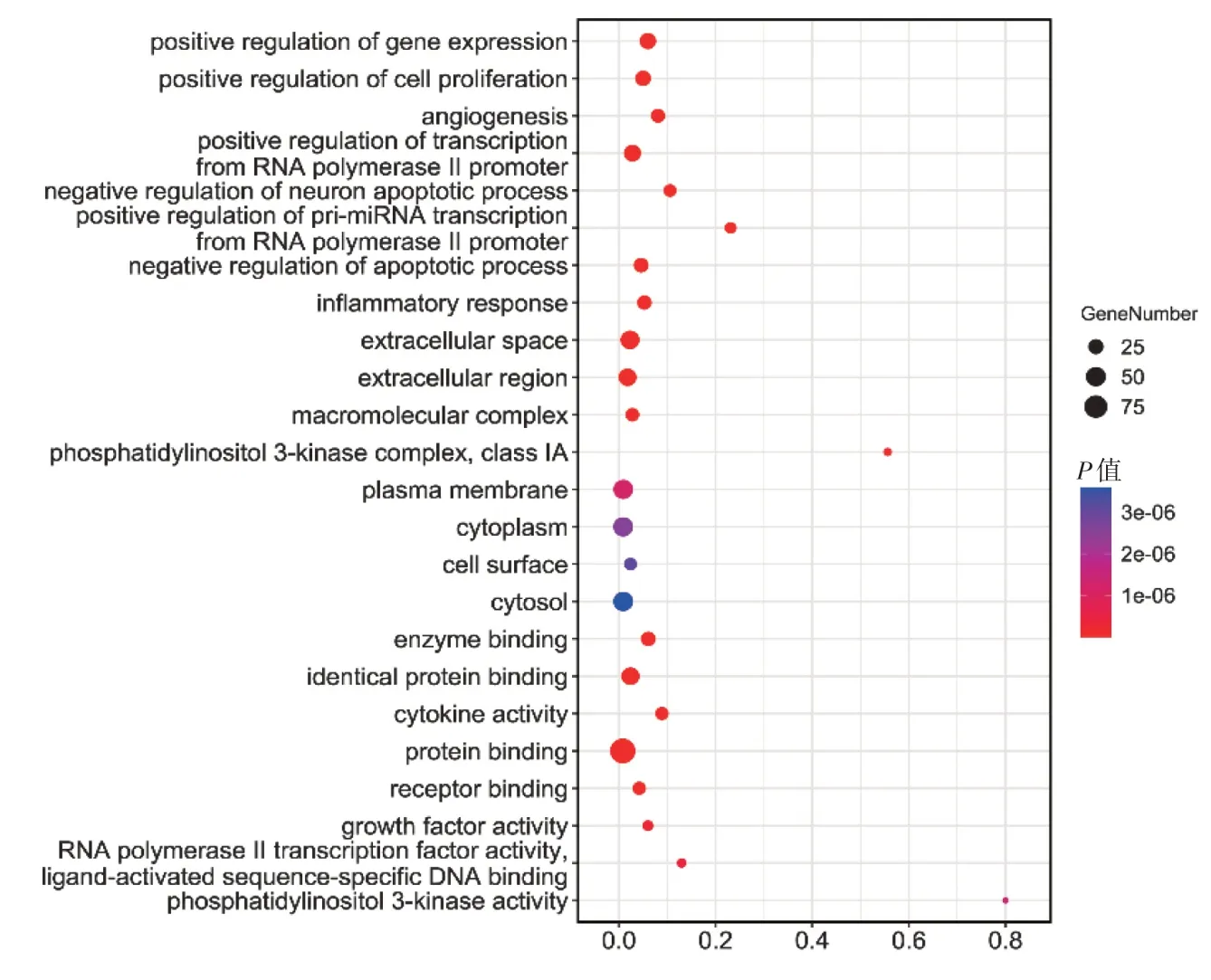
图3 GO 功能富集分析Figure 3 GO enrichment analysis of potential targets
得到KEGG 通路(P<0.05)166 条,对其前25 条条目进行可视化(图4)。主要涉及HIF-1 信号通路、Toll样受体信号通路、JAK-STAT信号通路、IL-17信号通路、TNF 信号通路、松弛素信号通路、PI3KAkt 信号通路、VEGF 信号通路、T 细胞受体信号通路、FoxO 信号通路、甲状腺激素信号通路、ErbB 信号通路、催乳素信号通路、Rap1 信号通路、雌激素信号通路、MAPK 信号通路、B 细胞受体信号通路、趋化因子信号通路、NOD 样受体信号通路、催产素信号通路、mTOR 信号通路、p53 信号通路、NF-kappa B信号通路、GnRH信号通路等信号通路。
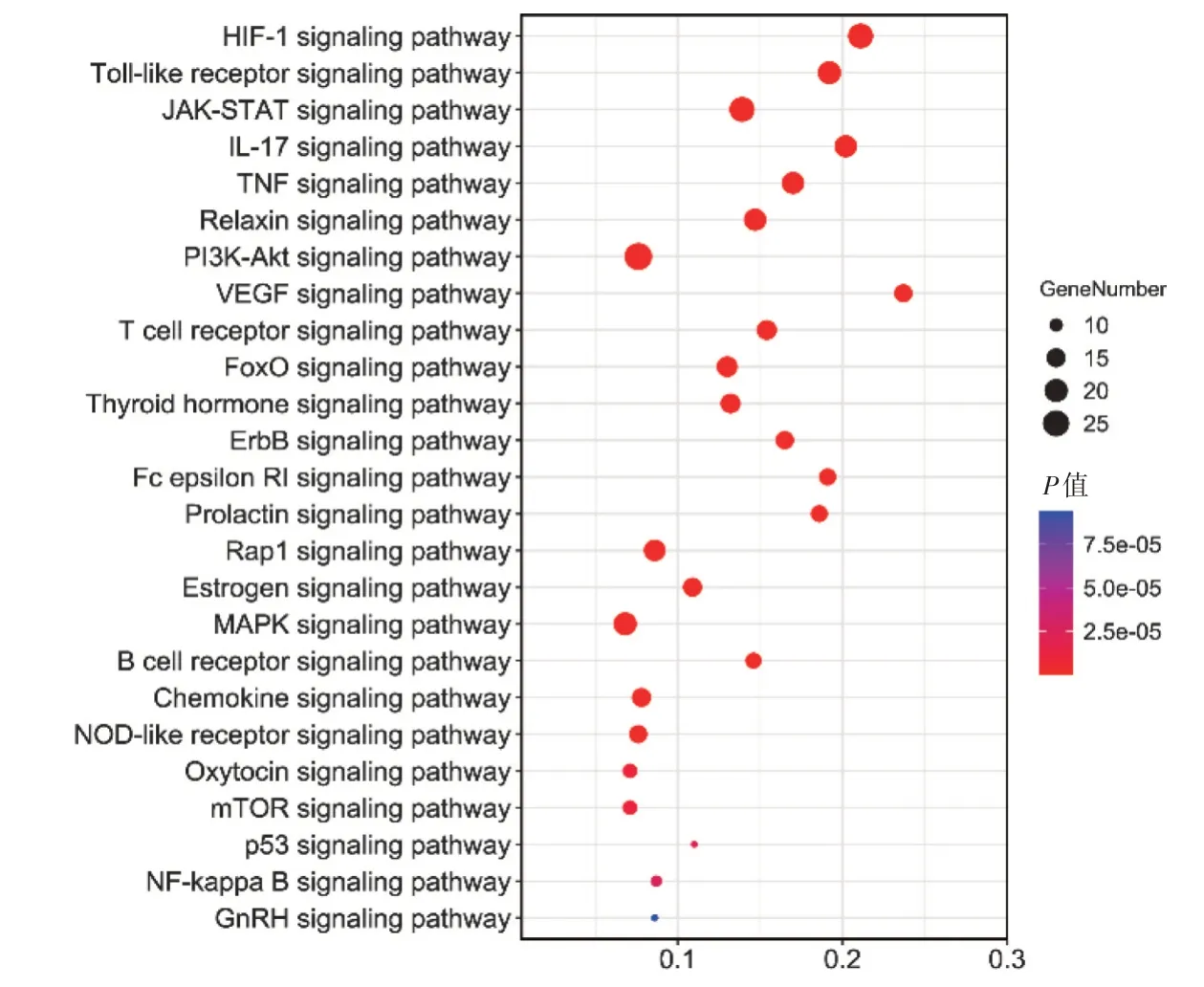
图4 KEGG 通路富集分析Figure 4 KEGG pathway analysis of potential targets
3.2.4PPI网络构建及核心靶点筛选 将101个靶点基因导入STRING 数据库,构建PPI 网络,共得到101 个节点,1 838 条边,经过分析获得MAPK14、PTGS2、CAV1、KDR、PPARG 等10 个核心靶点,见图5。
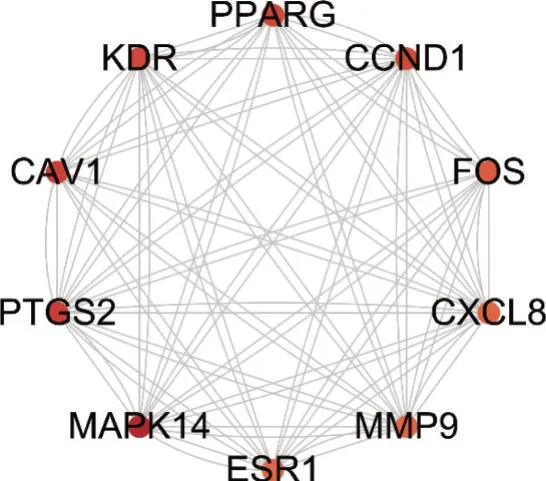
图5 红芪调节免疫的核心靶点网络Figure 5 Core target network of regulating immue of Hedysari Radix
3.3 分子对接及动力学验证对MAPK14、PTGS2、MMP9、PPARG 等核心靶点筛选结果逆向评估,对应到芒柄花素、美迪紫檀素、毛蕊异黄酮、槲皮素等核心化合物,与核心靶点MAPK14、PTGS2 对接结果较好的前4 位化合物的对接结果见表1、图6。MAPK14蛋白对接结果优于PTGS2蛋白对接结果,且4 个化合物对这2 个蛋白都有较好的结合能力,从而验证了红芪具有免疫调节的作用。
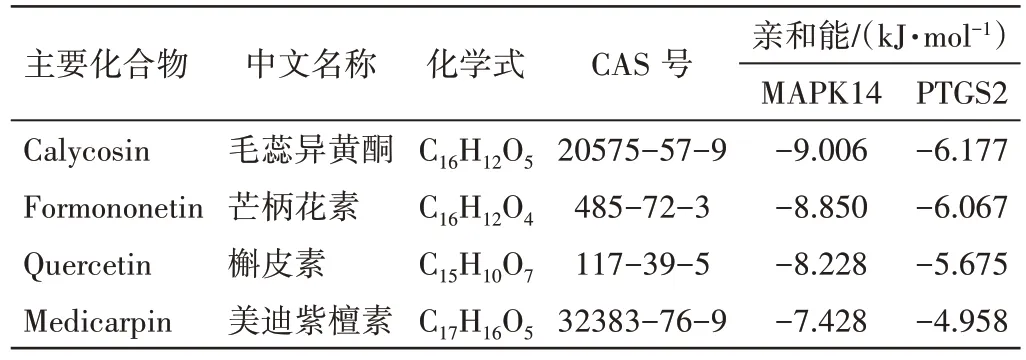
表1 红芪活性成分与靶蛋白的结合能Table 1 Binding energy between Hedysari Radix active components and target proteins

图6 红芪活性成分与高亲和力靶点相互作用分析Figure 6 Interaction analysis between active components of Hedysari Radix and targets with high affinity
根据模拟结果计算复合物的RMSD,评估整个复合物结构及各个氨基酸在动力学过程中的稳定程度。虚拟筛选获得的毛蕊异黄酮、芒柄花素两个化合物与MAPK14 蛋白分子的对接复合物的20 ns 分子动力学模拟结果显示,毛蕊异黄酮、芒柄花素分别在模拟5 ns和15 ns后趋于平衡,RMSD 值稳定在0.4 Ånm和0.45 Ånm(图7),表明两个复合物的骨架在模拟过程偏移程度较小,两个化合物与MAPK14形成稳定的分子间作用,且构象稳定,处于较低的能量状态,进一步证明了分子对接结果的可靠性。
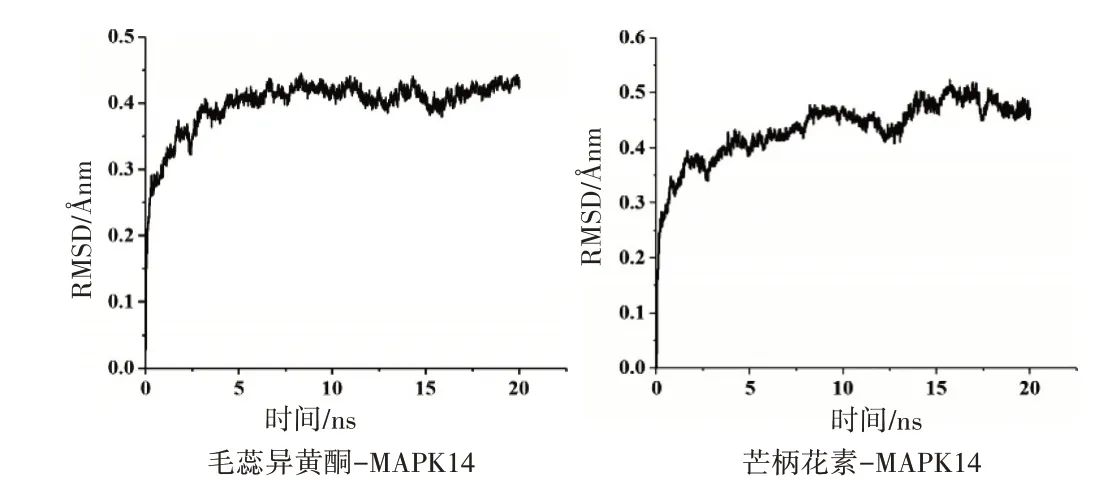
图7 分子动力学结果Figure 7 Molecular dynamics results
4 讨论
红芪水提液能提高脾气虚大鼠免疫功能[11-12],且其提取物有一定的增强体液、细胞免疫作用[13-14]。红芪通过调节免疫器官、免疫细胞和免疫因子增强机体的免疫功能而起到免疫调节作用[6,13,15],但免疫调节机制的研究较少。中药成分比较复杂,经适当的途径给药后,在体内会经过吸收、分布、代谢等过程,通过血液运输到各个器官组织或靶点,并在达到一定的血药浓度时才能发挥药效。
本研究建立了稳定、可靠的红芪入血成分定性定量UPLC-MS/MS 分析方法,共鉴定红芪原型入血成分8 个,3 个定性成分为腺苷、甜菜碱、槲皮素,5 个定量成分的血清药物浓度分别为芒柄花素(32.64±1.85)μg·L-1、芒柄花苷(1.60±0.34)μg·L-1、毛蕊异黄酮(0.66±0.18)μg·L-1、美迪紫檀素(3.46±0.67)μg·L-1及香草酸(25.77±1.29)μg·L-1。本研究尚未涉及红芪含药血清中代谢产物等可能的药效物质,在后续将深入研究。
本研究在血清药物化学定性定量分析红芪入血成分的基础上,结合网络药理学方法揭示了芒柄花素、芒柄花苷、毛蕊异黄酮、美迪紫檀素等可能是红芪发挥免疫调节作用的核心化合物。其中芒柄花素具有神经保护、抗菌、抗癌、抗高血压作用[16],通过PI3K、Akt、MAPK 信号通路调节生长因子VEGF、FGF2以及MMP-2、MMP-9蛋白抑制细胞侵袭[17]。芒柄花苷在调节炎症相关信号通路中起关键作用,可缓解TNF-α诱导的RA-FLS和MH7A细胞活力,减少IL-6 等促炎细胞因子的产生,抑制NF-κB 和MAPK通路的异常激活[18];通过PI3K/Akt/mTOR 信号通路,有效抑制了Hep-2、非小细胞肺癌细胞的增殖,具有显著的抗肿瘤活性[19-20]。毛蕊异黄酮通过影响PI7K/Akt/mTOR、WDR7-7-GPR30 等信号通路,起到抗癌、抗炎、神经保护、保肝等作用[21],通过灭活PI1K/Akt/FoxO3 通路来防止IL-1β 诱导的软骨细胞凋亡、炎症和ECM 降解[22]。香草酸对MAPK、NF-κB、JAK、STAT、NLRP 等信号通路具有抑制活性,起抗炎和抗氧化作用;可抑制TLR4信号传导,对DOX 诱导的心脏毒性发挥心脏保护作用[23];还可减少KOA大鼠模型中的滑膜炎和疼痛相关行为[24]。
综合拓扑参数,可推测红芪免疫调节中起重要作用的核心靶点可能有MAPK14、PTGS2、CAV1、KDR、 PPARG、 CCND1、 CXCL8、 ESR1、 MMP9、FOS。研究[25]发现,PTGS2 过表达可提高hTERTMSCs 对淋巴细胞的抑制作用。MAPK14 在结直肠肿瘤组织中的表达上调,与CD8+T、CD4+T、B 细胞等免疫细胞的免疫浸润水平有关[26]。也可通过下调炎性细胞因子的表达,抑制肺组织细胞凋亡[27]。GO 富集分析显示其作用机制可能与免疫反应、基因表达的正调控、受体结合、酶结合、细胞因子活性、细胞增殖调控等过程相关。当机体暴露于病原体时,先天免疫系统都会以相同和非特异性的方式迅速发挥作用,但不能建立和维持免疫记忆来帮助防止再感染[28]。代谢因子通过调节细胞内信号传导、诱导蛋白质的修饰来调节宿主免疫细胞的反应[29]。本研究KEGG 富集显示与HIF-1、JAK-STAT、Toll 样受体、T 细胞受体、PI3K-Akt、FoxO 等信号通路密切相关。PI3K、Akt、mTOR 信号通路在细胞存活、生长和增殖的调节中起重要作用[30]。PI3K 在酶的作用下导致Akt在PI3K-Akt信号转导途径中与细胞膜结合,参与细胞增殖、细胞凋亡抑制、细胞迁移、囊泡运输和细胞癌变的效应[31]。
本研究初步探究了红芪的免疫调节作用机制为芒柄花素、美迪紫檀素、毛蕊异黄酮、槲皮素等核心化合物分别作用于MAPK14、PTGS2、MMP9、PPARG、CCND1、CXCL8、ESR1等核心靶点,调节免疫反应、基因表达的正调控、细胞增殖调控等生物过程以及HIF-1、JAK-STAT、T 细胞受体、PI3K-Akt、FoxO等信号通路。分子对接结果表明,芒柄花素、美迪紫檀素、毛蕊异黄酮、槲皮素等核心化合物与核心靶点MAPK14、PTGS2 对接结果较好,分子动力学结果显示毛蕊异黄酮、芒柄花素两个化合物与MAPK14蛋白形成稳定的分子间作用,构象稳定,进一步验证了网络药理学分析结果的可靠性。
综上所述,本研究结合网络药理学、计算药学、血清药物化学,探讨了红芪免疫调节的物质基础及机制,为红芪等补益类中药材免疫调节作用机制研究提供了思路和依据。

