miR-105-5p靶向SIRT1调控脂肪酸代谢影响胃癌细胞生物学行为的研究
罗庆元 闫军 孙国辉 杨阳
胃癌是胃肠道最常见恶性肿瘤之一,近年来我国胃癌发病率逐年升高,很多患者就诊时已经达到晚期,尽管近年来放化疗、免疫治疗等方法层出不穷,但患者总体预后不佳[1]。因此,寻找新的治疗靶点迫在眉睫。微小RNA(microRNA,miRNA)是近年来研究的热点,在调控肿瘤进展中扮演着重要角色。miR-105-5p是一种抑癌基因,在卵巢癌、宫颈癌、非小细胞肺癌组织中差异表达,调控肿瘤细胞恶性表型[2-4]。但最近研究发现,胃癌组织高表达miR-105-5p,上调miR-105-5p可增强胃癌细胞增殖、侵袭及迁移能力[5]。肿瘤细胞代谢在调控肿瘤进展、免疫微环境中发挥重要作用,其中脂肪酸代谢是肿瘤细胞代谢最重要的领域之一。研究发现,多种miRs可通过调节脂肪酸代谢影响胃癌进展,如miR-23b、miR-1275[6-7]。但miR-105-5p是否同样通过调控脂肪酸代谢影响胃癌恶性表型,目前尚不清楚。沉默信息调节因子1(silent information regulator 1,SIRT1)负责调控细胞新陈代谢,与肿瘤的代谢异常密切相关,也是肿瘤诊断及治疗的潜在靶点[8]。研究发现,SIRT1参与调控肿瘤细胞脂肪酸代谢[9-10]。本研究探讨miR-105-5p对胃癌增殖、侵袭、迁移及脂肪酸代谢的影响,及其与SIRT1的靶向关系,希望为胃癌的靶向治疗提供新的靶点。
1 材料与方法
1.1 试剂与仪器 人胃黏膜上皮细胞GES-1、人胃癌HepG2细胞(中国北纳生物公司),RPMI-1640培养基(安徽白鲨生物科技有限公司),胎牛血清、0.25%胰蛋白酶(百克赛斯生物科技有限公司),lipofectamine 8000(上海碧云天生物有限公司),TRizol(美国Invitrogen公司),引物序列,sh-SIRT1(敲低)质粒、敲低空载体(Scramble)、miR-105-5p模拟物(mimic)质粒、miR-105-5p抑制剂(inhibitor)质粒、mimic空载体及inhibitor空载体,野生型(WT)-SIRT1载体、突变型(MUT)-SIRT1载体(北京博尔迈生物技术有限公司),PCR试剂盒(上海碧云天生物科技有限公司);CCK-8(Cell counting kit-8)试剂盒(杭州赫贝科技有限公司);双荧光素酶报告基因检测试剂盒(武汉科谨生物科技有限公司);磷脂、三酰甘油酶联免疫吸附试验(enzyme-linked immuno sorbent assay,ELISA)试剂盒(上海惠诚生物有限公司);兔抗人β-actin、SIRT1、脂肪酸合成酶(fatty acid synthase,FASN)、乙酰辅酶a羧化酶(acetyl-CoA carboxylase,ACC1)及脂肪酸结合蛋白5(fatty acid binding protein 5,FABP5)(上海碧云天生物有限公司),酶标仪(美谷分子,中国),NANOdrop 2000仪(Bio-rad公司,美国),聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳器械(上海懋康生物科技有限公司),天能VE-586曝光机(上海天能科技有限公司),ABI 7900 PCR仪(美国ABI公司),ARM200F原子级分辨率透射电子显微镜(日本电子株式会社)。
1.2 细胞培养、转染及分组 HepG2细胞使用RPMI-1640完全培养基培养,条件:37℃、5%CO2,每隔2 d更换新鲜培养液。取传代3次对数生长期的HepG2细胞接种到6孔板,细胞铺满50%板面积时使用lipofectamine 8000将不同质粒转染细胞分为miR-105-5p组(转染miR-105-5p mimic)、si-miR-105-5p组(转染miR-105-5p inhibitor)、miR-NC组(转染mimic NC),NC组(转染inhibitor NC),Scramble组(转染Scramble)、miR-105-5p+Scramble组(转染miR-105-5p mimic、Scramble)及miR-105-5p+sh-SIRT1组(转染miR-105-5p mimic、sh-SIRT1),继续培养48 h后进行后续实验。
1.3 CCK-8测定细胞活力 首先,消化细胞后制备单细胞悬液,将5 000个细胞/孔接种在96孔板,常规条件,培养基孵育24、48和72 h后终止培养,去除旧培养基,每孔加入含有10 μL CCK-8溶液的新鲜培养基,继续孵育3 h。然后上机检测450 nm波长处组细胞的光密度(Optical density,OD)。每组实验独立重复3次,每次3个样本。
1.4 Tanswell实验测定细胞侵袭、迁移能力
1.4.1 侵袭实验:先用无血清DMEM培养基配置Matrigengel胶,然后将基质胶按照每孔100 μL量铺到Tanswell小室的上室,37℃培养箱放置1 h,下室中加入600 μL 10%胎牛血清,消化细胞后制备成单细胞悬液,向上室中加入2×104个细胞,孵育48 h后棉签拭去上室未穿的细胞,洗涤3次后用4%多聚甲醛固定10 min,0.1%结晶紫染色,显微镜下低倍镜下拍照,计数。
1.4.2 迁移实验:除了上室中不加入基质胶,其他步骤参考侵袭实验。
1.5 ELISA检测细胞磷脂、三酰甘油含量 收集各组细胞,1 200 r/min离心10 min,去上清液,沉淀进行超声1 min,按照试剂盒说明书检测细胞磷脂、三酰甘油含量。
1.6 实时定量PCR(qRT-PCR)检测miR-105-5p和SIRT1-mRNA的表达 使用TRizol从各组细胞中提取总RNA,测定浓度、纯度。根据试剂盒说明书逆转录成cDNA,然后PCR,体系:cDNA 2 μL,上下游引物各0.2 μL,2×Tip Green qPCR Sper Mix 5 μL,DEPC水 2.6 μL。条件:95℃ 2 min、95℃ 15 s、60℃ 15 s、共40循环,构建溶解曲线。2-ΔΔCt法表示基因相对含量。内参选择GAPDH、U6。见表1。
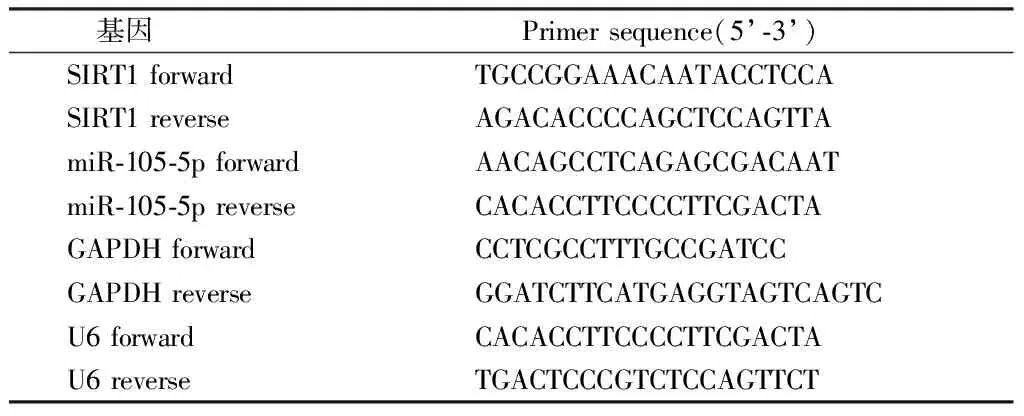
表1 qRT-PCR引物
1.7 Western blot检测SIRT1、FASN、ACC1及FABP5蛋白表达 细胞中加入蛋白裂解物提取总蛋白,通过BCA法进行总蛋白浓度测定,沸煮后按照1∶4的比例蛋白液中加入5×蛋白loading,沸煮10 min变性。取50 μg的蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳进行蛋白分离,采用湿转法将分离的蛋白转至PVDF膜上,5%的脱脂牛奶于室温下封闭2 h后,分别加入SIRT1(1∶1 000)、FASN(1∶1 000)、ACC1(1∶1 000)及FABP5(1∶1 000)一抗,4℃摇床孵育过夜。TBST溶液清洗3次,5 min/次,以辣根酶标记的二抗(1∶1 000)室温孵育1 h,以TBST溶液清洗3次,5 min/次。最后均匀滴加ECL发光液后于凝胶成像仪进行曝光拍照。采用Image J 软件测定条带灰度值,以目标蛋白与内参β-actin的比值作为其相对表达量。以上实验重复3次。
1.8 在线网站预测miR-105-5p与SIRT1的靶向关系 使用TargetScan在线网站(httP://www.targetscan.org/)预测miR-105-5p与SIRT1的靶向关系。
1.9 双荧光素酶报告 在转染前24 h,将HepG2细胞以每孔1×104/mL细胞接种在24孔板中。将miR-NC或miR-105-5p mimics分别与WT-SIRT1、MUT-SIRT1载体(突变序列:ACGGAGGCTGAGGCACGAGGATTGCT)共转染到HepG2细胞中,分为miR-NC+WT-SIRT1、miR-105-5p+WT-SIRT1组、miR-NC+MUT-SIRT1组及miR-105-5p+MUT-SIRT1组。使用双荧光素酶报告分析系统在转染后24 h进行荧光素酶分析。荧火虫荧光素酶活性被标准化为每个反应的海肾荧光素酶活性。

2 结果
2.1 GES-1、HepG2细胞miR-105-5p、SIRT1表达水平 HepG2细胞miR-105-5p表达水平高于GES-1细胞,SIRT1蛋白、基因mRNA表达水平低于GES-1细胞(P<0.01)。见图1,表2。
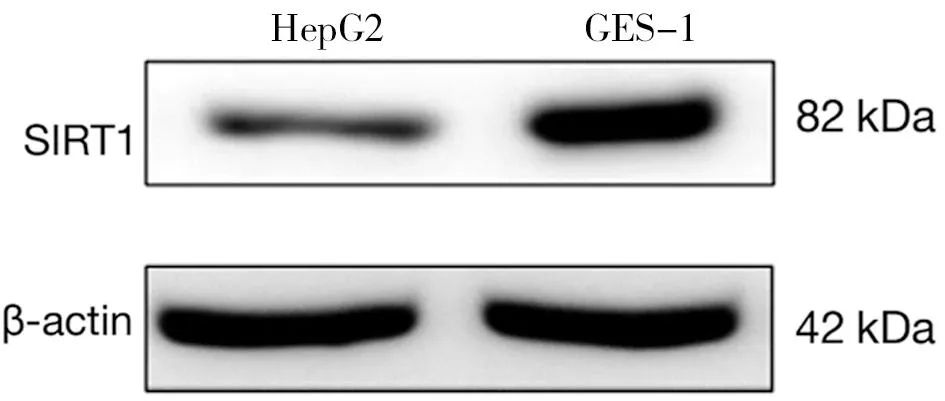
图1 Western blot检测SIRT1蛋白

表2 GES-1、HepG2细胞miR-105-5p、SIRT1表达水平
2.2 miR-105-5p对HepG2细胞脂肪酸代谢的影响 miR-105-5p组细胞磷脂含量、三酰甘油含量、FASN、ACC1、FABP5蛋白水平均高于miR-NC组,si-miR-105-5p组细胞磷脂含量、三酰甘油含量及FASN、ACC1、FABP5蛋白水平均低于NC组(P<0.01)。见图2,表3。

图2 miR-105-5p对HepG2细胞脂肪酸代谢的影响

表3 miR-105-5p对HepG2细胞脂肪酸代谢的影响
2.3 miR-105-5p对HepG2细胞增殖、侵袭及迁移的影响 miR-105-5p组细胞48、72 h OD值,侵袭及迁移细胞数量高于miR-NC组,si-miR-105-5p组细胞48、72 h OD值,侵袭及迁移细胞数量低于NC组,差异有统计学意义(P<0.01)。见图3,表4。
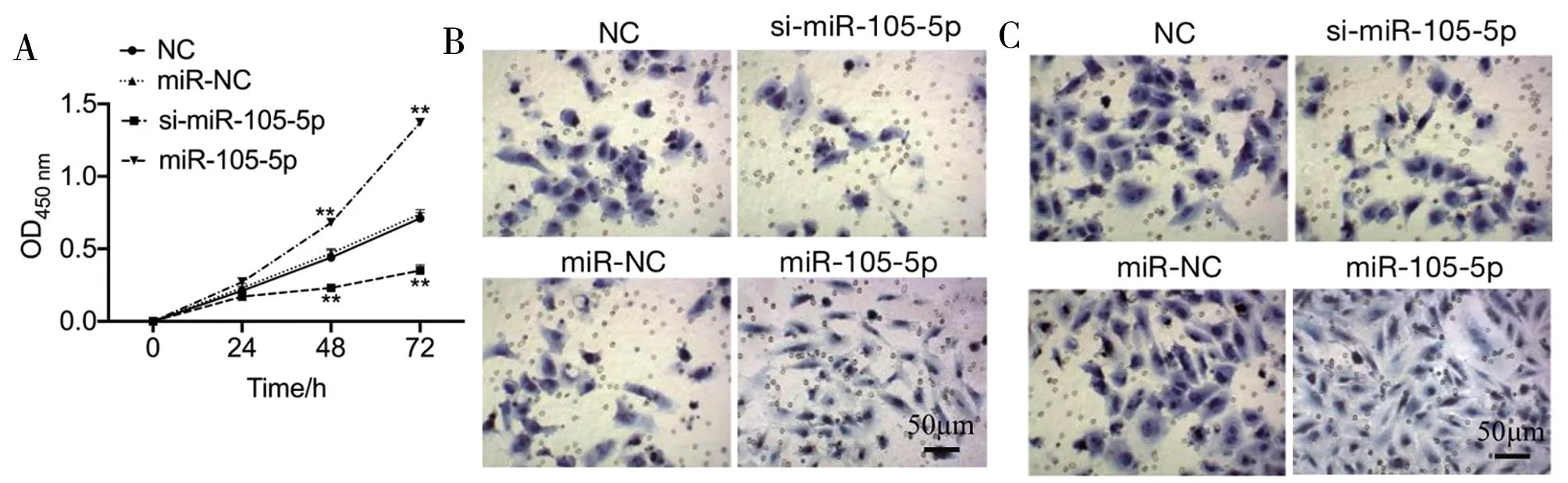
图3 miR-105-5p对HepG2细胞增殖、侵袭及迁移的影响;A CCK-8结果;B 侵袭实验(结晶紫染色×20);C 迁移实验(结晶紫染色×20)

表4 miR-105-5p对HepG2细胞增殖、侵袭及迁移的影响
2.4 下调SIRT1逆转miR-105-5p对HepG2细胞增殖、侵袭及迁移的影响 miR-105-5p+Scramble组细胞48 h、72 h OD值、侵袭及迁移细胞数量高于Scramble组,差异均有统计学意义(P<0.01);miR-105-5p+sh-SIRT1组细胞48 h、72 h OD值、侵袭及迁移细胞数量低于miR-105-5p+Scramble组,差异均有统计学意义(P<0.01)。见图4,表5。
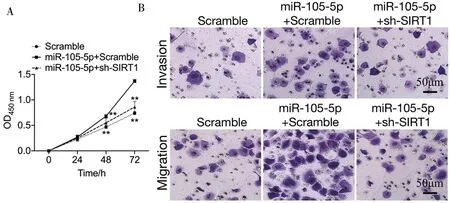
图4 下调SIRT1逆转miR-105-5p对HepG2细胞增殖、侵袭及迁移的影响;A CCK-8结果;B 侵袭、迁移实验(结晶紫染色×20)

表5 下调SIRT1逆转miR-105-5p对HepG2细胞增殖、侵袭及迁移的影响 个,
2.5 下调SIRT1逆转miR-105-5p对HepG2细胞脂肪酸代谢的影响 miR-105-5p+Scramble组细胞磷脂含量、三酰甘油含量及FASN、ACC1、FABP5蛋白水平均高于Scramble组,miR-105-5p+sh-SIRT1组细胞磷脂含量、三酰甘油含量及FASN、ACC1、FABP5蛋白水平均低于miR-105-5p+Scramble组(P<0.01),Scramble组和miR-105-5p+sh-SIRT1组比较差异无统计学意义(P>0.05)。见图5,表6。
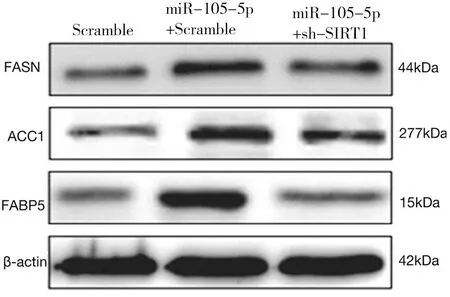
图5 下调SIRT1逆转miR-105-5p对HepG2细胞脂肪酸代谢的影响

表6 下调SIRT1逆转miR-105-5p对HepG2细胞脂肪酸代谢的影响
2.6 miR-105-5p与SIRT1的靶向关系 miR-105-5p组细胞SIRT1蛋白水平低于miR-NC组,si-miR-105-5p组细胞SIRT1蛋白水平高于NC组(P<0.01)。信息学网站预测发现,miR-105-5p与SIRT1 3’UTR存在碱基互补配对位点。荧光素酶实验报告发现,miR-105-5p+WT-SIRT1组细胞荧光素酶活性低于miR-NC+WT-SIRT1组(P<0.01),miR-105-5p+MUT-SIRT1组细胞荧光素酶活性与miR-NC+MUT-SIRT1组差异无统计学意义。见图6,表7、8。

图6 miR-105-5p与SIRT1的靶向关系;A 4组细胞SIRT1蛋白表达;B miR-105-5p与SIRT1的碱基结合位点

表7 4组SIRT1蛋白水平

表8 4组荧光素酶活性比较
3 讨论
胃癌作为消化道常见恶性肿瘤之一,在我国发病率居高不下,尽管放化疗、免疫治疗等手段近年来取得了一定的进展,但患者总体生存率仍较低,复发、病死率较高。因此,寻找影响胃癌进展的新分子及治疗靶点迫在眉睫。
miRNA在胃癌进展中发挥重要作用[11]。miR-105-5p在多种肿瘤组织中差异表达,影响肿瘤进展,如Roseth等[12]研究发现,原发性骨髓瘤细胞患者骨髓组织miR-105-5p高表达,是患者预后不良的危险因素。此外,研究发现,结直肠癌组织高表达miR-105-5p,下调miR-105-5p可抑制结直肠癌细胞的增殖、侵袭及迁移能力[13]。本研究结果显示,胃癌细胞miR-105-5p高表达,提示miR-105-5p可能是胃癌的癌基因。为进一步研究miR-105-5p在胃癌发生发展中的作用,笔者构建了miR-105-5p沉默和过表达胃癌细胞系,并分析了其对肿瘤细胞恶性表型的影响,结果显示,miR-105-5p过表达的细胞增殖、侵袭及迁移能力显著升高,反之沉默miR-105-5p的细胞增殖、侵袭及迁移能力降低。这与Miliotis等[5]的研究结果基本一致。
研究发现,miRNA在肿瘤细胞能量代谢编程中扮演着重要角色,如miR-17通过调控小细胞肺癌脂肪酸代谢影响肿瘤进展[14]。目前普遍认为,肿瘤进展过程中存在异常的脂质代谢过程,被认为是肿瘤的特征之一[15]。脂肪酸是脂质重要组成部分,也是肿瘤细胞能量存储的主要形式,参与各种膜合成、信号通路的组成[16]。在肿瘤发展过程中,脂肪酸代谢途径会发生一定程度上的改变,因此探索脂肪酸代谢调控的机制对于肿瘤防治至关重要。为了观察miR-105-5p对胃癌细胞脂肪酸代谢的影响,本研究检测了磷脂、三酰甘油含量及脂质代谢酶的表达,结果显示,上调miR-105-5p可升高细胞磷脂和三酰甘油含水平,促进FASN、ACC1、FABP5蛋白表达,反之沉默miR-105-5p可降低细胞磷脂和三酰甘油含水平,抑制FASN、ACC1、FABP5蛋白表达,FASN、ACC1、FABP5是调控细胞脂肪酸代谢的关键酶,提示miR-105-5p可抑制非小细胞肺癌细胞中脂肪酸合成。
为了研究miR-105-5p调控胃癌细胞进展、脂肪酸代谢的机制,笔者首先通过TargetScan 数据库预测发现miR-105-5p与SIRT1 3’UTR存在核苷酸结合位点。SIRT1是一种去乙酰化酶,在调控细胞炎性反应、凋亡及增殖中发挥重要作用[17]。研究发现,SIRT1同样参与调控肿瘤细胞脂肪酸代谢[18]。鉴于miR-105-5p与SIRT1在调控胃癌细胞脂肪酸代谢中的作用,笔者随后试图明确两者的靶向关系。首先双荧光素酶报告实验结果证实miR-105-5p与SIRT1具有负性靶向关系。随后通过Western blot以及细胞功能实验证实上调miR-105-5p可抑制细胞SIRT1表达,敲低miR-105-5p可促进细胞SIRT1表达,更重要的是,敲低SIRT1可逆转上调miR-105-5p对胃癌细胞恶性表型、脂肪酸合成的促进作用。上述结果证实,miR-105-5p通过负性调控SIRT1的表达,进而促进胃癌细胞的增殖、侵袭、迁移及脂肪酸合成。
综上所述,miR-105-5p通过负性调控SIRT1促进胃癌细胞的脂肪酸代谢进而促进胃癌细胞的恶性表型,为胃癌的防治提供了潜在靶点。但本次研究结果有待进一步动物实验、临床样本验证。

