1-甲基环丙烯结合气调处理对‘帕拉英达’和‘吉禄’芒果保鲜效果的影响
杞廷美,李艳娇,赵兴东,彭 磊,林 奇,包媛媛,*
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.云南省元江县农业技术推广服务中心,云南 玉溪 653399;3.云南农业大学园林园艺学院,云南 昆明 650201)
芒果(Mangifera indicaL.)为漆树科芒果属植物,是一种风味独特且营养价值极高的热带水果,深受人们的欢迎,有“热带水果之王”的美誉[1]。目前云南是全国鲜食芒果供应期最长的省份,产品畅销省内外。云南省玉溪市元江县为低纬高海拔地区,适宜芒果种植,全县共引进和选育的芒果品种有138个,主栽品种有‘金凤凰’‘台农一号’‘帕拉英达’‘吉禄’等,均具有高产稳产的特点。元江晚熟芒果‘帕拉英达’和‘吉禄’7 月初开始上市,果实味甜、肉质细腻、口感好[2]。芒果属于典型的呼吸跃变型果实,内源乙烯的大量释放促使呼吸跃变的发生,之后果实迅速成熟衰老,货架期短,严重制约其产业的发展[3]。因此,延长芒果的保鲜期,抑制内源乙烯的产生是关键。
1-甲基环丙烯(1-Methylcyclopropene,1-MCP)是一种安全、高效的乙烯受体抑制剂,可抑制果实内源乙烯的生成和呼吸强度的增加,进而抑制果实的各种生理生化反应,延缓果实采后的成熟衰老,从而延长货架期[5]。大量研究表明,1-MCP能有效延缓苹果、油梨、李、猕猴桃和番茄等呼吸跃变型果蔬的成熟衰老[6-10];对枇杷、紫背天葵、蕨菜和金针菇等非呼吸跃变型果蔬也有显著的保鲜效果[11-14]。有研究表明,呼吸跃变是对果实细胞代谢能力需求增加的反应,在农作物和果蔬中发现,糖酵解、三羧酸循环、电子传递链调节着淀粉、可溶性糖、有机酸和氨基酸代谢等重要的初级代谢,以及细胞色素氧化酶(COX)、交替氧化酶(AOX)、多酚氧化酶(PPO)、抗坏血酸氧化酶(ASO)和黄素氧化酶等多种分支途径,它们在不同发育时期不同细胞区室对代谢物积累的时间和水平起着重要调节作用[15-17]。环境的变化会影响下游呼吸途径的代谢反应,下游呼吸途径产物浓度的变化更会影响上游的呼吸途径,而限速酶的产物浓度则直接影响酶的活性[18]。
微孔膜在果蔬贮藏中可保持保鲜袋内外的气体流通,从而抑制果蔬呼吸作用,延长果蔬保鲜期[19]。PBI 保鲜袋的专一性强,安全性高,可在降低袋内氧气体积分数的同时提高二氧化碳体积分数,抑制乙烯的生成和延缓呼吸高峰的到来,延缓果蔬衰老[20]。本研究采用0.5 μL/L 1-MCP、微孔膜、PBI 气调保鲜袋、1-MCP+微孔膜及1-MCP+PBI 处理芒果,探究芒果采后贮藏期的生理品质和呼吸代谢相关酶活性变化,以期为低纬度、高海拔地区晚熟芒果采后保鲜提供技术参考和科学依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
芒果:品种为‘帕拉英达’和‘吉禄’,2020 年8 月采自云南玉溪市元江县农业技术推广服务中心芒果种植基地。
PBI 保鲜袋(35 cm×24 cm,厚度0.15 mm),以色列PBI公司;微孔膜(85 cm×70 cm,厚度0.05~0.06 mm,孔径15~20 μm),国家农产品保鲜工程技术研究中心(天津);1-MCP(5 mg/袋,有效成分含量3.33%),佛山市嘉芝诺生物科技有限公司;氢氧化钠、乙酸钠、间苯二酚、三氯乙酸,天津市大茂化学试剂厂;腺苷二磷酸、牛血清蛋白、二磷酸腺苷二钠盐、细胞色素C、细胞色素氧化酶、二硫苏糖醇、焦磷酸硫胺素、蔗糖、葡萄糖、苹果酸、二甲基对苯二胺、曲拉通X-100、谷胱甘肽、还原型辅酶1、二异丙基氨基锂、三羟甲基氨基甲烷,上海凛恩科技发展有限公司;D-葡萄糖-6-磷酸二钠盐、氯化镁、碳酸氢钾、乙二胺四乙酸二钠盐,天津市风船化学试剂科技有限公司;β-巯基乙醇、琥珀酸钠,山东西亚化学工业有限公司;丙酮、2,6-二氯酚靛酚钠、盐酸,重庆川东化工有限公司。其他试剂均为国产分析纯。
1.1.2 仪器与设备
WGDW-100L恒温恒湿试验箱,温州韦度电子有限公司;CR-400 色差计,柯尼卡美能达投资有限公司;TB90T 糖度计,广州市速为电子科技有限公司;GY-3指针式水果硬度计,衢州艾普计量仪器有限公司;HH-8数显恒温水浴锅,常州国华电器有限公司;UV-1800 紫外分光光度计,日本岛津制作所;AR224CN 分析天平,奥豪斯仪器(上海)有限公司;8685A PH 计,衡欣科技股份有限公司;HC-3018R 高速冷冻离心机,科大创新股份有限公司。
1.2 方法
1.2.1 处理方法
通过前期芒果贮藏预试验确定0.5 μL/L 1-MCP处理效果最佳,1-MCP 处理时间为24 h。将挑选好的新鲜芒果随机分成6组,每组50个芒果。
CK:未经1-MCP 处理也未使用气调袋,将芒果装入塑料筐,置于(13±1)℃的环境下贮藏。
1-MCP 处理组:使用40 ℃温水在烧杯中配制0.5 μL/L 1-MCP 溶液,与预冷后的芒果置于塑料帐内,迅速封闭塑料帐,将芒果置于(13±1)℃的环境下贮藏24 h后取出,装入塑料筐继续置于(13±1)℃的环境下贮藏。
微孔膜处理组:将预冷后的芒果用微孔膜包装(每袋5个果实)后置于(13±1)℃的环境下贮藏。
PBI气调包装处理组:将预冷后的芒果用PBI气调袋包装(每袋5个果实)后置于(13±1)℃的环境下贮藏。
1-MCP+微孔膜处理组:预冷后的芒果经0.5 μL/L 1-MCP 处理后用微孔膜包装(每袋5 个果实)后置于(13±1)℃的环境下贮藏。
1-MCP+PBI 气调包装处理组:预冷后的芒果经0.5 μL/L 1-MCP 处理后用PBI 气调袋包装(每袋5 个果实)后置于(13±1)℃的环境下贮藏。
将处理好的芒果于(13±1)℃贮藏30 d,每5 d取样测定各指标,每个指标重复测定3次,结果取平均值。
通过对‘帕拉英达’和‘吉禄’芒果果实保鲜方式进行筛选,得出1-MCP+PBI 气调包装对两种芒果均具有良好的保鲜效果,在此基础上测定1-MCP+PBI气调包装对‘帕拉英达’和‘吉禄’芒果呼吸代谢酶的影响。‘帕拉英达’芒果果实的对照组和1-MCP+PBI处理组分别用P-ck、P 表示;‘吉禄’芒果果实的对照组和1-MCP+PBI 处理组分别用J-ck、J表示。
1.2.2 测定项目与方法
1.2.2.1 黄化指数和病情指数
黄化指数的测定方法参考文献[21],病情指数的测定方法参考文献[22],并略作修改。芒果的转黄级别和病情级别详见表1。
黄化指数和病情指数的计算公式分别为:
1.2.2.2 腐烂指数
根据果实表面腐烂程度分为0~4 级[23]。0 级:无腐烂;1级:1~3个腐烂点;2级:1/4≤腐烂面积<1/2;3级:1/2≤腐烂面积<3/4;4级:腐烂面积≥3/4。
1.2.2.3 商品率
注:式中的0级和1级果实表示果实表面腐烂程度分级中的0级和1级。
1.2.2.4 失重率
采用称重法[24]测定。
式中:m0为果实初始质量;m1为测定时的果实质量。
1.2.2.5 硬度
使用硬度计测定。
1.2.2.6 可溶性固形物含量
使用手持糖度计测定。
1.2.2.7 VC含量
采用2,6-二氯酚靛酚滴定法[25]测定。
1.2.2.8 可滴定酸含量
参照袁芳等[26]的酸碱滴定法测定。
1.2.2.9 呼吸强度
采用碱静置法[27]测定。
1.2.2.10 色差
参考文献[28],使用色差计测定。
1.2.2.11 呼吸代谢相关酶活性
(1)酶提取液的配制
提取液A:50 mmol/L Tris-HCl 缓冲液(pH 7.4)、0.5 mol/L蔗糖、2 mg/mL牛血清蛋白、5 mmol/L乙二胺四乙酸二钠盐、0.3%β-巯基乙醇,等比例混合,置于4 ℃备用。
提取液B:50 mmol/L 磷酸盐缓冲液(PBS)(pH 为7.4)与2.0%曲拉通X-100等比例混合,置于4 ℃备用。
(2)酶液的制备
参考Matsumoto等[29]的方法,并略作修改。
磷酸己糖异构酶(GPI)、丙酮酸激酶(PK)、葡萄糖-6-磷酸脱氢酶(G-6-PDH)、苹果酸脱氢酶(NADMDH)、NADP型苹果酸酶(ME):称取芒果15.0 g研磨后,加150 mL 浓度为50 mmol/L 的磷酸盐缓冲液(PBS),冰浴匀浆后,于7 000 r/min、4 ℃离心35 min,过滤上清液。再离心35 min,取上清液于4 ℃保存待测。
琥珀酸脱氢酶(Sdh)、丙酮酸脱氢酶(PDC)、细胞色素氧化酶(COX):称取30 g 果肉冰浴研磨至匀浆,加150 mL 预冷的提取液A,于5 000 r/min、4 ℃离心30 min,取上清7 000 r/min、4 ℃离心30 min,弃上清液、取沉淀,加预冷的丙酮15 mL,7 000 r/min、4 ℃离心30 min,弃上清液。所得沉淀为线粒体,每管加50 mL提取液B后,振荡,冰浴待测或-80 ℃保存。
(3)呼吸代谢酶活性的测定
呼吸代谢相关酶活性的测定参考史娟等[30]的方法,并略作修改。
磷酸己糖异构酶:准确量取酶液0.5 mL,然后加入15 mmol/L 6-磷酸葡萄糖溶液5 mL,30 ℃水浴中反应10 min后,加2.5 mL 10%三氯乙酸终止反应,加入10 mL 30% HCl 和5.0 mL 0.1%间苯二酚,80 ℃水浴8 min,冷却后在520 nm处测定吸光度值。
琥珀酸脱氢酶:于试管中准确加入5 mL 浓度为50 mmol/L的PBS(pH 7.4),0.2 mL浓度为1.2 mol/L的琥珀酸钠(pH 7.4)以及0.2 mL 浓度为0.9 mmol/L的2,6-二氯酚靛酚钠,混匀后于30 ℃水浴10 min,加酶液1 mL,在600 nm处测定吸光度值。
葡萄糖-6-磷酸脱氢酶:将8 mL浓度为0.025 mol/L的MgCl2溶液,2 mL 浓度为50 mmol/L 的6-磷酸葡萄糖与2 mL酶液混匀,在340 nm处测定吸光度值。
丙酮酸激酶:取50 mmol/L PBS(pH 7.4)500 μL加入10 μL的二异丙基氨基锂和50 μL酶液,在340 nm处测定吸光度值。
丙酮酸脱氢酶:将2 mL浓度为50 mmol/L 的PBS(pH 7.4)溶液、2 mL浓度为1.0 mmol/L的MgCl2、2 mL 0.2 mmol/L 硫胺素焦磷酸、2 mL 浓度为0.1 mmol/L的2,6-二氯酚靛酚钠、2 mL 浓度为2.0 mmol/L 的丙酮酸钠溶液和2 mL 酶液混匀,于340 nm 处测定吸光度值。
细胞色素氧化酶:取酶液1 mL,加入纯水10 mL,0.04%细胞色素C溶液2 mL,37 ℃预热2 min,加入1 mL 0.4%二甲基对苯二胺溶液,37 ℃水浴1~3 min至反应液呈红色为止。在510 nm处测定吸光度值。
苹果酸脱氢酶:量取酶液1.5 mL、800 mmol/L Tris-HCl 1.5 mL、40 mmol/LMgCl20.75 mL、200 mmol/L KHCO30.75 mL 及10 mmol/L 谷胱甘肽0.75 mL,3.0 mmol/L 还原型辅酶10.75 mL、高纯水1.5 mL 混匀后,迅速在340 nm波长下测定吸光度值。
NADP 型苹果酸酶:将4.5 mL 酶液、7.5 mL 浓度为4.0 mmol/L的苹果酸、1.5 mL浓度为800 mmol/L的Tris-HCl(pH 7.4)混匀后,立即在340 nm波长下测定吸光度值。
呼吸代谢相关酶在酶的相应波长下测定10 min内的吸光度,以每分钟吸光度值变化计算酶活性,参考文献[31]中过氧化物酶活性的计算方式,如下所示:
式中:ΔOD为每分钟反应吸光度变化值;ODF为反应混合液吸光度终止值;ODI为反应混合液吸光度初始值;tp为反应终止时间,min;tI为反应初始时间,min。
以每分钟吸光度变化值增加1 时为该酶的一个酶活性单位(U)。酶活性计算公式如下:
式中:V为样品提取液总体积,mL;VS为测定时所取样品提取液体积,mL;m为样品质量,g。
1.2.3 数据处理
用Excel 2016 和Origin 2021 软件进行数据处理分析及绘图,用SPSS 23.0 软件对数据进行差异显著性分析。
2 结果与分析
2.1 不同处理对芒果贮藏期间外观指标的影响
由表2 可知,随着贮藏时间的延长,‘帕拉英达’果实的外观品质呈逐渐下降的趋势。贮藏0~20 d时,1-MCP+PBI处理组芒果的黄化指数上升缓慢;贮藏至25 d 时,各处理组芒果的黄化指数快速上升。整个贮藏期间,芒果果实的病情指数呈逐渐上升的趋势。贮藏前期(10~20 d),1-MCP 处理及气调包装均对芒果的病害有抑制作用,但贮藏至20 d后,各组的病情指数迅速上升,贮藏30 d 时,1-MCP+PBI 保鲜袋处理组果实病情指数比对照组低16.07 个百分点。果实腐烂指数随贮藏时间的延长一直升高,对照组果实最早出现腐烂现象,PBI 保鲜袋处理组果实贮藏15 d 时开始出现腐烂现象,其他处理组果实在贮藏10 d 时开始腐烂。其中对照组、1-MCP 处理组及1-MCP+PBI 处理组果实的腐烂指数上升速率较快,1-MCP+微孔膜、微孔膜及PBI 保鲜袋处理组的果实腐烂指数上升缓慢。
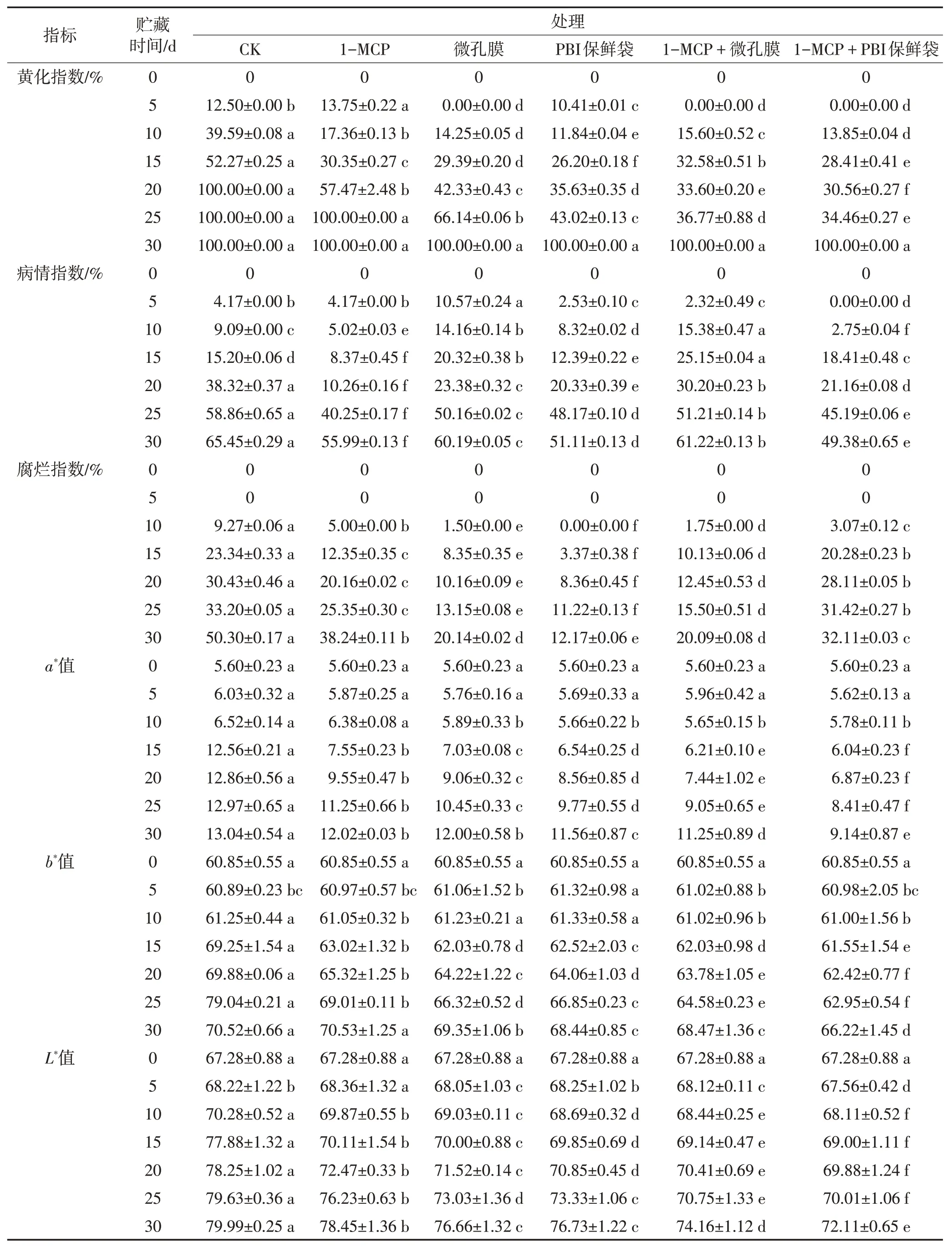
表2 不同处理对‘帕拉英达’果实贮藏期间外观指标的影响Table 2 Effects of different treatments on the appearance index of‘Palayingda’fruit during storage
色泽是评价果实品质和判断其成熟度的重要外观指标。使用色差仪测量芒果的色差,其中a*值代表红绿色,a*值为正说明样品偏红,反之偏绿;b*值代表黄蓝色,b*值为正说明样品偏黄,反之偏蓝。由表2可见,在整个贮藏过程中,‘帕拉英达’果实的a*值和b*值整体呈上升的趋势,即表明芒果果实逐渐脱绿变红黄。其中,对照组在贮藏10~15 d 时果实的a*值和b*值急剧上升,其他处理组在整个贮藏期间芒果的a*值和b*值逐渐上升,在20~25 d贮藏期间,各处理组间的a*值差异达显著水平(P<0.05)。贮藏至30 d 时,1-MCP+PBI 保鲜袋处理组‘帕拉英达’果实a*值和b*值分别比对照组低29.91%和6.10%。1-MCP+PBI保鲜袋处理能有效延缓L*值的上升。综合考虑以上结果得出1-MCP+PBI 保鲜袋处理能有效抑制‘帕拉英达’果实的色泽变化,从而延长果实的货架期。
上述结果发现:1-MCP+PBI 保鲜袋处理可有效抑制‘帕拉英达’果实外观品质的下降,这与李英丽等[32]研究报道采前1-甲基环丙烯处理推迟‘Bartlett’梨虎皮病发生时间并降低了病情指数的结论相似。
由表3 可知,随着贮藏时间的延长,‘吉禄’果实的外观品质呈逐渐下降的趋势。在整个贮藏期间,‘吉禄’果实黄化指数总体呈现逐渐上升的趋势。贮藏15~25 d,对照组的黄化指数显著高于其他处理组(P<0.05)。贮藏20~25 d,各处理组的黄化指数快速上升,其中,1-MCP+PBI保鲜袋处理对果实黄化的抑制效果最好。随着贮藏时间的延长,各处理组‘吉禄’果实病情指数呈现逐渐上升的趋势。在整个贮藏期间,对照组的病情指数不断升高;其他处理组在贮藏5~10 d期间果实的病情指数上升较快,贮藏10 d之后,果实病情指数缓慢上升。贮藏期间‘吉禄’果实的腐烂指数逐渐升高。对照组和1-MCP处理组贮藏5 d 之后,果实开始腐烂,其他处理组贮藏至第10天之后逐渐腐烂,对照组的腐烂指数显著高于其他处理组(P<0.05),贮藏至30 d时,对照组腐烂指数达到30.18%,其他处理组腐烂指数最低的仅为10.17%。表明1-MCP 结合气调包装能够有效抑制芒果的腐烂。在贮藏过程中,‘吉禄’果皮颜色均偏绿色。对照组的a*值贮藏5 d 之后显著高于其他处理组(P<0.05);b*值在贮藏期间逐渐上升,对照组和1-MCP处理组在10~15 d时b*值迅速升高,随后缓慢增加,并显著高于其他处理组(P<0.05)。结合a*值和b*值的变化情况,可得出1-MCP+PBI 保鲜袋处理芒果可抑制果实的转黄速率。贮藏至30 d时,与其他处理相比,1-MCP+PBI 保鲜袋处理显著抑制了果实L*值的上升(P<0.05)。综上表明,1-MCP+PBI保鲜袋处理可有效抑制‘吉禄’果实外观品质的下降。
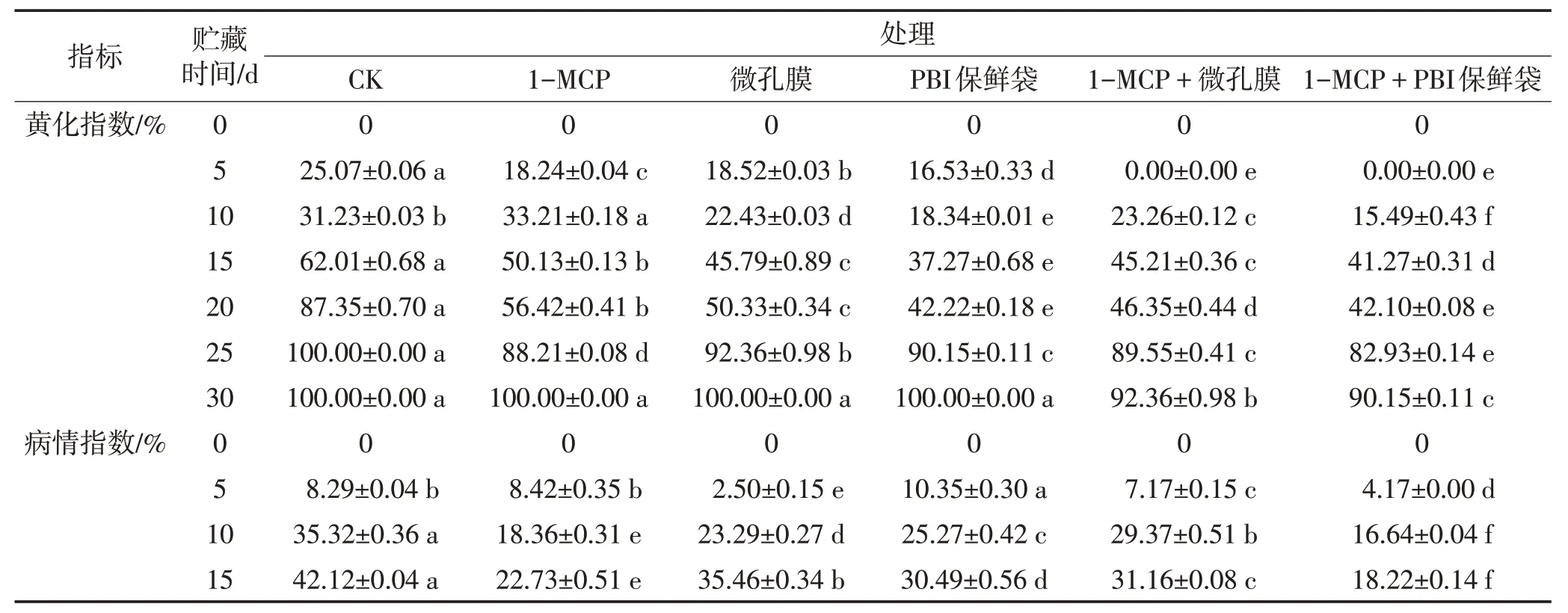
表3 不同处理对‘吉禄’果实贮藏期间外观指标的影响Table 3 Effects of different treatments on appearance index of fruits of‘Jilu’during storage
2.2 不同处理对芒果贮藏期间失重率的影响
失重率是果蔬在贮藏期间重要的品质指标。由图1 可知,随着贮藏时间的延长,采后‘帕拉英达’和‘吉禄’芒果果实的失重率逐渐升高。各处理组均在贮藏0~15 d 上升较为缓慢,20~30 d 快速上升。贮藏30 d 时,对照组的失重率达15%以上,对照组与其他处理组之间的失重率存在显著性差异(P<0.05),其中1-MCP+PBI保鲜袋处理组芒果失重率控制在3%~5%。表明1-MCP+PBI 保鲜袋处理可以有效保持这两个品种芒果采后水分和营养成分,减少贮藏期间质量损失。
2.3 不同处理对芒果贮藏期间果实硬度的影响
硬度是果蔬的质地指标,可反映果蔬成熟度和腐烂度。由图2可知,芒果在贮藏过程中硬度总体呈下降的趋势,‘帕拉英达’果实硬度下降速度大于‘吉禄’。整个贮藏期间,1-MCP+PBI保鲜袋处理组果实硬度始终最高。其中贮藏0~15 d,‘帕拉英达’果实硬度下降幅度较大,贮藏15 d之后,‘吉禄’果实硬度快速下降。两种芒果的1-MCP+PBI保鲜袋处理组果实硬度显著高于对照组(P<0.05),贮藏期间‘吉禄’的果实硬度整体高于‘帕拉英达’。表明1-MCP+PBI保鲜袋处理能更好地抑制采后芒果硬度的下降。
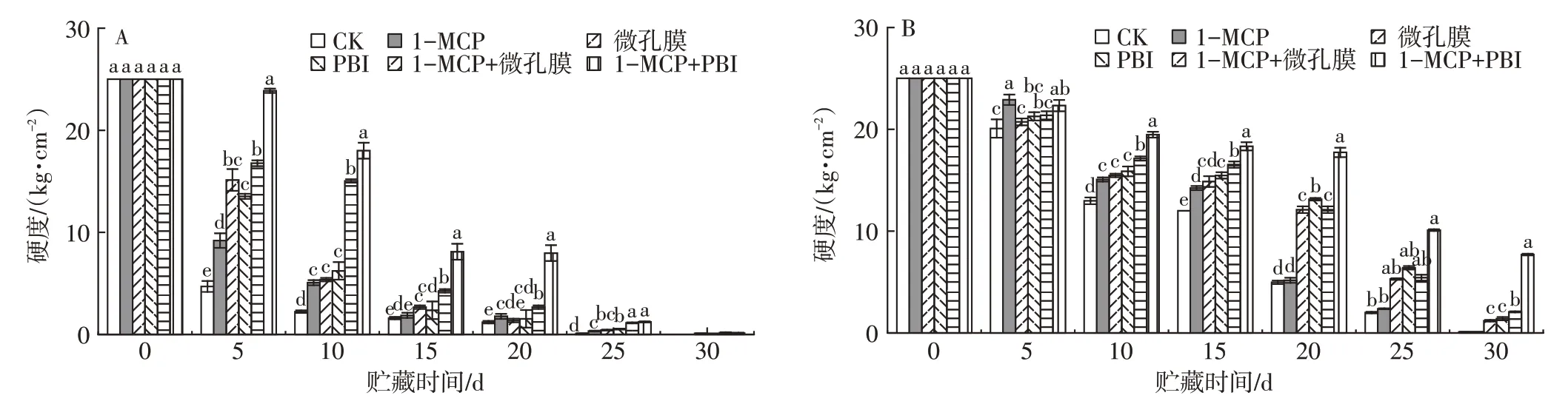
图2 不同处理对‘帕拉英达’(A)和‘吉禄’(B)芒果贮藏期间硬度的影响Fig.2 Effects of different treatments on the hardness of‘Palayingda’(A)and‘Jilu’(B)mangoes during storage
2.4 不同处理对芒果贮藏期间TSS含量的影响
可溶性固形物含量可用来评价果蔬的口感品质,与消费者喜爱程度相关,也能间接反映果蔬成熟衰老状况。由图3 可以看出,在贮藏过程中,采后芒果的可溶性固形物含量整体呈上升趋势。‘帕拉英达’对照组在0~15 d 上升较快,并在15 d 时到达峰值,之后快速下降。在整个贮藏期间,‘帕拉英达’果实的TSS 含量上升幅度大于‘吉禄’。贮藏至30 d 时,1-MCP+PBI 保鲜袋处理组‘帕拉英达’和‘吉禄’芒果TSS 含量分别比对照组低1.90 和6.87 个百分点,其中,‘吉禄’1-MCP+PBI 保鲜袋处理组TSS 含量显著低于对照组(P<0.05),表明1-MCP+PBI 保鲜袋处理可有效控制芒果TSS 含量的上升。
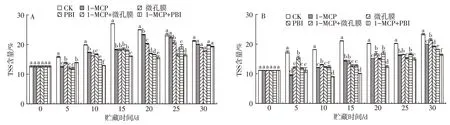
图3 不同处理对‘帕拉英达’(A)和‘吉禄’(B)芒果贮藏期间TSS含量的影响Fig.3 Effects of different treatments on TSS content of‘Palayingda’(A)and‘Jilu’(B)mangoes during storage
2.5 不同处理对芒果贮藏期间VC含量的影响
由图4 可知,采后芒果贮藏期间VC 含量整体呈先上升后下降的趋势。‘帕拉英达’芒果在贮藏0~10 d期间,各组的VC 含量快速上升,贮藏至10 d 时果实的VC 含量达到峰值,之后不断下降。‘吉禄’芒果在贮藏0~5 d期间,各组果实的VC含量缓慢上升,贮藏至5 d时果实的VC含量达到峰值,之后呈逐渐下降的趋势。贮藏初期,芒果VC含量在30 mg/100 g左右,贮藏至30 d时,1-MCP+PBI保鲜袋处理组果实的VC含量最高,显著高于对照组(P<0.05),表明1-MCP+PBI保鲜袋处理能有效降低芒果果实VC的损失。
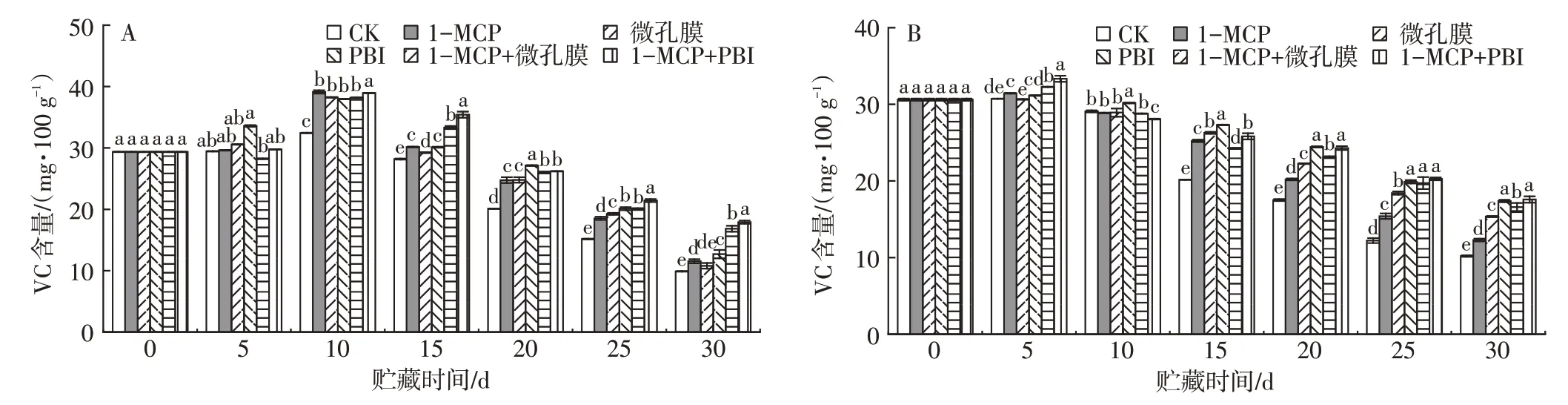
图4 不同处理对‘帕拉英达’(A)和‘吉禄’(B)芒果贮藏期间VC含量的影响Fig.4 Effects of different treatments on VC content of‘Palayingda’(A)and‘Jilu’(B)mangoes during storage
2.6 不同处理对芒果贮藏期间TA含量的影响
果实含酸量影响其风味品质,是评价芒果品质的重要指标。由图5可知,在果实贮藏过程中,TA含量整体呈下降的趋势。贮藏10~30 d,‘帕拉英达’各处理组之间以1-MCP+PBI 保鲜袋处理组的TA 含量最高,且显著高于对照组(P<0.05)。‘吉禄’芒果贮藏5~15 d,果实的TA含量快速下降,之后缓慢下降。贮藏至30 d时,1-MCP+PBI 保鲜袋处理组芒果果实TA含量显著高于对照组(P<0.05)。表明1-MCP+PBI保鲜袋处理可延缓芒果TA 含量的下降,延缓风味的变化,且对‘帕拉英达’芒果的效果最好。

图5 不同处理对‘帕拉英达’(A)和‘吉禄’(B)芒果贮藏期间TA含量的影响Fig.5 Effects of different treatments on TA content of‘Palayingda’(A)and‘Jilu’(B)mangoes during storage
2.7 不同处理对芒果贮藏期间呼吸强度的影响
由图6可以看出,‘帕拉英达’对照组果实呼吸强度在贮藏初期持续升高,贮藏10 d时达到峰值,之后呈下降的趋势。1-MCP、微孔膜和PBI保鲜袋处理组果实的呼吸峰值推迟至贮藏20 d出现,1-MCP+微孔膜和1-MCP+PBI保鲜袋处理组果实的呼吸峰值推迟至25 d 出现,对照组与其他处理组的呼吸峰值存在显著性差异(P<0.05)。其中1-MCP+PBI 保鲜袋处理组对‘帕拉英达’代谢能力的保持效果最佳,表明1-MCP+PBI保鲜袋处理可以有效推迟‘帕拉英达’果实的呼吸跃变。‘吉禄’对照组贮藏至5 d后呼吸强度快速上升,在贮藏15 d 时达到峰值,之后呈下降趋势。1-MCP 处理组果实贮藏至20 d 时达到呼吸峰值,而1-MCP+PBI 保鲜袋处理组果实的呼吸高峰推迟至30 d 出现,表明1-MCP+PBI 保鲜袋处理组可有效推迟‘吉禄’果实的呼吸跃变。综上表明,1-MCP+PBI保鲜袋处理可有效推迟‘帕拉英达’和‘吉禄’果实的呼吸跃变,这与林静颖等[33]的研究得出1-甲基环丙烯处理可降低采后‘油㮈’果实呼吸速率的结论相似。
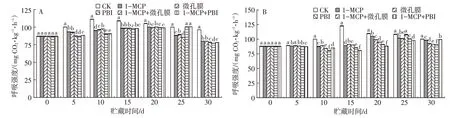
图6 不同处理对‘帕拉英达’(A)和‘吉禄’(B)芒果贮藏期间呼吸强度的影响Fig.6 Effects of different treatments on the respiratory intensity of‘Palayingda’(A)and‘Jilu’(B)mangoes during storage
2.8 不同处理对芒果贮藏期间商品率的影响
商品率可评估果实品质变化及病理指标等多个方面。由图7可以看出,两种芒果的商品率随贮藏时间的延长而降低。‘帕拉英达’芒果贮藏至15 d时,CK组果实已无商品价值。贮藏至30 d时,只有1-MCP+微孔膜和1-MCP+PBI保鲜袋处理组的果实具有商品价值,表明1-MCP 结合PBI 气调包装可有效延长‘帕拉英达’果实的货架期。‘吉禄’芒果采后贮藏0~5 d,各处理组间商品率无显著差异,随着贮藏时间的延长,各组芒果商品率迅速下降。贮藏至20 d时,CK组果实已不具有商品价值,1-MCP和PBI保鲜袋处理组果实分别在贮藏至25 d和30 d时基本不具有商品价值,而1-MCP+PBI保鲜袋处理组果实贮藏至30 d时,其商品率仍为33.19%。结果表明1-MCP+PBI保鲜袋处理组可有效延长‘帕拉英达’和‘吉禄’果实的货架期。
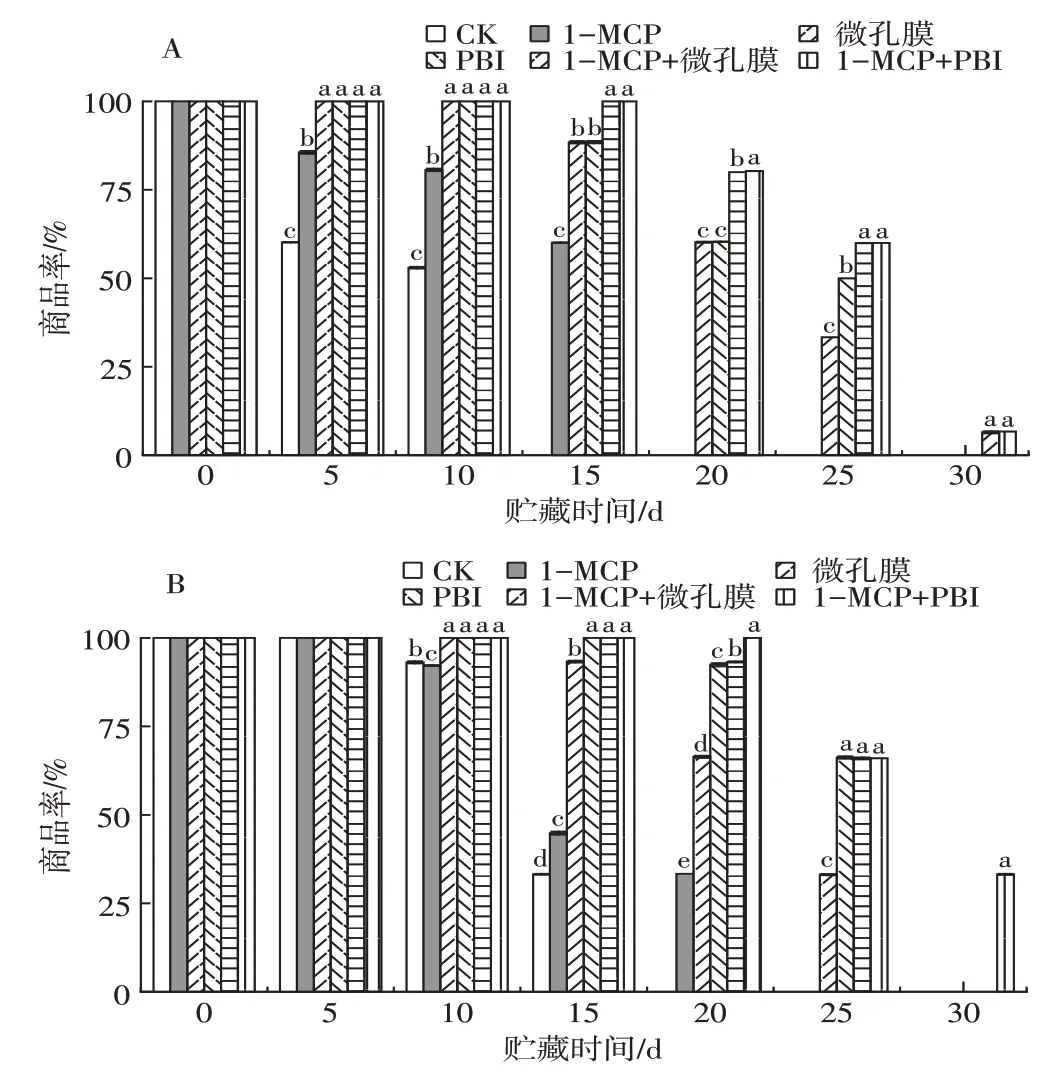
图7 不同处理对‘帕拉英达’(A)和‘吉禄’(B)芒果贮藏期间商品率的影响Fig.7 Effects of different treatments on the commodity rate of‘Palayingda’(A)and‘Jilu’(B)mangoes during storage
2.9 1-MCP+PBI保鲜袋处理对采后芒果果实呼吸代谢相关酶活性的影响
2.9.1 1-MCP+PBI 保鲜袋处理对采后芒果果实GPI和Sdh活性的影响
由图8A可知,贮藏前10 d,‘帕拉英达’芒果的磷酸己糖异构酶活性高于‘吉禄’,贮藏后期(15~30 d),‘吉禄’芒果的GPI活性高于‘帕拉英达’。‘帕拉英达’芒果GPI活性整体呈缓慢降低的趋势,经1-MCP+PBI保鲜袋处理的果实在整个贮藏过程中GPI 活性均高于对照组,说明1-MCP+PBI 保鲜袋处理能有效抑制GPI 活性的降低。‘吉禄’对照组(J-ck)贮藏至15 d时,GPI 活性达到峰值,而1-MCP+PBI 保鲜袋处理组贮藏至20 d 时,GPI 活性达到峰值。表明,1-MCP+PBI保鲜袋处理可延缓‘吉禄’果实呼吸代谢GPI活性峰值的到达,延长其货架期。
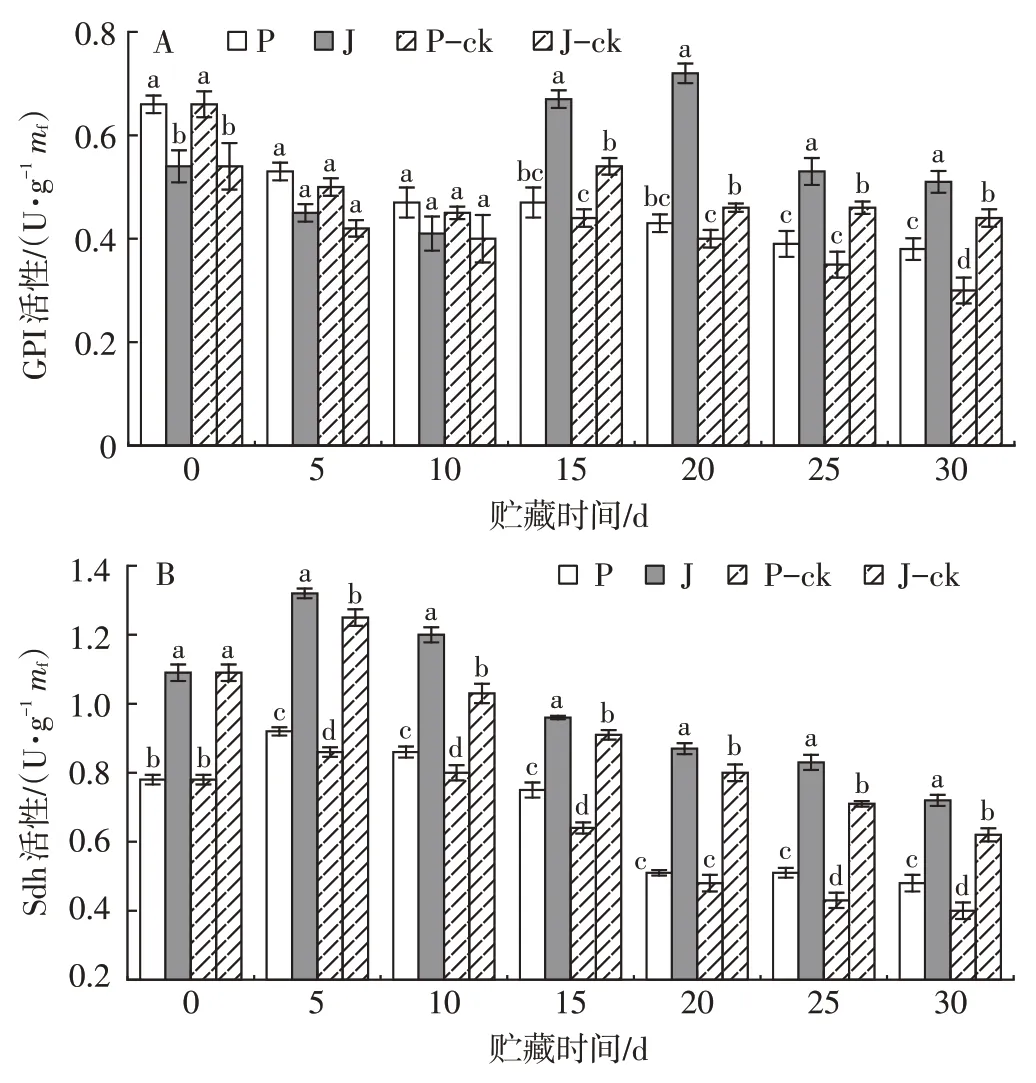
图8 1-MCP+PBI保鲜袋处理对采后芒果果实GPI(A)和Sdh(B)活性的影响Fig.8 Effect of 1-MCP combined with PBI treatment on GPI(A)and Sdh(B)activity in postharvest mango fruits
由图8B可知,在整个贮藏期间,‘吉禄’果实的琥珀酸脱氢酶活性高于‘帕拉英达’。贮藏至5 d时,各组Sdh活性达到峰值,5 d之后Sdh活性受到抑制呈缓慢下降的趋势。其中,贮藏5 d 时,1-MCP+PBI 保鲜袋处理组‘帕拉英达’和‘吉禄’Sdh 活性分别比其对照组高5.92%和4.62%,与相应的对照组差异显著(P<0.05)。贮藏30 d时,1-MCP+PBI保鲜袋处理组‘帕拉英达和‘吉禄’Sdh 活性分别比其对照组高10.26%和9.18%,与相应的对照组差异显著(P<0.05)。表明1-MCP+PBI 处理对芒果贮藏期间Sdh 活性有促进作用,保持果实的贮藏品质。
2.9.2 1-MCP+PBI 保鲜袋处理对采后芒果果实G-6-PDH和PK活性的影响
由图9A 可以看出,各处理组葡萄糖-6-磷酸脱氢酶活性整体呈现先升后降的趋势,与对照组相比,1-MCP+PBI 保鲜袋处理组均对芒果果实G-6-PDH活性有明显的促进作用,且对‘吉禄’果实的促进作用更明显。贮藏至20 d 时,各组G-6-PDH 活性达到高峰,1-MCP+PBI 处理组‘帕拉英达’和‘吉禄’果实G-6-PDH 活性分别比相应的对照组高13.95%和12.33%。直至贮藏结束,1-MCP+PBI 保鲜袋处理组‘帕拉英达’和‘吉禄’果实G-6-PDH活性始终高于对照组,且1-MCP+PBI 保鲜袋处理组与对照组之间差异显著(P<0.05)。表明1-MCP+PBI 保鲜袋处理对这两个品种的芒果贮藏期间G-6-PDH活性有促进作用,可延缓果实的成熟衰老。
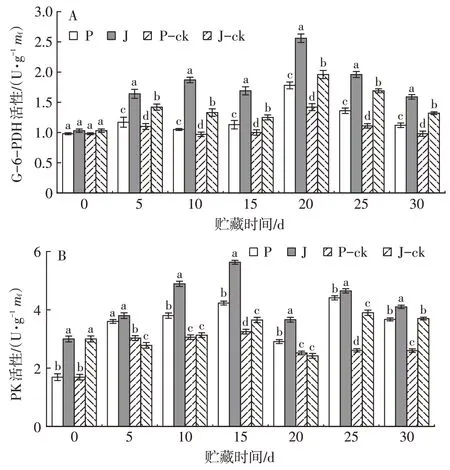
图9 1-MCP+PBI保鲜袋处理对采后芒果果实G-6-PDH(A)和PK(B)活性的影响Fig.9 Effect of 1-MCP combined with PBI treatment on G-6-PDH(A)and PK(B)activity in postharvest mango fruits
如图9B可知,在贮藏期间,‘帕拉英达’和‘吉禄’果实丙酮酸激酶活性整体呈先上升后下降的趋势。其中,贮藏15 d 时,1-MCP+PBI 保鲜袋处理组‘帕拉英达’和‘吉禄’PK 活性分别比对照组高12.05%和28.90%,1-MCP+PBI 保鲜袋处理组与相应的对照组差异显著(P<0.05)。贮藏期间,‘帕拉英达’各处理组果实PK 活性均小于‘吉禄’。贮藏15、25 d 时,两个品种的芒果PK 活性存在显著性差异(P<0.05)。
2.9.3 1-MCP+PBI 保鲜袋处理对采后芒果果实PDC和COX活性的影响
由图10A可知,丙酮酸脱氢酶活性整体呈先上升后下降的趋势。贮藏期间‘帕拉英达’PDC 活性整体高于‘吉禄’。贮藏至20 d 时,‘帕拉英达’果实PDC活性达到高峰,1-MCP+PBI 保鲜袋处理组PDC活性比对照组高17.03%;而‘吉禄’贮藏至15 d 时,PDC 活性达到高峰,1-MCP+PBI 保鲜袋处理组PDC 活性比对照组高9.15%,且存在显著性差异(P<0.05)。‘帕拉英达’和‘吉禄’果实PDC 活性达到峰值后快速下降。贮藏至30 d 时,‘帕拉英达’1-MCP+PBI 保鲜袋处理组PDC 活性比‘吉禄’1-MCP+PBI 保鲜袋处理组高42.62%,‘帕拉英达’和‘吉禄’1-MCP+PBI 保鲜袋处理组PDC 活性分别比相应的对照组高1.64%和42.86%。

图10 1-MCP+PBI保鲜袋处理对采后芒果果实PDC(A)和COX(B)活性的影响Fig.10 Effect of 1-MCP combined with PBI treatment on PDC(A)and COX(B)activity in postharvest mango fruits
由图10B可知,‘帕拉英达’与‘吉禄’果实细胞色素氧化酶活性在贮藏期间呈先上升后下降的趋势,且在15 d 时达到峰值。整个贮藏过程中,‘吉禄’果实COX活性始终低于‘帕拉英达’,且贮藏至30 d时,1-MCP+PBI保鲜袋处理组‘帕拉英达’和‘吉禄’果实COX 活性分别比相应的对照组高28.23%和63.16%,表明1-MCP+PBI 保鲜袋处理对芒果COX 活性有促进作用。
2.9.4 1-MCP+PBI 保鲜袋处理对采后芒果果实NAD-MDH和ME活性的影响
由图11A 可知,随着贮藏时间的延长,‘帕拉英达’和‘吉禄’果实各组苹果酸脱氢酶活性整体呈上升的趋势,贮藏0~25 d,‘吉禄’果实NAD-MDH 活性较高。贮藏至30 d时,1-MCP+PBI保鲜袋处理组‘帕拉英达’和‘吉禄’果实NAD-MDH活性分别比相应的对照组高31.96%和21.72%。
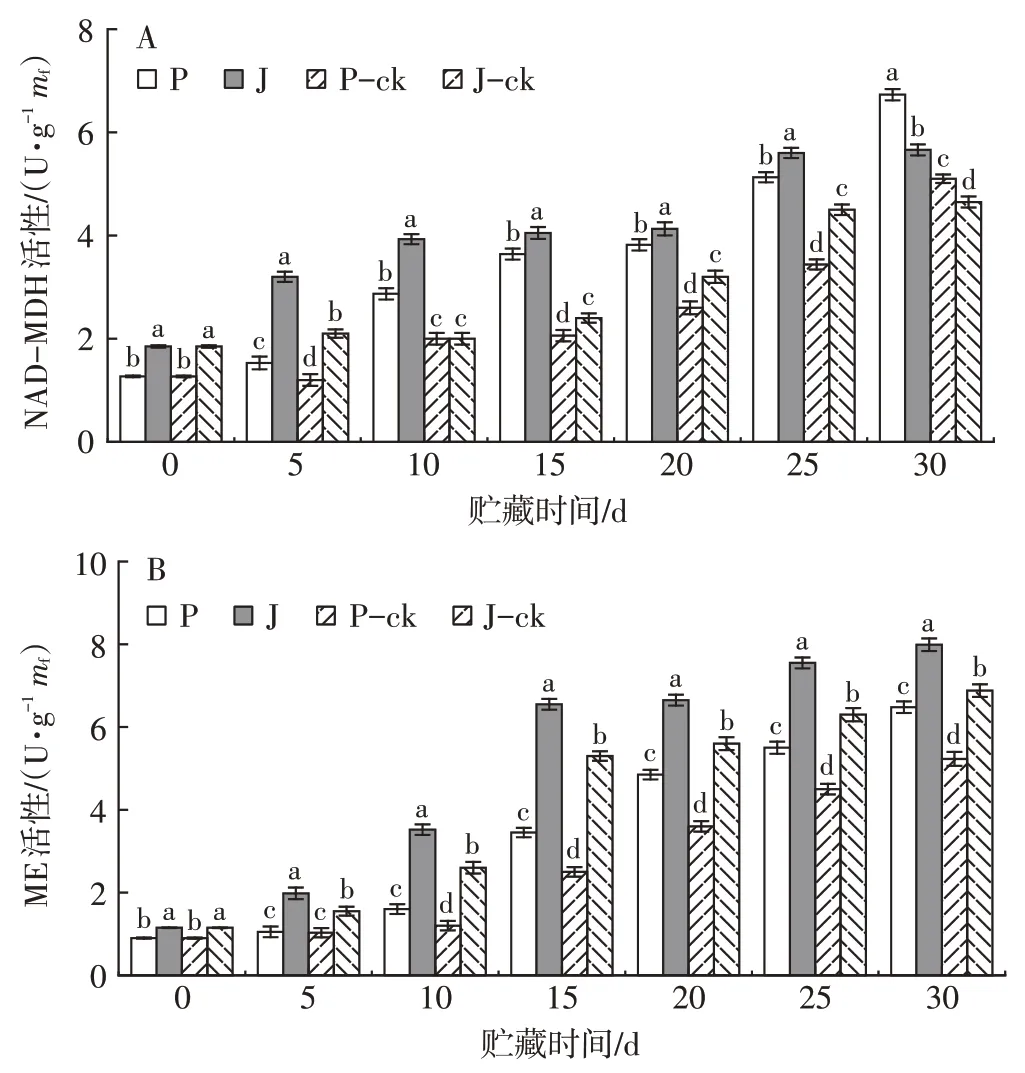
图11 1-MCP+PBI保鲜袋处理对采后芒果果实NAD-MDH(A)和ME(B)活性的影响Fig.11 Effect of 1-MCP combined with PBI treatment on NADMDH(A)and ME(B)activity in postharvest mango fruits
如图11B 所示,NADP 型苹果酸酶活性随贮藏时间的延长而逐渐上升,贮藏前期ME 活性较低,贮藏至10 d后ME活性开始快速上升,并且各组之间差异显著(P<0.05),整个贮藏期间‘吉禄’果实ME 活性均高于‘帕拉英达’。贮藏第30 天时,1-MCP+PBI保鲜袋处理组‘帕拉英达’和‘吉禄’果实ME 活性分别比相应的对照组高23.90%和16.13%。结果表明,1-MCP+PBI 保鲜袋处理对芒果NAD-MDH 及ME 活性有促进作用,可延缓果实成熟衰老。
3 讨论与结论
云南元江晚熟芒果品种‘帕拉英达’和‘吉禄’营养价值、产销量高,但收获时间集中,芒果采后极易成熟和软化,导致其货架期相对较短,并使产品供应链及物流受到严重限制[34]。因此,寻找抑制芒果成熟软化的调控技术成为生产中亟待解决的重要问题[35-36]。
本课题采用1-MCP、微孔膜、PBI 气调保鲜袋、1-MCP+微孔膜、1-MCP+PBI 气调保鲜袋5种保鲜方式处理‘帕拉英达’与‘吉禄’两种芒果,研究采后各处理对两种芒果果实在(13±1)℃温度下贮藏品质及呼吸代谢相关酶活性的影响。结果表明:0.05 µL/L 1-MCP+PBI气调保鲜袋处理芒果可有效维持果实外观品质,抑制硬度、可滴定酸含量、VC 含量及商品率的下降,抑制果实呼吸强度延缓呼吸高峰出现。在相同采收成熟度下,1-MCP+PBI 气调保鲜袋处理两种芒果的反应不同,在同样的贮藏期,1-MCP+PBI气调保鲜袋处理对‘吉禄’的保鲜效果优于‘帕拉英达’,能维持较高的硬度、VC含量和可滴定酸含量,抑制病情指数、黄化指数、腐烂指数及呼吸强度的上升。此外,与对照相比,1-MCP+PBI保鲜袋处理可抑制‘帕拉英达’和‘吉禄’果实GPI、Sdh、PK、PDC、G-6-PDH、NAD-MDH、ME和COX等呼吸代谢相关酶活性变化,有效维持两个品种芒果较高的呼吸代谢相关酶的活性。‘帕拉英达’对照组贮藏至第10 天时达到呼吸高峰,‘吉禄’对照组在贮藏至第15 天达到呼吸高峰。两个品种芒果的酶活性对比,发现‘吉禄’在贮藏期内PK、G-6-PDH、Sdh、NAD-MDH 和ME 5种酶活性高于‘帕拉英达’,而‘吉禄’在贮藏期内GPI、PDC和COX 3种酶活性高于‘帕拉英达’。虽然元江主栽两种芒果均为中晚熟品种,但‘吉禄’营养丰富且呼吸代谢相关酶显著高于‘帕拉英达’,耐贮藏性优于‘帕拉英达’。因此,‘吉禄’芒果更适宜销售半径较长区域的推广应用。
1-MCP处理晚熟芒果贮藏效果优于单一气调贮藏,而1-MCP 结合PBI 自发气调处理能达到更好的贮藏效果。这些研究结果对于云南芒果贮藏条件的优化,贮藏过程中的代谢研究与控制具有一定的参考价值,为低维度高海拔高原特色果蔬的贮藏保鲜提供一条新途径。

