乳腺导管原位癌MRI表现与p53表达及临床病理的关系
王小英 顾海玉 金红玉

【摘要】 目的:探讨分析乳腺导管原位癌(DCIS)磁共振成像(MRI)表现与p53蛋白(p53)表达及临床病理的关系。方法:回顾性研究60例2018年1月—2021年12月在南昌市人民医院经手术病理证实的DCIS患者的乳腺MRI平掃+增强的资料,观察记录患者病理分级和MRI表现[动态增强曲线、早期强化率、表观弥散系数(ADC)、病灶形态学],采用免疫组化法检测癌组织p53表达情况,分析MRI表现与p53表达及临床病理的关系。结果:DCIS患者MRI表现主要为非肿块强化37例(61.67%,37/60),以节段性强化(19例,51.35%)和簇环强化(17例,45.95%)为主。动态增强曲线主要以Ⅰ型为主(25例,41.67%),早期强化率以早期快速强化为主(22例,36.67%)。ADC值<1.0×10-3 mm2/s较多,占65.00%(39/60)。p53阳性、高核级别中TIC类型为Ⅲ型和早期快速强化占比均显著高于p53阴性、非高核级别,差异均有统计学意义(P<0.05);p53(阳性、阴性)和病理分级(高核级别、非高核级别)在形态学、非肿块强化分布形式和内部强化及ADC比较,差异均无统计学意义(P>0.05)。p53表达与病理分级有关。高核级别的DCIS患者p53阳性表达发生率更高,差异有统计学意义(P<0.05)。结论:DCIS患者MRI表现具有特异性,主要表现为节段性分布和簇环强化的非肿块强化,以早期快速强化和I型TIC曲线多为常见。MRI表现与p53表达和临床病理分级有关,通过分析MRI表现可为DCIS患者的治疗和预后提供参考。
【关键词】 乳腺导管原位癌 磁共振成像 p53蛋白 病理分级
The Relationship between MRI Findings, p53 Expression, and Clinical Pathology of Ductal Carcinoma in Situ of the Breast/WANG Xiaoying, GU Haiyu, JIN Hongyu. //Medical Innovation of China, 2024, 21(04): -145
[Abstract] Objective: To explore and analyze the relationship between magnetic resonance imaging (MRI) findings, p53 protein (p53) expression and clinicopathology in ductal carcinoma in situ of breast (DCIS). Method: A retrospective study was conducted on MRI plain scan + enhancement data of 60 patients with surgically and pathologically confirmed DCIS in Nanchang People's Hospital between January 2018 and December 2021, the pathological grading and MRI findings [dynamic enhancement curve, early enhancement rate, apparent diffusion coefficient (ADC), focal morphology] of patients were observed and recorded, the expression of p53 in carcinoma tissues was detected by immunohistochemistry, the relationship between MRI findings, p53 expression and clinicopathology was analyzed. Result: The main MRI findings in DCIS patients were non-mass enhancement [37 cases (61.67%, 37/60)], which was mainly on segmental enhancement (19 cases, 51.35%) and cluster-ring enhancement (17 cases, 45.95%). The dynamic enhancement curves were mainly on type Ⅰ (25 cases, 41.67%), and early enhancement rate was mainly on fast enhancement (22 cases, 36.67%). The proportion of cases with ADC value <1.0×10-3 mm2/s was high [65.00% (39/60)]. The proportions of type Ⅲ TIC and early fast enhancement in p53 positive and high nuclear grading were significantly higher than those in p53 negative and non-high nuclear grading, the differences were statistically significant (P<0.05); but there were not significant differences in morphology, distribution of non-mass enhancement, internal enhancement or ADC among patients with different p53 expression (positive, negative) and pathological grading (high nuclear grade, non-high nuclear grade) (P>0.05). The expression of p53 was related to pathological grading. The incidence of p53 positive was higher in patients with high nuclear grade of DCIS, the difference was statistically significantly (P<0.05). Conclusion: MRI findings are specific in DCIS patients, which are mainly characterized by non-mass enhancement with segmental distribution and cluster-ring enhancement, and early fast enhancement and type Ⅰ TIC curves are common. MRI findings are related to p53 expression and pathological grade. The analysis of MRI findings can provide reference for the treatment and prognosis of DCIS patients.
[Key words] Ductal carcinoma in situ of breast Magnetic resonance imaging p53 protein Pathological grading
乳腺导管原位癌(ductal carcinoma in situ of breast,DCIS)是最常见的非侵袭性乳腺癌,属于早期原位癌[1]。有研究显示,部分DCIS会随病情进展成为浸润性导管癌,故早期发现诊断治疗对预防浸润的发生意义重大[2]。既往研究报道,DCIS的发生发展和预后与病理分级和分子水平变化密切相关[3],诸多分子生物标志物在决定了DCIS形态学的同时还会影响影像学表现。p53蛋白(p53)作为一种抑癌基因,其表达水平与肿瘤分化程度、浸润和转移等有关,可反映DCIS的生物学行为及预后[4-5]。磁共振成像(magnetic resonance imaging,MRI)软组织结构显示清晰,且可获得多方位的图像,对病变本身及病变范围的评估更加准确,能够反映病变的生物学特性,现已被广泛应用于DCIS的临床诊断中[6-7]。因分子标志物指标在术前指导DCIS的治疗有一定局限性,故对DCIS患者MRI的表现及其与p53表达和临床病理的关系进行探讨分析,可为DCIS的术前早期诊断,制订针对性治疗治疗方案提供更准确和丰富的参考信息。
1 资料与方法
1.1 一般资料
回顾性研究60例2018年1月—2021年12月在南昌市人民医院经手术病理证实的DCIS患者作为研究对象,均为女性,年龄34~65岁,平均(49.52±5.19)岁,均为单侧病变。纳入标准:均经手术病理检查确诊为DCIS;术前行乳腺MRI平扫+增强检查;临床资料完整;在本院接受手术治疗。排除标准:既往有乳腺疾病史者和恶性肿瘤史;存在DCIS伴微浸润;存在MRI检查禁忌;存在精神障碍和沟通障碍;存在孕产妇。本研究经南昌市人民医院医学伦理委员会批准。
1.2 方法
1.2.1 MRI检查 (1)常规MRI方法:采用西门子1.5TAvanto进行检测。指导患者采取俯卧位,双侧乳房自然悬垂于乳腺相控阵线圈中,适当加压固定乳房,乳头位于最低点,并嘱患者平静呼吸,避免呼吸运动伪影。行常规扫描轴位T1加权成像(T1 weighted imaging,T1WI)及三方位T2加权成像(T2 weighted image,T2WI)扫描平扫序列扫描参数,①T1WI[快速自旋回波(turbo-spin echo, TSE)序列]:回波时间(echo time,TE)=14 ms,重復时间(repetition time,TR)=600 ms,层厚5 mm,层数36层,层间距1 mm,视野(field of view,FOV)280 mm×340 mm×144 mm,重建矩阵:480,激励次数(number of excitation,NEX):2;②T2WI[频率衰减反转恢复序列(spectral attenuated inversion recovery, SPAIR)]:TE=28 ms,TR=4 800 ms;层厚5 mm,层数36层,层间距1 mm;FOV 250 mm×340 mm×144 mm,重建矩阵:576,NEX:2。(2)弥散加权成像(diffusion weighted imaging,DWI)检查:患者进行冠状、横断、矢状位定位扫描后,将仪器设为TSE序列实施DWI检查,弥散敏感因子(b值)取0 s/mm2、1 000 s/mm2。(3)磁共振动态对比增强(DCE-MRI)检查:随后进行DCE-MRI扫描,于增强前多翻转角扫描,随后采取轴位压脂T1动态增强序列及延迟期薄层扫描,对其采用Vibrant 成像技术,在其图像预扫描效果较为良好之后,可开始注射磁共振对比剂[钆喷酸葡胺(生产厂家:北京北陆药业股份有限公司,批准文号:国药准字H10860001,规格:15 mL︰7.04 g)],剂量维持在0.15~0.25 mmol/kg。
1.2.2 图像采集和分析 将采集到的图像传送至工作站,获得表观弥散系数(apparent dispersion coefficient,ADC)图,测量ADC值:选择病变显示最大的层面,然后手动画出感兴趣区(避开明显的出血、液化和坏死及囊变等部位),以得到病变的ADC值;病灶动态增强表现由绘制时间-信号强度曲线(time-signal strength curve,TIC)分为Ⅰ型、Ⅱ型和Ⅲ型:Ⅰ型曲线为渐进型曲线,特征为动态观察时间内信号增强持续增加;Ⅱ型曲线又叫平台型曲线,特征为早期信号强度逐渐增加,信号强度达到峰值后,维持此水平形成中晚期平台;Ⅲ型曲线又称为廓清型曲线,特征为早期信号逐渐增加,当信号达到峰值后降低。在获得TIC曲线上测量早期强化率[增强扫描2 min时信号强度-基线信号强度)/基线信号强度],其中早期快速强化:早期强化率>100%;早期中度强化:早期强化率为50%~100%;早期缓慢强化:早期强化率<50%。病灶形态学:包括肿块和非肿块,其中肿块从形态学(形态、边缘)和内部强化特征(均匀、不均匀和边缘强化)进行描述;非肿块强化从病灶分布形式(节段性、区域性、线性、局灶、多区域和弥漫强化)和内部强化类型进行描述(均匀、不均匀、集丛和簇环强化)进行描述。
影像分析均是由2名具有5年以上丰富工作经验的影像学医师在已知病理结果和病变部位的情况下,按照乳腺影像报告与数据系统(breast imaging reporting and data system,BI-RADS)分类阅片,对诊断意见不同的患者需讨论制订出一致结论。
1.3 p53检测和病理核分级
1.3.1 p53 采用免疫组化法行p53检测,术中取患者癌组织常规石蜡包埋后,将石蜡组织切为连续切片(厚度为5 μm。对切片行脱蜡、水化处理后,采用枸椽酸盐液修复抗原15 min,经磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗后,加入3%的过氧化氢室温避光孵育30 min,采用含1%牛血清白蛋白(bovine serum albumin,BSA)的PBS封闭10~15 min,再分别向其中加入p53抗体(1︰50,Dako公司),在4℃的条件下进行过夜培育,加二抗于37℃条件下孵育1 h,使用二氨基联苯胺(diaminobenzidine,DAB)显色后以苏木素复染,然后脱水,待全部完成后对切片行封闭处理,然后在显微镜下观察,记录染色肿瘤细胞的百分数。p53阳性:p53阳性细胞表达率≥10%。
1.3.2 病理核分级 由2名及以上工作经验为5年的病理学医师对病变行描述和诊断,并参考相关分类标准,将DCIS分为高(伴或不伴坏死)、中(伴坏死)和低核级别(不伴坏死),其中中、低核级别为非高核级别。
1.4 统计学处理
均以SPSS 23.0行数据分析,计数资料以例(%)表示,采用字2检验,等级资料行秩和检验;两组间差异比较行t检验,多组间差异比较行单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 病理分级和p53表达情况
60例患者中低核级别16例,中核级别23例,高核级别21例;p53阳性表达31例。
2.2 MRI表现
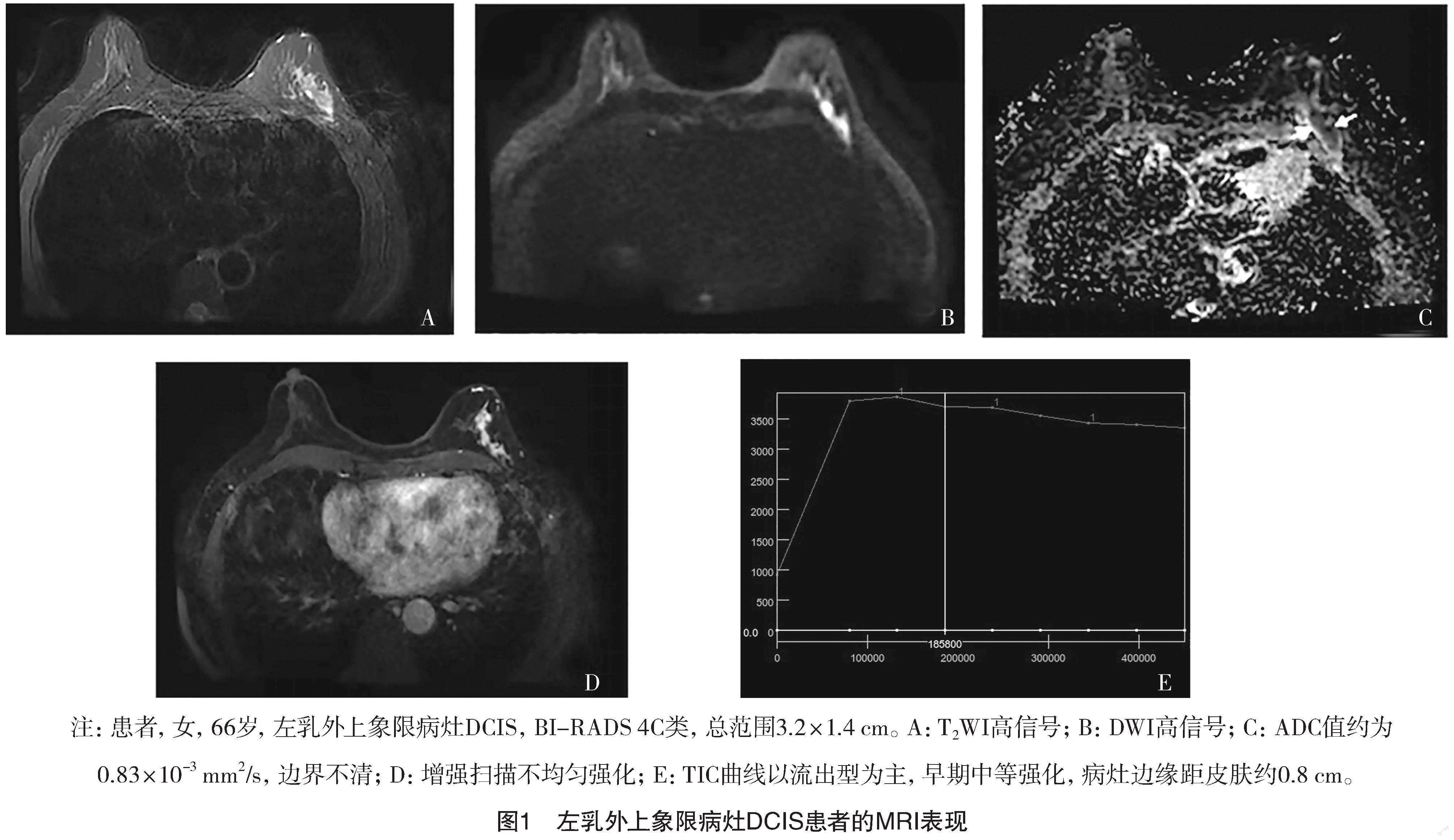
2.2.1 典型图例 见图1。
2.2.2 病灶形态学 (1)非肿块强化37例(61.67%,37/60),分布形式:节段性强化19例,区域性强化8例,线性强化4例,局灶性强化4例,多区域强化1例,弥漫强化1例;内部强化:簇环强化17例,集丛12例,不均匀强化5例,均匀强化3例;(2)肿块型23例(38.33%,23/60),均表现为类圆形,边界清楚,不均匀强化。
2.2.3 病灶ADC值 T2WI高信号,DWI高信号,ADC值<1.0×10-3 mm2/s 39例(65.00%,39/60),平均0.83×10-3 mm2/s;ADC值≥1.0×10-3 mm2/s 21例(35.00%,21/60),平均1.22×10-3 mm2/s。
2.2.4 病灶动态增强 Ⅰ型TIC 25例,Ⅱ型TIC 19例,Ⅲ型TIC 16例;早期缓慢强化20例,早期中度强化18例,早期快速强化22例。
2.3 MRI表现与p53表达及临床病理的关系
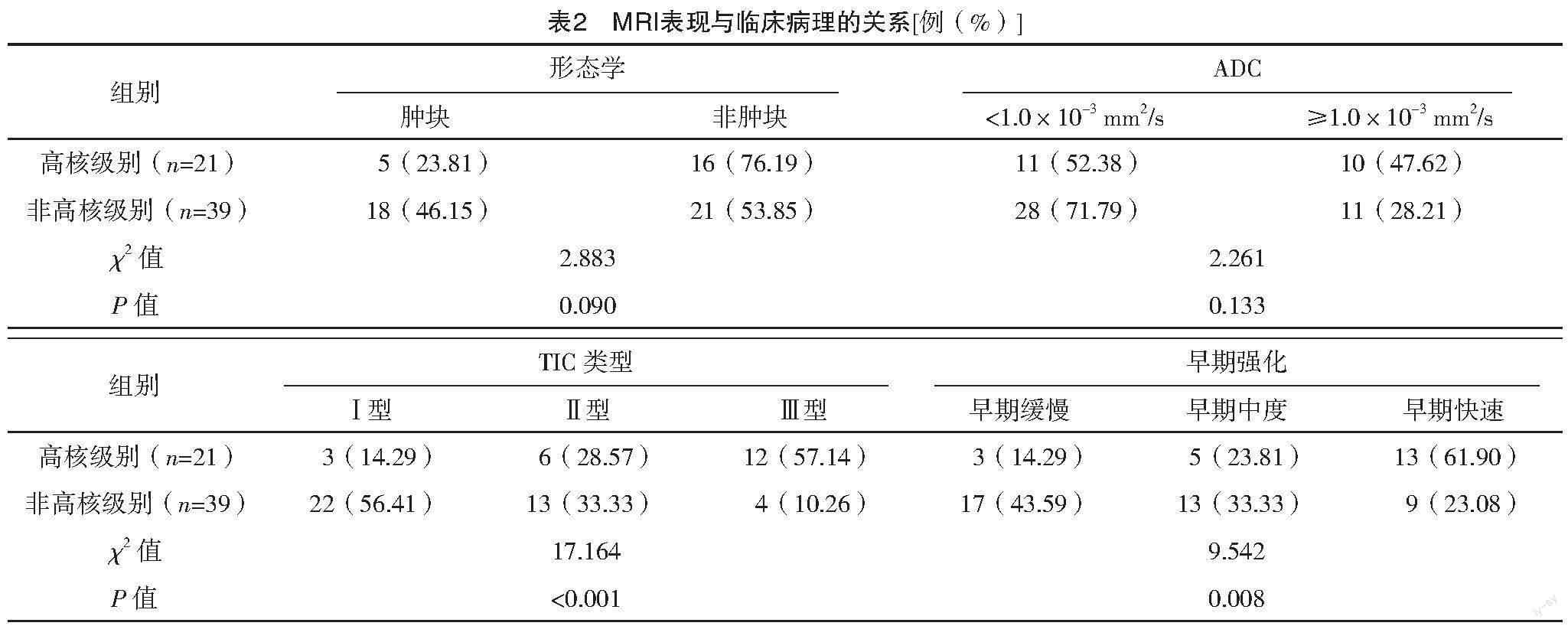
p53阳性、高核级别中TIC类型为Ⅲ型和早期快速强化占比均显著高于p53阴性、非高核级别,差异均有统计学意义(P<0.05);p53(阳性、阴性)和病理分级(高核级别、非高核级别)在形态学、非肿块强化分布形式和内部强化及ADC比较,差异均无统计学意义(P>0.05)。见表1~4。
2.4 p53表达与临床病理的关系
p53表达与病理分级有关,高核级别的DCIS患者更易出现p53阳性表达,差异有统计学意义(Z=6.150,P<0.013),见表5。
3 讨论
DCIS是一种节段性疾病,多数发生于终末导管小叶单位,也可发生于大导管,是局限于乳腺导管内的原位癌[8-9]。近年,DCIS发展成为浸润性癌的趋势愈发明显,但目前对哪种DCIS易发展成为浸润性癌尚无明确定论。因而早期诊断予以治疗是阻止浸润性癌发生的关键一步。MRI增强扫描可反映DCIS的分布特点,且对浸润癌检出率的敏感度较高[10],有利于帮助临床医师更加准确的评估患者病情。故掌握DCIS患者MRI影像学特征对早期诊断意义重大。
既往研究显示,非肿块强化中的节段性强化被认为是DCIS增强后的特征性表现[11]。本研究结果显示,DCIS患者MRI表现主要为非肿块强化37例(61.67%,37/60),以节段性强化(19例,51.35%)和簇环强化(17例,45.95%)为主,造成此种征象的原因可能与导管内癌有丰富的血供有关,增强时导管周围基质和导管壁强化,垂直于导管切面的则表现为小环形强化,平行的则表现为线样或轨道样强化[12]。区域性强化范围较大,不沿导管走行,且分布范围无特异性表现,故不能采用节段性强化来描述,常表现为地图状或斑片状强化。本研究中也发现8例表现为区域性强化。本研究中肿块型23例(38.33%,23/60),均表现为类圆形,边界清楚,不均匀强化。因非肿块样强化通常是浸润性导管癌伴较广泛DCIS改变的表现,故以肿块样强化为主的DCIS病灶应优先考虑浸润性导管癌[13]。TIC反映了病变在动态增强中信号强度的变化,与对比剂的灌注和血流流出有关,且早期强化率会随着病情的发展依次从良性-DCIS-浸润性导管癌逐渐增加[14-15]。本次研究发现TIC Ⅰ型TIC 25例,Ⅱ型TIC 19例,Ⅲ型TIC 16例,早期强化率以早期快速强化为主(22例,36.67%),提示DCIS患者TIC类型多种多样,既可表现为恶性曲线,也可表现为良性曲线。可能与肿瘤血管密度低和血管化程度不一有关。本研究还发现,DCIS患者均表现为T2WI高信号和DWI高信号。
病理分级可反映DCIS患者生物学特点,与预后有关[16],根据核异型性可分为低、中、高级别,其中高级别的复发风险均显著高于中、低级别。本研究中,60例患者中低核级别16例,中核級别23例,高核级别21例,且病理分级在TIC类型、早期强化率比较上,差异有统计学意义,提示DCIS患者MRI表现与病理分型密切相关,即高核级别的DCIS患者更易表现为Ⅲ型TIC和早期快速强化。考虑为高核级别的DCIS患者病变范围较大,侵袭性也更强,故易表现出Ⅲ型TIC曲线和早期快速强化,而非高核级别则很少出现恶性病变,故表现为Ⅰ型TIC和早期缓慢强化。
p53在正常细胞中的表达很低,一般难以检测出,然而突变型p53的表达产物则可被检测出,故通过免疫组化检测出的p53均为突变型,突变型p53会发挥抑癌作用,导致肿瘤细胞恶变[17]。研究显示,p53的过度表达提示原癌基因扩增,可促进肿瘤细胞的活动,导致肿瘤浸润和转移,预后较差[18-19]。由此推测,p53的表达可能与DCIS的发生发展有关。本研究显示p53阳性表达31例(51.67%),且p53的表达在TIC类型、早期强化率比较上有明显差异,提示p53在DCIS中呈现高表达,参与了DCIS的进展过程,并与其MRI表现有一定关系。可能是由于p53高表达的DCIS患者更易发生淋巴结转移和侵袭,组织分级也更高,且p53高表达表明肿瘤中的微血管密度增加,导致患者MRI更易表现为Ⅲ型TIC和早期快速强化。徐丽娜等[20]研究也表明,随着TIC分型的增加,p53阳性表达率也逐渐升高,本研究与其基本一致。本研究中还显示,p53表达与病理分级有关,高核级别的DCIS患者更易出现p53阳性表达,可能是与高核级别的DCIS患者恶性程度更严重有关。
综上所述,DCIS患者MRI表现为节段性分布和簇环强化的非肿块强化,以早期快速强化和Ⅰ型TIC曲线多为常见,且MRI表现与病理分级和p53表达有关,临床可通过MRI表现来预测病理分级和p53表达情况。
参考文献
[1] BADVE S S, G?KMEN-POLAR Y.Ductal carcinoma in situ of breast: update 2019[J].Pathology,2019,51(6):563-569.
[2] CHIH WAN GOH,吴佳毅,朱丽.乳腺浸润性导管癌伴导管原位癌的病理特征及预后关系研究[J].外科理论与实践,2019,24(6):550-554.
[3]马发鹏,常宝,王时茂,等.乳腺导管原位癌X线特征与病理核分级及不同肿瘤因子表达相关性[J].放射学实践,2020,35(6):731-735.
[4] MORRISSEY R L,THOMPSON A M,LOZANO G.Is loss of p53 a driver of ductal carcinoma in situ progression?[J].Br J Cancer,2022,127(10):1744-1754.
[5] VISSER L L,ELSHOF L E,VAN DE VIJVER K,et al.Discordant marker expression between invasive breast carcinoma and corresponding synchronous and preceding DCIS[J].Am J Surg Pathol,2019,43(11):1574-1582.
[6] GREENWOOD H I,WILMES L J,KELIL T, et al.Role of breast MRI in the evaluation and detection of DCIS: opportunities and challenges[J].J Magn Reson Imaging,2020,52(3):697-709.
[7] RAHBAR H,TJOE J A.Breast MRI in the setting of DCIS: quality trials are still needed to determine its value[J].Eur Radiol,2021,31(8):5877-5879.
[8]滕敏敏,邵元伟,方娟娟,等.乳腺导管内原位癌的MRI特征与HER-2表达的相关性分析[J].中国辐射卫生,2022,31(4):507-511.
[9]刘静,张晔,阎文婷,等.乳腺导管原位癌和导管原位癌伴微浸润患者的临床病理特征及预后差异分析[J].第三军医大学学报,2020,42(13):1355-1359.
[10]赵雪,朱晓龙,赵茹.MRI对乳腺導管原位癌及浸润性导管癌的鉴别诊断价值[J].中国CT和MRI杂志,2022,20(8):105-107.
[11]李康,白晨光,刘念龙.不同病理类型非肿块样强化乳腺癌MRI表现的初步研究[J].现代医学,2021,49(9):1086-1090.
[12]许晓琴,汪登斌,王丽君,等.乳腺导管原位癌MRI特征及其与病理分级的关系[J].中国全科医学,2019,22(18):2248-2252.
[13]刘碧华,郑晓林,李晏,等.非肿块强化导管内原位癌与浸润性导管癌的MRI内部特征及分析[J].临床放射学杂志,2019,38(7):1198-1203.
[14]郭静丽,刘浩,黄晓斌,等.MR动态增强TIC曲线联合表观弥散系数在乳腺良恶性病变中的应用价值[J].中国CT和MRI杂志,2022,20(9):97-98.
[15]赵倩,李莹,陈宗耀,等.肿块型乳腺浸润性导管癌MR环状强化的组织病理学及影像特点分析[J].中国体视学与图像分析,2018,23(3):229-234.
[16]张敏,林青,苏晓慧,等.乳腺导管原位癌X线表现与病理学免疫组织化学分型关系的分析[J].中华放射学杂志,2021,55(2):148-153.
[17]王彦龙,肖兰,朱丽娜,等.不同p53表达乳腺癌临床病理特征及MRI表现对照分析[J].四川医学,2021,42(2):162-166.
[18]周蕾,张敏,宋平,等.酪氨酸激酶2与P53在乳腺癌中表达的相关性及与临床病理特征之间的关系[J].临床和实验医学杂志,2019,18(8):818-822.
[19]崔婷婷,李红,张倩,等.乳腺癌肿瘤代谢异质性与p53基因表达和淋巴结转移相关性的研究[J].现代肿瘤医学,2019,27(15):2670-2673.
[20]徐丽娜,唐竹晓,李双标,等.乳腺癌3.0T MRI影像学表现及临床病理特征研究[J].中国CT和MRI杂志,2021,19(5):43-45,74.

