中医院校本科生层次递进式开展流式细胞术实验方法课程的实践 *
于 雪 张淑静 高 阔 刘 燕 冯 婧 田雷瑜 王淑艳 甘秀伦 汤 阳
(北京中医药大学中医学院,北京 102488)
在过去的30 年里,流式细胞术取得了巨大的进步,使得免疫系统和其他细胞生物学领域的研究出现了前所未有的发展[1,2]。流式细胞术是一种对溶液中的单个细胞进行快速多参数分析的技术,流式细胞仪利用激光作为光源,产生散射光信号和荧光信号,由光电二极管或光电倍增管等探测器读取,这些信号被转换成电子信号,由计算机分析并写入标准化格式(.fcs)数据文件。流式细胞术是一种强大的工具,在免疫学、细胞分子生物学、细菌学、癌症生物学、病毒学和传染病监测中都有广泛应用[3-7]。北京中医药大学中医学院面向本科生的“橘井青苗”计划,意在培养学生科研思维,提高其动手实践能力和技术应用能力。
近年来,医学院校陆续在本科生和研究生中开展流式细胞仪的实验教学与实践的课程,并取得了较好的预期效果[8-13]。“培养拔尖创新人才”是高校“双一流”建设中的任务之一,在实践训练方面,北京中医药大学办学理念开放,在多年中医高层次人才培养办学的经验基础上,依据“五维一体”的中医拔尖创新人才培养目标,构建了以“一以贯通”为设计思路,“多途径培养”为育人途径的中医拔尖创新人才培养模式[14]。有研究[15]揭示,中医院校医学本科生渴望参与科研活动的积极性较高,但实际的科研渠道获取较为狭窄,多数仍流于形式。中医院校大学生创新创业课题,鼓励大学生切身参与到科研实验中,虽然本科生课程安排比较紧凑,较难有完整的时间去完成较为复杂的科学研究,但是本科生的科研兴趣较浓厚。张萌等[16]提到,在实验技能提升模块需要开设独立的创新教育课程,包括一般仪器设备、高级仪器设备的使用方法,基本实验技术等。因此,如何利用本中心已经搭建好的院级流式细胞术技术服务平台,为学生提供多样化、高水平、适合中医院校本科生的流式细胞术的实验教学、科研方案,并有效解决目前面临的一系列问题,尤为重要。基于此,作者结合多年从事细胞培养和流式细胞术的经验,以参与北京中医药大学中医学院“橘井青苗”计划的本科生为研究对象,进行教学探索。在课程设置上,作者做了两种层次递进式的实验安排:初阶为细胞缺氧造模和CCK-8 法检测细胞存活率实验;进阶为流式细胞术检测细胞的凋亡,包括样本的制备、调节电压、上样检测和数据分析等模块。此举的主要目的是希望通过这两种层次递进式的实验设计,力图探索通过现场教学结合上机实操的方式激发学生的求知欲,提高学生应用流式细胞术解决实际科研问题的能力。
1 实验设计
1.1 实验目的(1)明确实验室安全知识的重要性并学习掌握;(2)学习细胞的传代流程,学会正倒置一体荧光显微镜的使用方法;(3)掌握流式细胞术检测样本的制备方法和细胞凋亡上机检测的设置方法;(4)初步学会解读和分析流式细胞术的检测结果。
1.2 实验材料与仪器实验材料:胎牛血清(北京翱擎生物科技有限公司)、0.25%胰蛋白酶消化液(含EDTA,赛默飞世尔科技公司)、DMEM 培养基(赛默飞世尔科技公司)、DMSO(Sigma-Alrdich)、CCK-8 检测试剂盒(上海碧云天生物技术有限公司),AnnexinV-FITC 细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),C2C12细胞系等。
实验仪器:离心机(德国艾本德股份公司)、三气培养箱(赛默飞世尔科技公司,160i)、酶标仪(美国Cpoch 公司,bio-tek)、倒置荧光显微镜(美国Echo 公司,Revolve FL)、流式细胞仪(美国BD 公司,FACSCelesta)等。
1.3 实验方法
1.3.1 对本科生进行出入实验室安全培训本科生的课程设置中也有常规教学实验,但教学实验室和科研实验室的规模、管理以及可能接触的实验类物品有差别。作者首先对本科生进行实验室现场安全培训,目的是让本科生重视实验室安全,实验室安全知识包括但不限于以下内容:细胞培养技术平台实验室的研究范围,主要仪器如高压灭菌锅、电热恒温干燥箱、细胞培养箱、超净台、离心机、酶标仪、显微镜和流式细胞仪的主要用途,细胞实验室生物安全,垃圾分类处理,消防设备存放位置以及使用等。
1.3.2 本科生学会科研设计以及试剂的购置本科生的教学实验,实验内容和实验物品由负责课程的教师提前准备,对于科研实验,需要先进行文献查阅,再根据实验设计需求购置。
1.3.3 小鼠成肌细胞C2C12的复苏、传代与缺氧造模液氮罐中取出C2C12 细胞株进行复苏,使用含10%胎牛血清的DMEM 培养基培养,当传至2~3代时,观察到细胞的培养状态良好,将细胞按照1×105个/mL,分别接种于96 孔板和24 孔板中,当细胞生长至80%饱和度时,对照组放置在37 ℃、5%的CO2的培养箱中,缺氧造模组细胞放在三气培养箱(O2∶CO2∶N2=1∶5∶94)中进行缺氧造模,继续培养24 h后进行检测。
1.3.4 使用CCK-8检测试剂盒检测细胞存活率实验分为两组,对照组不做处理,缺氧组在三气培养箱中缺氧造模24 h 后检测,设置空白组(没有细胞),加入100 μL DMEM 培养液,正常组和缺氧组中加入10 μL 的CCK-8溶液+90 μL DMEM 培养液,37 ℃、5%的CO2培养箱中培养45 min 后,用酶标仪测定在450 nm 的吸光度(OD 值)。细胞相对存活率(RSR)=(缺氧组OD-空白组OD)/(对照组OD-空白组OD)×100%。
1.3.5 细胞凋亡检测试剂盒检测细胞的凋亡用不含有EDTA 的胰酶消化细胞,取(5~10)×104重悬的细胞,1000 g离心5 min后弃上清,磷酸盐(PBS)缓冲液清洗1次,1000 g离心5 min后再弃上清,然后在细胞沉淀中加入提前配置的195 μL Annexin V-FITC 结合液+5 μL Annexin V-FITC重悬细胞,再加入10 μL碘化丙啶染色液,轻轻混匀,在室温中避光孵育20 min后,加入200 μL 缓冲液终止反应后置于冰上,立即进行流式细胞仪上机检测。
1.3.6 流式细胞仪的上机操作现场教学流式细胞仪的三个系统:液流系统、光学系统和电子系统,流式细胞术的专业术语:前向散射光(FSC)、侧向散射光(SSC)、荧光信号、荧光信号的相关参数(脉冲高度、面积和宽度)、黏连体、设门、“十”字门、四象限、荧光补偿、同型对照等。流式细胞仪如何补充鞘液、清理废液桶和实时观察流式细胞仪主机上的信号灯。样品的收集:(1)打开Diva 软件,做2 个散点图:散点图1:X轴为FSC-A,Y 轴为SSC-A;散点图2:X 轴为FITC-A,Y 轴为PI-A。(2)先将空白管样品放在样品支架上。(3)从流式细胞仪主机上打开RUN,从Diva 软件上选择acquire 模式,实时观察细胞的收集情况。(4)调整散点图1 为FSC-A 和SSC-A 的电压(当FSC-A 的电压增大,细胞群体往右移动,当SSC-A 的电压增大,细胞往上移动);实时查看细胞群体的移动过程,当细胞群体出现在合适位置,且显示无较多碎片,圈门实验(不规则门,根据细胞群体实际情况)。(5)将散点图1的圈门策略应用于散点图2作为研究对象,画一个“十字门”,调节散点图2 的FITC-A 和PI-A 的电压,空白组细胞未染色,此时细胞位于十字门的Q4阴性区域。(6)调节好荧光电压之后,依次检测单染样本和混合染色样本。(7)数据的导出与分析。

图1 小鼠成肌细胞C2C12的培养(10×10)
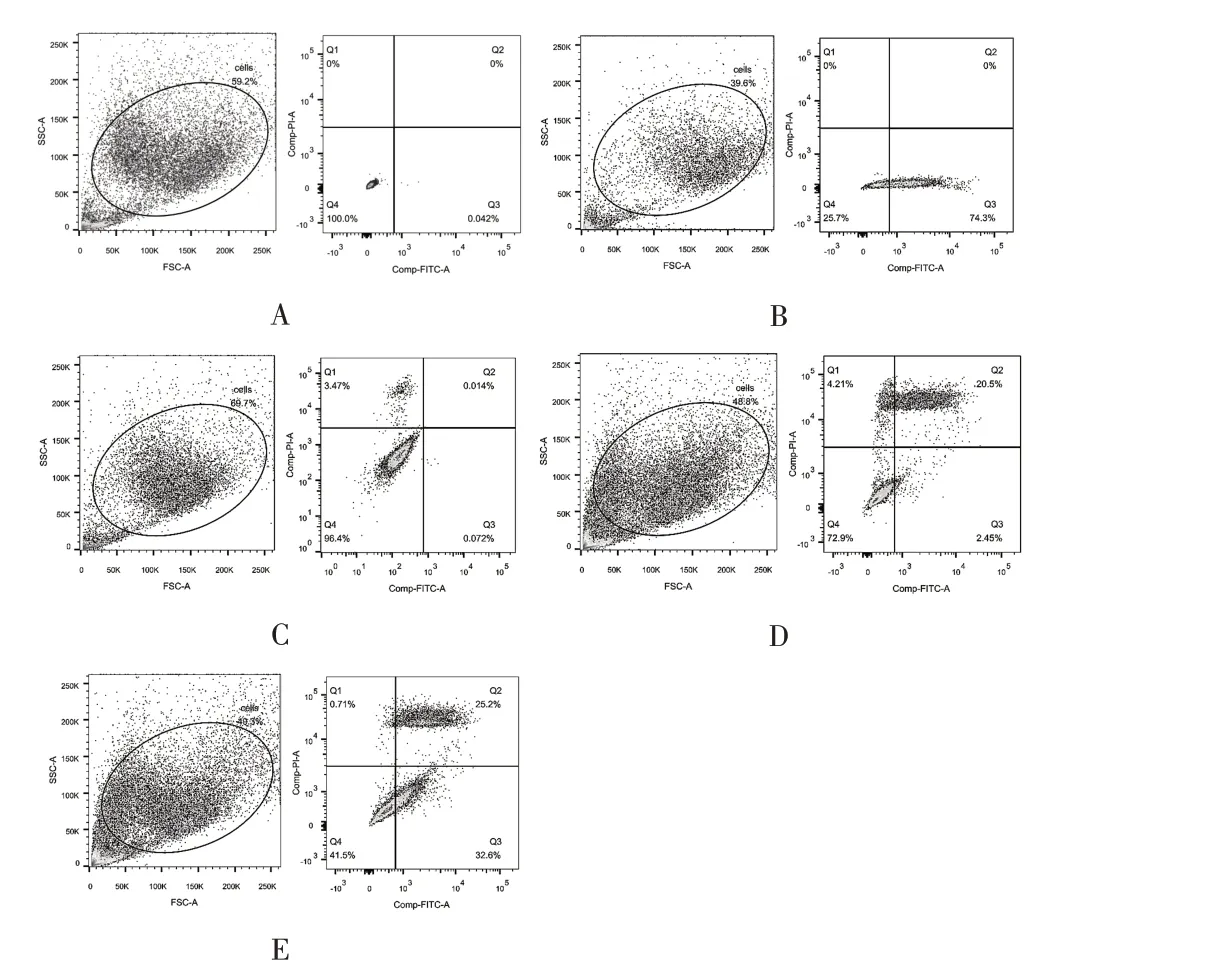
图2 小鼠成肌细胞C2C12的细胞凋亡情况
1.3.7 统计学方法应用软件FlowJo_V10 软件对细胞凋亡结果进行分析;应用软件SPSS 22.0统计分析所有实验数据,计量资料用(±s)表示,行t检验。P<0.05 为差异有统计学意义。
2 实验结果与讨论
2.1 科研实验室安全知识教育学生加强了对实验室安全性的认识,在入室培训到细胞平台的参观学习中了解到科研实验室与平时教学实验室的不同,提高了安全意识。
2.2 小鼠成肌细胞的复苏与培养观察和CCK-8法检测细胞的存活率学生参与了细胞的传代过程,学会了如何使用正倒置一体荧光显微镜,观察C2C12 并拍照,结果显示正常细胞的形态结构正常、细胞膜完整,见图1;掌握了如何使用酶标仪检测细胞的存活率,结果显示,缺氧组与对照组比较,细胞存活率降低了16.3%,差异有统计学意义(P<0.05)。见表1。
表1 细胞相对存活率 (± s,%)

表1 细胞相对存活率 (± s,%)
注:与对照组比较,1)P<0.05。
存活率100.0±0.0555 83.7±0.20571)组别对照组缺氧组鼠数55
2.3 流式细胞术检测细胞凋亡与软件的教学使用调节前向和侧向电压,找到研究细胞的群体,对需要研究的细胞群体圈门,并将圈门策略应用于荧光散点图中,荧光散点图设为“十”字门四象限,象限内数值单位为“%”,显示该象限细胞占总细胞的百分比。横纵轴数值代表不同荧光标记的流式抗体结合的相对荧光强度值。结果显示,缺氧处理后的细胞,其凋亡细胞(Annexin V-FITC+PI-的细胞)明显增加(E 组的右下象限),坏死细胞(Annexin V-FITC+PI+)也有所增加(E 组的右上象限)。见图2。
2.4 科研实验教学效果评价满意度情况实践过程中,鼓励本科生查阅文献,进行FCM 实验设计课题,根据FCM 实验设计课题的质量对学生进行考核。同时,我们收集并整理了他们参与本科研实验教学的最大收获及意见或建议,学生对教学质量满意度达到95%以上。
3 结语
本实践中,我们根据细胞平台多年带教研究生科学研究实验经验,结合本次参与“橘井青苗”计划学生的摸索与实践,形成了具有细胞培养平台特色的、层次递进式的科研实验教学经验。采用不同于本科生实验教学模式的探索,以科学研究需求为导向,建立了一种适合本科生的科研教学设计方案和教学方法,使得具有较浅医学知识背景的学生,在学习过程中能够发挥自己的主观能动性,主动查阅文献去设计课题并在实验平台完成预定的科学研究,学生的学习热情较高,学习效果理想。大学生进入实验室,学习到了科研实验室的实验安全、常规仪器的操作、仪器的简单维护、如何查阅文献设计科研课题以及实验数据的分析与统计等知识,为将来的科研实验和临床探索奠定了良好的实验基础。
本研究的课题设计包括细胞的复苏与传代、CCK-8法检测细胞的存活率、流式细胞术检测细胞的凋亡水平。实验结果显示,缺氧组细胞的存活率较低,并发生了一定程度的细胞凋亡。另外,考虑到教学经费预算问题以及本科生进入科研实验室的生物危害,我们在本科生的教学科研实验中将继续采用缺氧造模的细胞进行培训,安全性较高。同时在实际的培训过程中,我们也发现了一些问题,相对于研究生,本科生科研热情度高,但是知识理论系统的欠缺、主体课程的安排较满,一定程度上限制了其科研能力的培养和提升。

