白果肽的二肽基肽酶-Ⅳ抑制活性及其抑制机理研究
王翔,张彩虹,蒋建新,谢普军*,黄立新*
1(中国林业科学研究院林产化学工业研究所,江苏 南京,210042)
2(北京林业大学 材料科学与技术学院,北京,100083)
Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)是一种由胰岛素抵抗或胰岛素相对缺乏引起的慢性疾病,严重威胁着人们的生命安全[1]。据统计,全球目前约有4.15亿人患有Ⅱ型糖尿病,如不加控制,预计到2040年,其患者人数将达到6.42亿[2]。研究表明,抑制二肽基肽酶-Ⅳ(dipeptidyl peptidase Ⅳ,DPP-Ⅳ)活性可有效治疗T2DM。目前,临床上常用的DPP-Ⅳ抑制剂,如沙格列汀、西他列汀和维格列汀等人工合成类药物虽疗效显著,但长期服用可能会引起头痛、尿道和上呼吸道感染等不良反应[3]。因此,寻找高效、低毒副作用的新型DPP-Ⅳ抑制剂成为当下研究热点。近年来,食源性DPP-Ⅳ抑制肽因其天然、安全和高效等优点在治疗T2DM中备受关注。
白果,作为我国传统食品,富含蛋白质和多种活性成分[4],但由于加工技术的限制,目前对于白果的利用,仅停留在食品加工的初级阶段,经济效益较低,导致每年大量的白果被丢弃,造成严重资源浪费和环境污染。为实现白果的高值化利用,课题组前期采用酶解法将白果中提取得到的蛋白质水解为高附加值的多肽[5-6],并对其DPP-Ⅳ抑制活性进行了初步的探索,发现白果肽具有一定的DPP-Ⅳ抑制活性,其中,以白果肽(phenylalanine-alanine-proline-serine-tryptophan,FAPSW和methionine-proline-glycine-proline-proline,MPGPP)表现最优。为进一步量化其抑制活性,研究其构效关系,本实验以FAPSW和MPGPP为原料,通过体外抑制试验评估其DPP-Ⅳ抑制活性,并采用分子对接和分子动力学模拟技术,从分子和原子水平上阐明其抑制机理。该研究结果可为白果肽在功能食品领域的开发和利用提供一定的理论基础,同时为白果的高值化利用提供了有力支持。
1 材料与方法
1.1 材料与试剂
FAPSW和MPGPP多肽由课题组前期鉴定所得[5],并通过Fmoc固相合成制备,其一级质谱和二级质谱如图1所示。
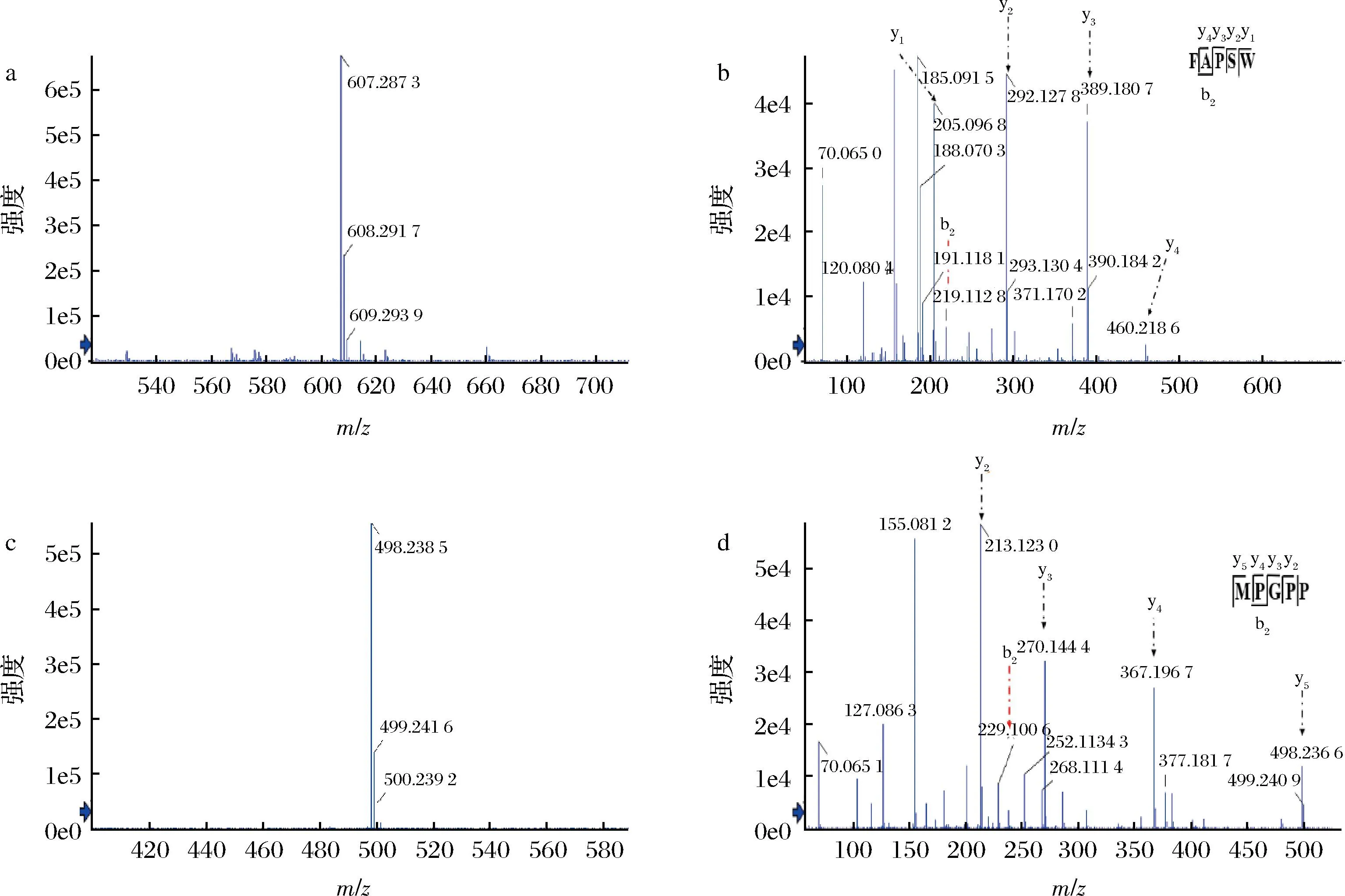
a-FAPSW的一级质谱图;b-FAPSW的二级质谱图;c-MPGPP的一级质谱图;d-MPGPP的二级质谱图
西他列汀(纯度≥97%),阿拉丁试剂有限公司;DPP-Ⅳ筛选试剂盒(MAK203),Sigma-Aldrich(上海)贸易有限公司。
1.2 仪器与设备
SpectraMax®i3x荧光多功能酶标仪,美国Molecular Devices公司;CPA225D分析天平,北京赛多利斯仪器公司。
1.3 实验方法
1.3.1 白果肽DPP-Ⅳ体外抑制实验
使用DPP-Ⅳ抑制剂筛选试剂盒测定FAPSW和MPGPP对DPP-Ⅳ的抑制活性。将50 μL DPP-Ⅳ溶液与25 μL不同质量浓度的多肽(FAPSW和MPGPP)溶液加入到96孔板中,37 ℃孵育10 min。其中,MPGPP的质量浓度为0.066、0.132、0.265、0.530、1.060 g/L,FAPSW的质量浓度为1.0、2.0、2.50、3.0、4.0 g/L。待孵育完成后,体系中加入25 μL DPP-Ⅳ反应底物,于λ=360 nm激发波长和λ=460 nm发射波长下连续测定其荧光强度,检测时长为30 min,时间间隔为1 min。西他列汀为阳性对照。多肽对DPP-Ⅳ的抑制活性计算如公式(1)、公式(2)所示:
(1)
(2)
式中:F30和F0分别为样品或空白(缓冲液代替样品)在30 min时和0 min时的荧光强度;A0和A1分别为空白和样品的斜率;k为斜率。
1.3.2 分子对接
根据ASHOK等[7]描述的方法,采用分子对接研究多肽(FAPSW和MPGPP)与DPP-Ⅳ之间的相互作用。从RCSB数据库下载DPP-Ⅳ晶体结构(PDB ID:1wcy)(https://www.rcsb.org/structure/1wcy),通过Protein Preparation Wizard模块对1wcy进行去水加氢,补全缺失氨基酸残基等处理,并利用OPLS4力场对其进行能量最小化。FAPSW和MPGPP的三维结构由pymol(Education version)生成,并通过LigPrep模块对其进行结构优化和能量最小化处理,力场选择为OPLS4。以1wcy自身配体附近的氨基酸残基作为活性位点,盒子中心坐标为center_x=55.62,center_y=62.20,center_z=36.88,大小设置为size_x=10,size_y=10,size_z=10。采用SP-peptide模式(Glide application,Schrodinger)进行对接。Docking score用于评估配体和受体之间的相互作用强弱。Docking score越低,表示受体与配体结合得越紧密。
1.3.3 分子动力学模拟
基于SONG等[8]报道的方法,使用GROMACS 2022.2对上述多肽-DPP-Ⅳ复合物进行非约束分子动力学模拟以评估其稳定性。采用Amber99sb-ildn力场和TIP3P水模型分别对复合物进行分子力学优化和溶剂化。模拟体系采用周期性立方体盒子。体系中添加适量的Na+以平衡电荷,并采用最陡下降法对体系进行能量最小化。进行正式模拟前,在正则系综和等温等压系综下对体系进行100 ps的预平衡。模拟温度和压力分别设置为310 K和1 bar。正式模拟的时长设置为90 ns。
采用分子力学/泊松-玻尔兹曼表面积(molecular mechanics/Poisson-Boltzmann surface area,MM/PBSA)法计算多肽与1wcy之间的结合自由能(ΔGbind),计算如公式(3)所示:
ΔGbind=ΔEVDW+ΔEelec+ΔGPB+ΔGSA-TΔSS
(3)
式中:ΔEVDW,ΔEelec,ΔGPB,ΔGSA和ΔSS分别为范德华能、静电能、极性溶剂化能、非极性溶剂化能和构象熵;T为温度,K。
1.4 数据分析

2 结果与分析
2.1 FAPSW和MPGPP的DPP-Ⅳ抑制活性
机体正常代谢过程中,食物摄入会引起胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的释放,刺激胰腺β细胞释放胰岛素,从而维持机体内正常血糖水平。DPP-Ⅳ作为一种多功能跨膜糖蛋白和丝氨酸蛋白酶,可迅速降解GLP-1,使机体血糖升高。抑制DPP-Ⅳ活性可提高GLP-1的水平,从而达到降血糖的功效[9]。如表1所示,FAPSW和MPGPP具有较好的DPP-Ⅳ抑制活性,其IC50分别为(2.540±0.126)、(0.158±0.009) g/L,虽弱于阳性对照[西他列汀,IC50=(0.037±0.009) g/L],但强于一些已报道的DPP-Ⅳ抑制肽,如QGQELLPSDFK (IC50=3.89 g/L)[10]、SGVSLAALKKALAAAGYDVEK(IC50=84.19 g/L)和SAPRHGSLGFLPRK(IC50=23.44 g/L)[11]。另外,MPGPP的DPP-Ⅳ抑制活性要强于FAPSW,这可能与MPGPP中N端2号位上的氨基酸残基P有关[12-13]。JIN等[14]研究表明,N端2号位上存在P的多肽,如LPQ(IC50=82.0 μmol/L)、LPVP(IC50=87.0 μmol/L)和LPY(IC50=87.15 μmol/L),其DPP-Ⅳ抑制活性要强于N端2号位上不存在P的多肽,如LDKVFR(IC50=128.71 μmol/L),这与本研究结果一致。

表1 FAPSW、MPGPP和西他列汀的DPP-Ⅳ抑制活性
2.2 分子对接结果分析
为进一步阐明FAPSW和MPGPP的抑制机理,采用分子对接从分子水平上揭示其与DPP-Ⅳ之间的相互作用。MPGPP与DPP-Ⅳ的Docking score为-8.168 kcal/mol,要小于FAPSW(-7.737 kcal/mol),表明MPGPP与DPP-Ⅳ之间的相互作用要强于FAPSW[15]。这与上述多肽的DPP-Ⅳ抑制活性结果是一致的。JIN等[16]研究表明,Docking score越低的多肽,其DPP-Ⅳ抑制活性更强,如YLNF的(Docking score为-3.58 kcal/mol,IC50=146.90 μmol/L)DPP-Ⅳ抑制活性要强于TKLPAVF(Docking score为-2.27 kcal/mol,IC50=242.10 μmol/L),这与本研究结果一致。
DPP-Ⅳ中存在3个主要的活性口袋[16]:由催化三联体Ser 630-Asp 708/Asn 710-His 740和疏水残基(Tyr 547、Tyr 631、Trp 659、Tyr 662、Tyr 666、Val 711和Val 656)组成的疏水位点S1、由Glu 205、Glu 206和Arg 125构成的电荷口袋S2以及由Val 207、Ser 209、Arg 358和Phe 357组成的活性位点S2′。另外,SAGAR等[17]和WU等[18]发现Tyr 547和Trp 629对DPP-Ⅳ活性也有重要影响。如图2所示,FAPSW和MPGPP与DPP-Ⅳ相互作用主要为静电相互作用、氢键、疏水作用和范德华力。YANG等[19]研究表明,静电相互作用和氢键在抑制DPP-Ⅳ活性中起重要作用。如图2-b和图2-d所示,FAPSW与Lys 554形成1个静电相互作用(Pi-阳离子),与S2中的Glu 205和Glu 206共形成2个静电相互作用(盐桥);而MPGPP与S2中的Glu 205和Glu 206分别形成1个静电相互作用(盐桥)。此外,FAPSW和MPGPP与DPP-Ⅳ分别形成3个氢键和7个氢键。其中,FAPSW与Glu 205形成一个碳氢键,与Glu 206和Tyr 547共形成2个传统氢键;MPGPP与S1中的Tyr 547、Tyr 631、Tyr 662、Asn 710和S2中的Arg 125共形成6个传统氢键,与S1中的His 740形成1个碳氢键。HE等[20]研究发现,传统氢键个数与多肽的DPP-Ⅳ抑制活性呈正相关,这可以解释为什么MPGPP的DPP-Ⅳ抑制活性强于FAPSW。WANG等[15]发现疏水相互作用也能影响DPP-Ⅳ活性。如图2-b和图2-d所示,FAPSW与Lys 554和S2′中的Phe 357分别形成1个疏水作用力,MPGPP与Lys 554和S1中的Tyr 662、Tyr 666和Tyr 547共形成5个疏水作用。

a-FAPSW与1wcy的对接模型;b-FAPSW与1wcy的二维相互作用示意图;c-MPGPP与1wcy的对接模型;d-MPGPP与1wcy的二维相互作用示意图
YANG等[19]研究表明DPP-Ⅳ与抑制剂之间的范德华力可影响DPP-Ⅳ的空间构型,从而影响其活性。如图2-b所示,FAPSW与DPP-Ⅳ中的Arg 560、Arg 358、Ser 209、Trp 201、Asp 663、Tyr 662、Tyr 631、Trp 659、Val 656、Ser 630、Val 711、His 740、Asn 710、Tyr 666、Arg 125、Arg 669、Cys 551、Tyr 585、Ser 552和Gln 553存在范德华力作用;而MPGPP与DPP-Ⅳ中的Gln 553、Ser 552、Trp 629、Ser 630、Val 711、Val 656、Trp 659、Asp 663和Trp 201存在范德华力作用(图2-d)。因此,FAPSW和MPGPP可通过范德华力改变DPP-Ⅳ的空间构型,从而发挥其抑制作用。
2.3 分子动力学模拟结果分析
为进一步评估FAPSW和MPGPP与DPP-Ⅳ结合后形成复合物的稳定性,通过分子动力学模拟分析其复合物的均方根偏差(root mean square deviation,RMSD)、均方根波动(root mean square fluctuation,RMSF)、回旋半径(radius of gyration,Rg)、溶剂可及表面积(solvent accessible surface area,SASA)和结合自由能。
2.3.1 FAPSW-1wcy和MPGPP-1wcy复合物的RMSD分析
游离1wcy、FAPSW-1wcy和MPGPP-1wcy复合物的RMSD值如图3所示。通常复合物的RMSD值越小,体系越稳定,配体与受体结合的越紧密[21]。如图3-a所示,1wcy、FAPSW-1wcy和MPGPP-1wcy复合物的RMSD值在40 ns后趋于稳定,表明后续40~90 ns轨迹可用于下一步分析。FAPSW-1wcy与MPGPP-1wcy复合物的RMSD值(40~90 ns)分别为(0.243±0.021) nm和(0.221±0.001) nm,小于游离1wcy的RMSD值[(0.253±0.012) nm](图3-b),表明FAPSW和MPGPP与1wcy结合后,其复合物结构更稳定。SONG等[22]研究表明,YYLVR、YLLVR和YYLLVR结合血管紧张素转化酶(angiotensin-converting enzyme,ACE)后,其复合物结构的RMSD值要小于游离ACE的RMSD值,表明其复合物结构更稳定。这与本研究结果一致。另外,MPGPP-1wcy复合物的RMSD值低于FAPSW-1wcy,表明MPGPP-1wcy的稳定性要强于FAPSW-1wcy复合物。这可能是由于MPGPP与1wcy结合地更紧密。LIU等[23]报道了相似的结果,其研究发现,相比于2,6-二羟基苯乙酮-黄嘌呤氧化酶和4-羟基苯乙醇-黄嘌呤氧化酶复合物,结合更紧密的4-羟基苯甲醛-黄嘌呤氧化酶复合物具有更小的RMSD值。
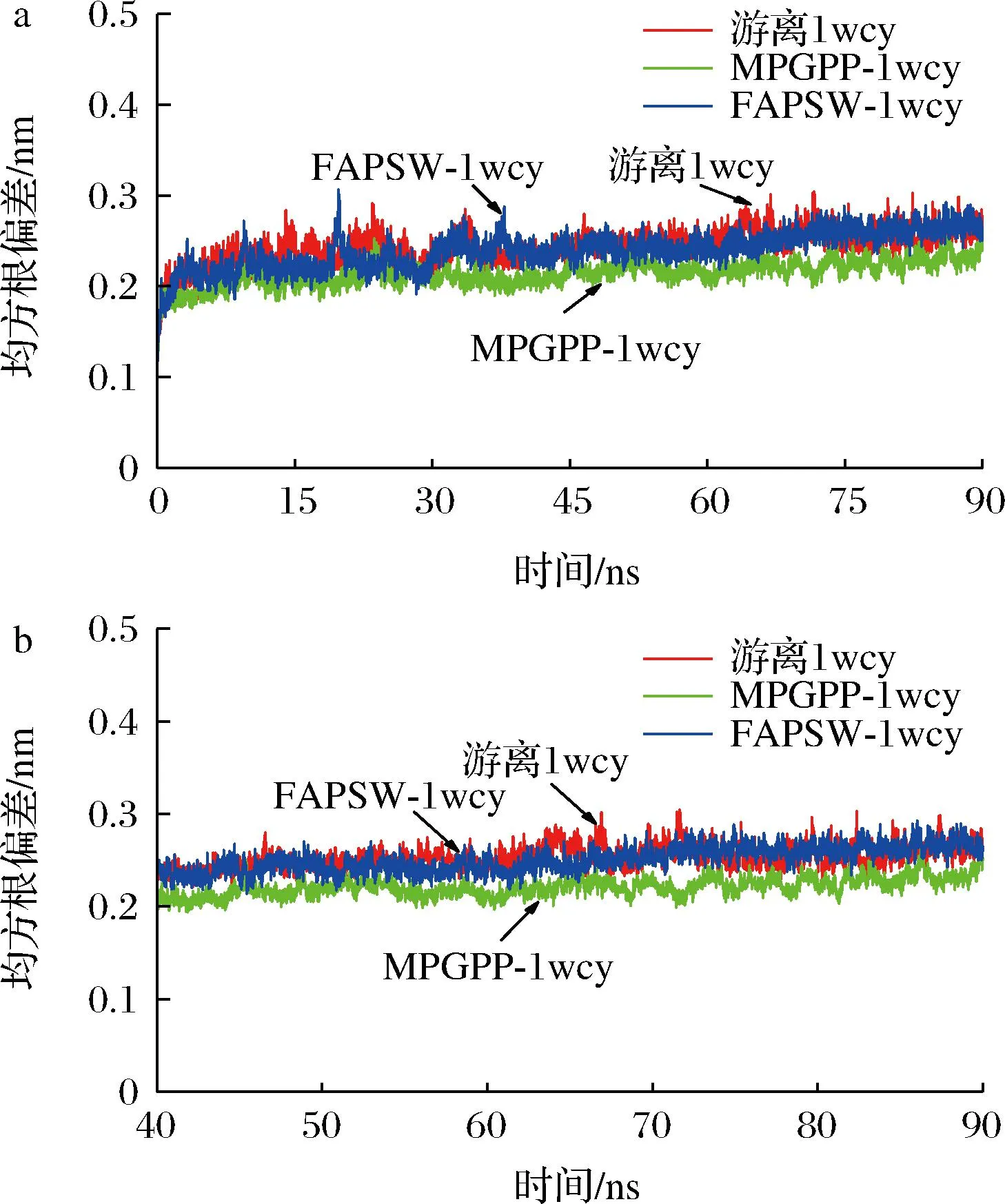
a-0~90 ns;b-40~90 ns
2.3.2 FAPSW-1wcy和MPGPP-1wcy复合物的RMSF分析
复合物中蛋白的RMSF能够反映配体对受体空间结构的影响。RMSF值越大,说明配体对蛋白的扰动越大,复合物结构越不稳定。如图4所示,复合物FAPSW-1wcy和MPGPP-1wcy的RMSF值分别为(0.121±0.006)和(0.116±0.006) nm,略低于游离1wcy的RMSF值[(0.130±0.008) nm],表明FAPSW-1wcy和MPGPP-1wcy复合物空间结构的稳定性要优于游离1wcy。AMIRI等[24]研究发现四环素结合α-淀粉酶和α-葡萄糖苷酶后,四环素-α-淀粉酶和四环素-α-葡萄糖苷酶复合物的RMSF值要小于游离α-葡萄糖苷酶和α-淀粉酶,表明其复合物的稳定性要优于游离α-葡萄糖苷酶和α-淀粉酶,这与本研究结果是一致的。此外,MPGPP-1wcy复合物的RMSF值要低于FAPSW-1wcy,表明MPGPP-1wcy复合物的稳定性要强于FAPSW-1wcy。
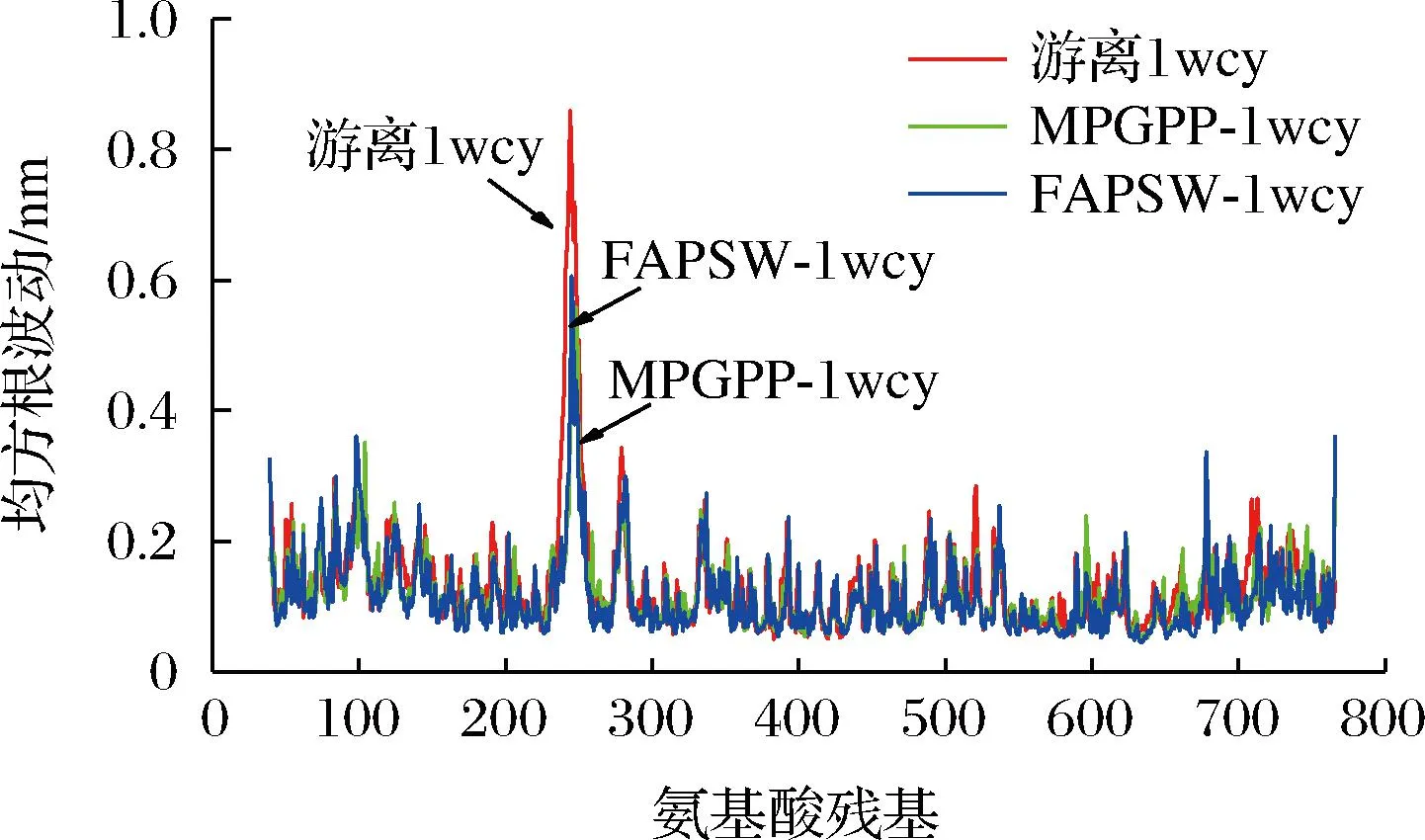
图4 游离1wcy、FAPSW-1wcy和MPGPP-1wcy复合物的RMSF值
2.3.3 FAPSW-1wcy和MPGPP-1wcy复合物的Rg分析
Rg常被用来描述蛋白质结构的紧密程度。在复合物体系中,其值越小,表明配体与蛋白结合得越紧密,复合物结构越稳定[25]。如图5所示,复合物FAPSW-1wcy和MPGPP-1wcy的Rg值分别为(2.708±0.008)、(2.693±0.001) nm,小于游离1wcy的Rg值[(2.723±0.009) nm],表明FAPSW-1wcy和MPGPP-1wcy复合物结构稳定强于游离1wcy。这可能是由于FAPSW和MPGPP结合1wcy后,其复合物结构更紧密。XU等[26]研究发现,5-咖啡酰奎尼酸和4-咖啡酰奎尼酸结合脂肪酶后,其复合物的Rg值低于游离脂肪酶的Rg值。这与本研究结果是一致的。另外,MPGPP-1wcy复合物的Rg值小于FAPSW-1wcy,表明复合物MPGPP-1wcy的稳定性要强于FAPSW-1wcy,这可以解释为什么MPGPP的DPP-Ⅳ抑制活性强于FAPSW。
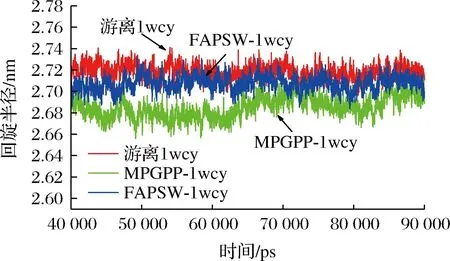
图5 游离1wcy、FAPSW-1wcy和MPGPP-1wcy复合物的Rg值
2.3.4 FAPSW与MPGPP结合1wcy的结合自由能分析
为进一步从能量的角度分析FAPSW-1wcy和MPGPP-1wcy复合物的稳定性,采用MM/PBSA计算FAPSW和MPGPP与1wcy之间的结合自由能。结合自由能越低,复合物结构越稳定。如表2所示,MPGPP的结合自由能(ΔGbind=-76.795 kJ/mol)小于FAPSW的结合自由能(ΔGbind=-54.015 kJ/mol),表明MPGPP-1wcy复合物结构的稳定性强于FAPSW-1wcy,这与上述多肽体外DPP-Ⅳ抑制活性的实验结果是一致的。FAPSW-1wcy复合物中ΔEelec、ΔEVDW、ΔGPB、ΔGSA和TΔSS分别为-419.180、-216.139、598.872、-35.120、-17.552 kJ/mol,表明静电相互作用在FAPSW与1wcy的结合中起主导作用;另外,在MPGPP-1wcy复合物中,ΔEelec、ΔEVDW、ΔGPB、ΔGSA和TΔSS分别为-241.819、-145.758、305.541、-23.902、-29.142 kJ/mol,同样表明静电相互作用在MPGPP与1wcy的结合中起主导作用。

表2 FAPSW-1wcy和MPGPP-1wcy复合物的结合自由能组成 单位:kJ/mol
2.3.5 结合自由能分解分析
为深入了解1wcy中各个氨基酸残基与多肽(FAPSW和MPGPP)之间的相互作用机制,通过自由能分解分析其对结合自由能的贡献,结果如图6所示。在FAPSW结合1wcy中(图6-a),1wcy对结合自由能贡献较大的氨基酸残基(结合自由能贡献<-4 kJ/mol)分别为Arg 560(-11.054 kJ/mol)、Arg 429(-8.273 kJ/mol)、Phe 357(-8.117 kJ/mol)、Tyr 666(-7.999 kJ/mol)和Arg 471(-5.873 kJ/mol)。而对于MPGPP结合1wcy(如图6-b所示),1wcy对结合自由能贡献较大的氨基酸残基为(结合自由能<-4 kJ/mol)为Phe 357(-11.930 kJ/mol)、Tyr 547(-7.531 kJ/mol)、Arg 560(-6.517 kJ/mol)、Lys 554(-5.997 kJ/mol)、Arg 429 (-5.343 kJ/mol)、Trp 629(-4.954 kJ/mol)和Arg 471(-4.270 kJ/mol)。
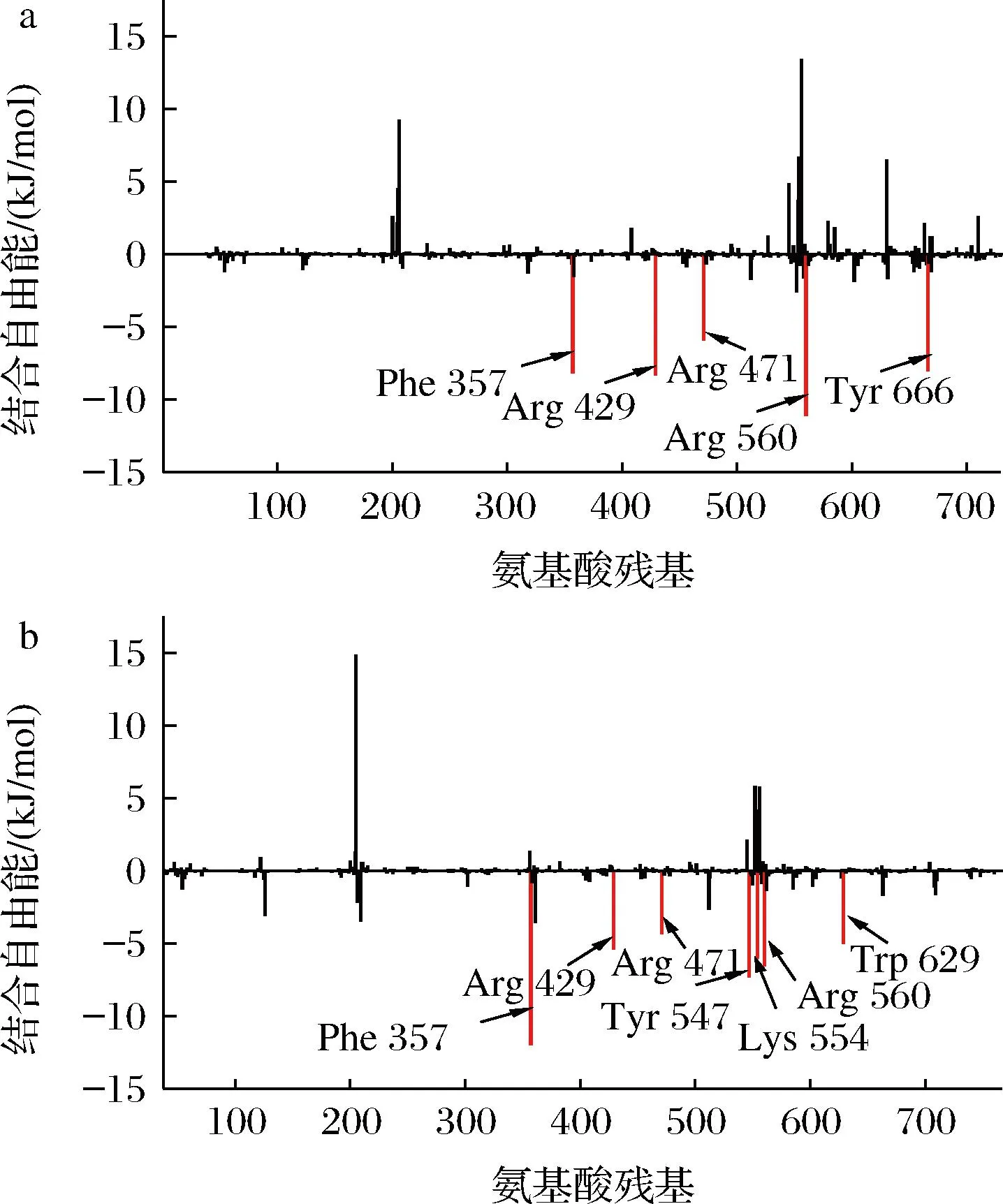
a-FAPSW-1wcy;b-MPGPP-1wcy
3 结论与讨论
本研究结果表明,FAPSW和MPGPP均表现出良好的DPP-Ⅳ抑制活性,且MPGPP的DPP-Ⅳ抑制活性IC50=(0.158±0.009) g/L强于FAPSW IC50=(2.540±0.126) g/L。分子对接结果表明,FAPSW和MPGPP通过静电相互作用、氢键、疏水作用和范德华力与DPP-Ⅳ活性位点相结合,且传统氢键在抑制DPP-Ⅳ活性中起重要作用。分子动力学结果表明,MPGPP-1wcy复合物的稳定性要强于FAPSW-1wcy复合物,其结合自由能分别为-76.795、-54.015 kJ/mol。静电相互作用在FAPSW和MPGPP与1wcy的结合中起主导作用。本研究结果不仅丰富了降糖肽库,同时为银杏白果源多肽(FAPSW和MPGPP)在功能食品领域的开发和利用提供科学参考。

