鸭疫里默氏菌的分离和鉴定
张 程
沭阳县农业农村局,江苏 沐阳 223600
0 引言
鸭疫里默氏菌(Riemerella anatipestifer)属于黄杆菌科、里氏杆菌属,为革兰氏阴性短小杆菌,无芽孢,不能运动,有荚膜,瑞氏染色呈两极浓染[1]。对培养鸭疫里默氏杆菌的营养条件有较高的要求,在普通培养基和麦康凯培养基上无法生长,在鲜血琼脂平板上不溶血。该菌不发酵糖类,不产生吲哚和硫化氢,不还原硝酸盐[2]。
鸭疫里默氏菌易引发雏鸭的鸭疫里默氏菌病,又称鸭传染性浆膜炎,呈现急性、慢性或败血症感染[3-4]。病鸭临床表现为排出绿色稀粪、眼睛和鼻子分泌物增多[5],常伴有角弓反张等神经症状。其大体病理变化主要为气囊浑浊,心包膜出现纤维素性炎症,少数情况会出现输卵管炎并在输卵管内有干酪样沉淀物,该病的病理变化与鸭沙门氏菌和致病性大肠杆菌感染的病理变化相似,故若要确诊须进行鉴别诊断,并进行微生物的分离鉴定[6]。
鸭疫里默氏菌在鸭场中较为常见,广泛存在于土壤、水源、鸭舍等,在鸭子体表、黏膜、鼻咽等部位均有寄生,容易引发动物感染、食品污染导致动物发病、食物中毒等。该细菌是存在于动物皮肤表面的一种常在菌,通常情况下不侵入机体体内,多见于水平传播,可通过破损的皮肤或黏膜、消化道、呼吸道、汗腺、毛囊等侵入机体,感染途径较多。同时,该病易受外界应激因素影响,例如恶劣环境、惊吓、外伤感染、昼夜温差等均可成为该病流行暴发的诱因[7]。
鸭疫里默氏菌病在全世界的流行范围十分广泛,因鸭疫里默氏菌感染导致养殖场出现大面积畜禽发病死亡的事件也越来越多,因此对该病做到早发现、早治疗,并采取一定的措施进行预防,显得尤为重要[8]。为明确病因,本文通过采集病料进行实验室诊断,经细菌分离鉴定及PCR检测及基因测序方法,明确从规模化鸭场分离得到的细菌为鸭疫里默氏菌。
1 材料和方法
1.1 材料
1)从某养殖场患有鸭疫里默氏菌病的病鸭中进行病料采集,在无菌操作环境下,从肝脏和心包液中分离出细菌。
2)试验仪器如表1所示。

表1 主要仪器及生产厂家
3)主要试剂见表2。

表2 主要试剂
4)其他试验材料和仪器:蒸汽高压锅、电泳槽、电泳仪、移液器、微量加样器、PCR仪、显微镜、琼脂粉、琼脂糖、电子天平、去离子纯水机、台式pH测试仪、低温冰柜、水浴震荡培养箱。
5)引物。按照GenBank提交的RA细菌16S rRNA基因序列,在运用引物设计软件设计一对扩增该基因的引物,PAGE纯化,进行普通PCR反应,并作电泳检测,引物序列如下。
上游引物:5’- AGAGTTTGATCCTGGCTCAG-3’
下游引物:5’-ACGGCTACCTTGTTACGACTT-3’
目的片段大小约为1 500 bp,由通用生物公司合成引物。
6)生化培养管 :甘露醇、乳糖、葡萄糖、麦芽糖、蔗糖、果糖、尿素、VP、甲基红试验、靛基质、硫化氢、硝酸盐还原、柠檬酸盐微量发酵管等,过氧化氢酶、用于RA的生化试验。
1.2 方法
1.2.1 鲜血琼脂培养基的制备
将高压灭菌的胰酶大豆琼脂冷却至50 ℃左右,在无菌操作条件下,将10%的无菌兔血加入胰酶大豆琼脂中,迅速摇匀,再迅速倒入无菌培养皿中。待鲜血琼脂培养基冷却,置于37 ℃培养箱待24 h后进行无菌检测。
1.2.2 革兰氏染色
无菌条件下剪取肝脏,作为病料,用接种环在培养基平板上进行划线,置于37 ℃温箱中培养24 h,观察菌落形态,挑取可疑单菌落进行连续纯化培养后进行革兰氏染色,镜检。革兰氏染色过程如下。
①涂片:将载玻片用酒精球擦拭后,在载玻片上做好标记,取少许PBS溶液均匀涂于玻片上,将接种环在酒精灯上灭菌后,挑取单菌落涂于玻片上的PBS溶液里,均匀涂开。②固定:待载玻片表面干燥后,使其快速通过酒精灯火焰1~2次,注意不可使载玻片温度过高。③初染:滴加结晶紫染液使其均匀覆盖载玻片表面,1 min后水洗,甩干。④媒染:滴加碘液以覆盖载玻片表面,1 min后洗涤并甩干。⑤脱色:滴加少许酒精溶液,覆盖涂面,时间不可过长,20~30 s后水洗,甩干。⑥复染:滴加1~2滴复红染料,1 min后洗涤并甩干。⑦用吸水纸吸去残余液体,等待玻片干燥,滴加香柏油,镜检。
1.2.3 鸭疫里默氏菌的生化实试验
按照说明书上的标准方法进行操作,在无菌操作下,挑取RA单菌落接种于各生化试验管中,接种完毕后,放进37 ℃恒温箱培养,期间注意观察其颜色变化,以及有无气泡等。
1.2.4 鸭疫里默氏菌16S rRNA PCR扩增
对已纯化的细菌进行细菌16S rRNA PCR扩增,获得的目的条带送至通用生物公司测序。16S rRNA PCR主要步骤如下。
1)细菌DNA的提取。挑取单菌落接种于LB肉汤中,于37 ℃摇床中培养24 h;取1 mL菌液于EP管中,10 000 r/min离心10 min;弃上清,加100 μL ddH2O,吹打至均匀;100 ℃沸水浴10 min后,立即转入-20 ℃冰浴10 min;以10 000 r/min离心10 min后,上清液为DNA模板,取上清液置于EP管中。
2)细菌的16S rRNA PCR扩增。用提取的细菌DNA为模板进行PCR扩增,PCR体系如表3所示,PCR反应程序如表4所示。

表3 鸭疫里默氏菌的16S rRNA PCR体系 单位:μL

表4 鸭疫里默氏菌PCR反应程序
3)PCR产物的琼脂糖凝胶电泳。配制1%的琼脂糖凝胶,在100 V条件下进行琼脂糖凝胶电泳30 min,分析PCR产物,于凝胶图象分析成像仪中观察电泳条带。
2 结果与讨论
2.1 结果
2.1.1 鸭疫里默氏菌的分离培养
血平板上鸭疫里默氏菌生长良好,菌落不溶血,呈乳白色、圆形、微突起,针尖大小、表面光滑的小菌落,鲜血琼脂培养基上鸭疫里默氏菌的菌落形态如图1所示。
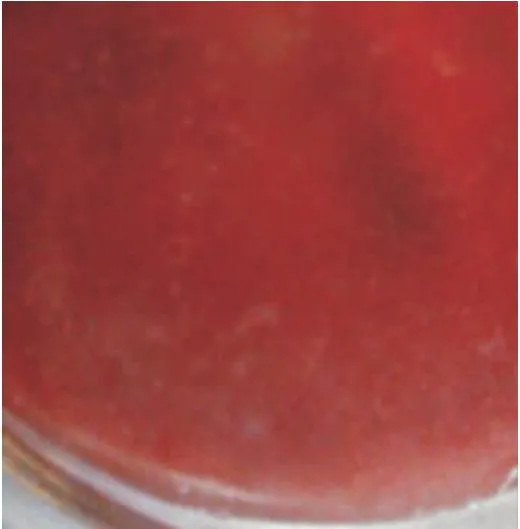
图1 鲜血琼脂培养基上鸭疫里默氏菌的菌落形态
2.1.2 鸭疫里默氏菌革兰氏染色镜检
对分离得到的鸭疫里默氏菌进行革兰氏染色镜检,镜检发现视野中出现紫红色呈椭圆形的短小杆菌,RA为革兰氏阴性菌,鸭疫里默氏菌革兰氏染色菌体形态如图2所示。
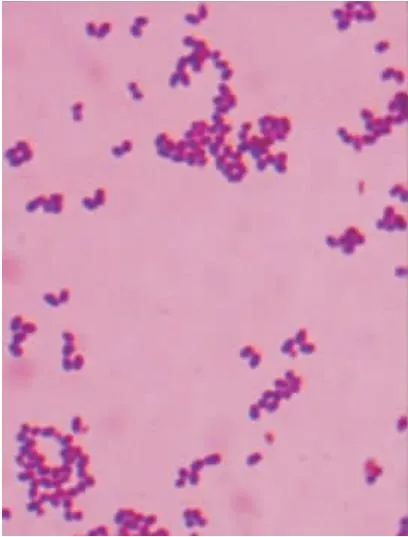
图2 鸭疫里默氏菌革兰氏染色菌体形态
2.1.3 鸭疫里默氏菌生化试验结果
试验结果表明:鸭疫里默氏菌(RA)不发酵葡萄糖、乳糖、麦芽糖、蔗糖、甘露糖、果糖,不产生硫化氢,过氧化氢酶,尿素试验呈阳性,MR试验、VP试验、靛基质试验、硝酸盐还原试验、柠檬酸盐利用试验均为阴性。该结果符合鸭疫里默氏菌(RA)的生化反应特征,鸭疫里默氏菌菌生化试验结果如图3所示。
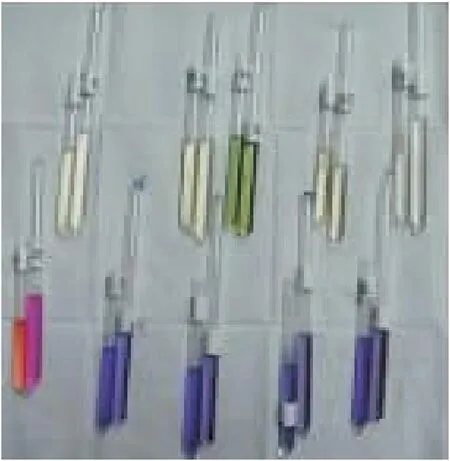
图3 鸭疫里默氏菌生化试验结果
2.1.4 鸭疫里默氏菌16S rRNA PCR检测
配制1%琼脂糖凝胶,将获得的PCR产物进行电泳检测。结果显示获得约1 500 bp的目的条带,该条带与预期的条带大小相匹配(见图4,泳道2所示)。
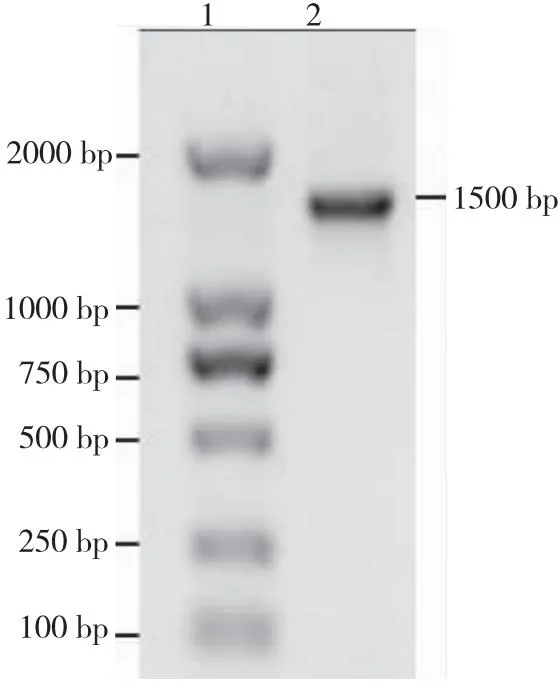
注:泳道1为DNA标准分子量DL2000 Marker;泳道2为RA的PCR检测结果。
将扩增的PCR产物送至生物公司进行测序,将测序得到的基因序列与NCBI上其他菌株进行同源性Blast比对,得出测序比较结果如表5所示。

表5 分离菌株16S rRNA同源性比较
结果表明,分离的菌株16S rRNA与NCBI公布的鸭疫里默氏菌序列同源性达到99%以上,进一步证明了该分离菌株为鸭疫里默氏菌。
2.2 讨论
对鸭疫里默氏菌(RA)进行分离鉴定研究,通过细菌分离培养、染色镜检形态观察、生化试验以及聚合酶链式反应(PCR)特异性扩增、产物测序鉴定方法等方面对分离得到的鸭疫里默氏菌(RA)进行鉴定。本研究分离得到的鸭疫里默氏菌(RA)在血平板上生长良好,菌落不溶血,呈乳白色,圆形、微突起,针尖大小,表面光滑的小菌落。鸭疫里默氏菌(RA)菌体无芽孢,无鞭毛,自身不运动。本研究结果为及时治疗病鸭,防止疾病传播,减少养鸭场的经济损失具有重要意义。
药物治疗是治疗鸭疫里默氏菌病的主要措施之一,治疗原则为早发现、早确诊、早治疗[9-12]。治疗用药物一般为抗菌药物,但由于鸭疫里默氏菌耐药性较强,在使用抗菌药治疗前,最好先分离纯化出病原菌,进行药敏试验,然后挑选最敏感的药物进行临床治疗。
在进行病理剖检时,发现患有鸭疫里默氏菌病的雏鸭临床上表现出腹泻、喘气、咳嗽等症状。眼睛和鼻子的分泌物增多,眼睛周围会形成“眼圈”,常常会出现头颈震颤和共济失调,部分病鸭出现神经症状,最终死亡[13-15]。
在鸭养殖过程中,为有效控制鸭疫里默氏菌感染[16],可采取以下措施:加强饲养管理,提供全价的饲料喂养,同时安排合理的饲养密度,加强通风换气,做好温度和湿度的调控;做好预防接种,制定科学的免疫程序,提高动物特异性免疫水平;切断传播途径,定期消毒,杀虫,灭鼠,保证畜舍卫生环境,做好消毒;发现病鸭应及时隔离;避免外界病原菌的带入。
3 结束语
在预防鸭疫里默氏菌感染的过程中,准确诊断,科学用药。随着细菌耐药性持续上升,可供临床上选择药物范围越来越窄,因此在用药前需要根据实际情况,分离鉴定病原菌进行药敏实验,从而选择合适药物。

