木糖葡萄球菌实时荧光定量PCR 检测方法的建立及其应用
于灵芝,冯丽萍,孔志豪,朱琦,魏晓锋
(上海实验动物研究中心,上海 201203)
木糖葡萄球菌(Staphylococcus xylosus,S.xylosus)是一种凝固酶阴性革兰氏阳性葡萄球菌,由其引起实验动物尤其是免疫缺陷小鼠感染的报道逐年增多。 木糖葡萄球菌在SPF 级C57BL/6 小鼠皮肤上被发现是一种共生细菌[1],会导致沙鼠的鼻腔皮炎[2],能促进肝纤维化小鼠模型的肝纤维化和细菌移位[3]。 无胸腺裸鼠自发性感染木糖葡萄球菌表现为弥漫性鳞屑性皮炎[4],经木糖葡萄球菌诱导的烫伤性皮炎表现为显著的真皮炎症[5-6]。NADPH 氧化酶缺陷的小鼠通常被用作慢性肉芽肿疾病的模型,对木糖葡萄球菌的易感性增加,表现为皮炎和脓肿[7-10]。 NOS2 在宿主防御多种微生物中起着重要作用,因此,NOS2 基因敲除小鼠通常对木糖葡萄球菌感染没有反应,表现出伴有表皮溃疡的肉芽肿性皮炎,在这些小鼠皮肤中分离并鉴定到了木糖葡萄球菌,因此,作者认为,木糖葡萄球菌是NOS2 基因敲除小鼠的潜在机会性病原体[11-14]。
木糖葡萄球菌感染免疫缺陷或基因工程小鼠出现皮屑、脱毛、脓肿和皮炎等,严重影响实验动物质量及实验结果。 免疫缺陷或基因工程动物作为疾病研究的重要工具,研发和使用数量逐年增强,对其进行木糖葡萄球菌的监测尤为重要。 木糖葡萄球菌尚未被列入我国实验动物国家标准检测体系中,而其他国家的一些实验动物生产和使用单位已将其列为检测项目[15]。
目前团体标准对木糖葡萄球菌的检测采用细菌培养及生化鉴定的方法[15],耗时长,操作复杂。因此,有必要开发一种灵敏特异快速的检测方法。qPCR 方法兼具快速、特异性强和灵敏度高的优势,在医学检测领域已被广泛推广和应用,但用该方法检测木糖葡萄球菌的方法未见报道。 本研究采用gehM基因片段作为靶标,建立了检测木糖葡萄球菌的qPCR 方法,并将其应用于临床样本的检测,旨在监测免疫缺陷小鼠木糖葡萄球菌的携带状态,并对其进行控制,对保障研究结果的准确性和科学性至关重要。
1 材料与方法
1.1 材料
1.1.1 菌株
标准菌株包括木糖葡萄球菌(ATCC29971)、表皮葡萄球菌(CMCC26069)、 嗜肺巴斯德杆菌(ATCC35149)、支气管鲍特杆菌(ATCC14065)、沙门氏菌(CMCC50115)、绿脓杆菌(ATCC27853)、金黄色葡萄球菌(ATCC6538)、腐生葡萄球菌(ATCC BAA-750)和肺炎克雷伯杆菌(CMCC46117),由本实验室购买保存。 头状葡萄球菌(23041070-1)、松鼠葡萄球菌(23041070-b)、 松鼠葡萄球菌(23041905-b)、松鼠葡萄球菌(23041070-5a)和科氏葡萄球菌(22101015-2-3)由本实验室分离并保存。
1.1.2 主要试剂与仪器
TB Green ® Premix Ex TaqTMⅡ( 批号:AM43086A)(日本TaKaRa 公司);引物由生工生物工程(上海)股份有限公司合成;磁珠法核酸提取试剂(批号:20221020)(麦诺迪生物科技有限公司);Nanodrop(型号:ND-1000)(美国Nanodrop 公司)。荧光定量PCR 仪(型号:CFX Opus 96)(美国Bio-Rad 公司);全自动核酸纯化仪(型号:Purifier 32)(麦诺迪(上海)生物科技有限公司)。
1.2 方法
1.2.1 引物合成
本文选用GenBank(登录号:AF208229.1)中登录的特异性gehM基因片段的引物组序列[16-17],并通过NCBI 比对确认引物的特异性。 上下游引物序列分别为gehM-F:5’-GTAGAAAAAGCGAATGAA CAAC-3’,gehM-R: 5’-CCTGGTTGCCAATCTTTA TATAC-3’。
1.2.2 DNA 提取
按照核酸提取仪操作说明书及配套提取试剂进行DNA 提取。 对DNA 浓度进行定量,并按梯度稀释至所需的浓度。
1.2.3 qPCR 检测体系建立
将提取的DNA 作为反应模板进行qPCR 扩增。阴阳性对照的设计方案同本实验室已发表的参考文献[18]。
反应体系:TB Green Premix(2 × )12.5 μL(终浓度1 × )、gehM-F(10 μmol/L)1 μL(终浓度0.2 μmol/L)、gehM-R(10 μmol/L)1 μL(终浓度0.2 μmol/L)、模板1 μL、加灭菌水9.5 μL 至25 μL。反应程序为:95 ℃,1 min;(95 ℃,10 s;50 ℃,30 s;72 ℃, 30 s),40 个循环;72 ℃,1 min;熔解曲线。荧光信号收集在50 ℃,30 s 时进行。
1.2.4 特异性实验
将木糖葡萄球菌和13 种非目的菌加入经培养法确认为阴性的样本中,阴性样本包括大、小鼠粪便、皮肤拭子和EAD 拭子样本,与常规样本一样提取DNA,并进行扩增。 以木糖葡萄球菌标准株的DNA 为阳性对照,来判断本方法是否与其他细菌存在交叉反应,从而对特异性进行验证。
1.2.5 建立标准曲线及灵敏度实验
木糖葡萄球菌标准菌液的DNA 浓度按10 倍梯度进行稀释,从107fg/μL 至1 fg/μL,取模板1 μL进行qPCR 扩增反应。 标准曲线绘制方法和灵敏度分析方法同参考文献[18]。
1.2.6 重复性实验
在2 个浓度水平进行重复性实验,高浓度为106fg/μL, 低浓度为103fg/μL。 对组内和组间进行重复性评估,每个组进行重复检测6 次,统计所测得的Ct 值,并计算变异系数。
1.2.7 临床样本的应用
委托检验的大、小鼠不同类型样本共60 份,包括排风管道粉尘拭子(exhaust air dust, EAD)20 份,皮肤拭子2 份,小鼠粪便20 份,大鼠粪便18 例。 粪便样本取40 ~50 mg,EAD 拭子和皮肤拭子折断,然后按“1.2.2”和“1.2.3”操作。
1.2.8 qPCR 产物测序鉴定
测序鉴定方案同参考文献[18]。
1.2.9 金标准对比实验
按团体标准T/CALAS 92—2020《实验动物木糖葡萄球菌检测方法》对临床样本分离培养及鉴定[15]。
2 结果
2.1 特异性结果
特异性实验结果表明,仅木糖葡萄球菌标准菌株出现典型S 扩增曲线,其他13 种细菌和水均为平直线(图1)。 即本方法仅能扩增出木糖葡萄球菌,而不能扩增出其他13 种菌。

图1 木糖葡萄球菌qPCR 特异性检测结果Note. Red S curve, S.xylosus standard strain. Straight purple lines, Other 13 non-S.xylosus species.Figure 1 Specificity for S.xylosus detected by qPCR
2.2 标准曲线的建立及灵敏度结果
10 倍梯度稀释后的木糖葡萄球菌标准菌株DNA 样品进行qPCR。 由图2 可见,可检测到100 fg/μL,在107~100 fg/μL 各浓度梯度之间线性关系良好,线性回归方程为Ct =-3.4159 × lg(DNA量) +39.281,k 为回归方程的斜率,扩增效率计算公式为E = 10(-1/k)-1 = 0.9498,即扩增效率为95%,相关系数R2=0.9892,表明所建方法的扩增效率较高。 本方法的灵敏度为 100 fg/μL 的DNA量(图2)。
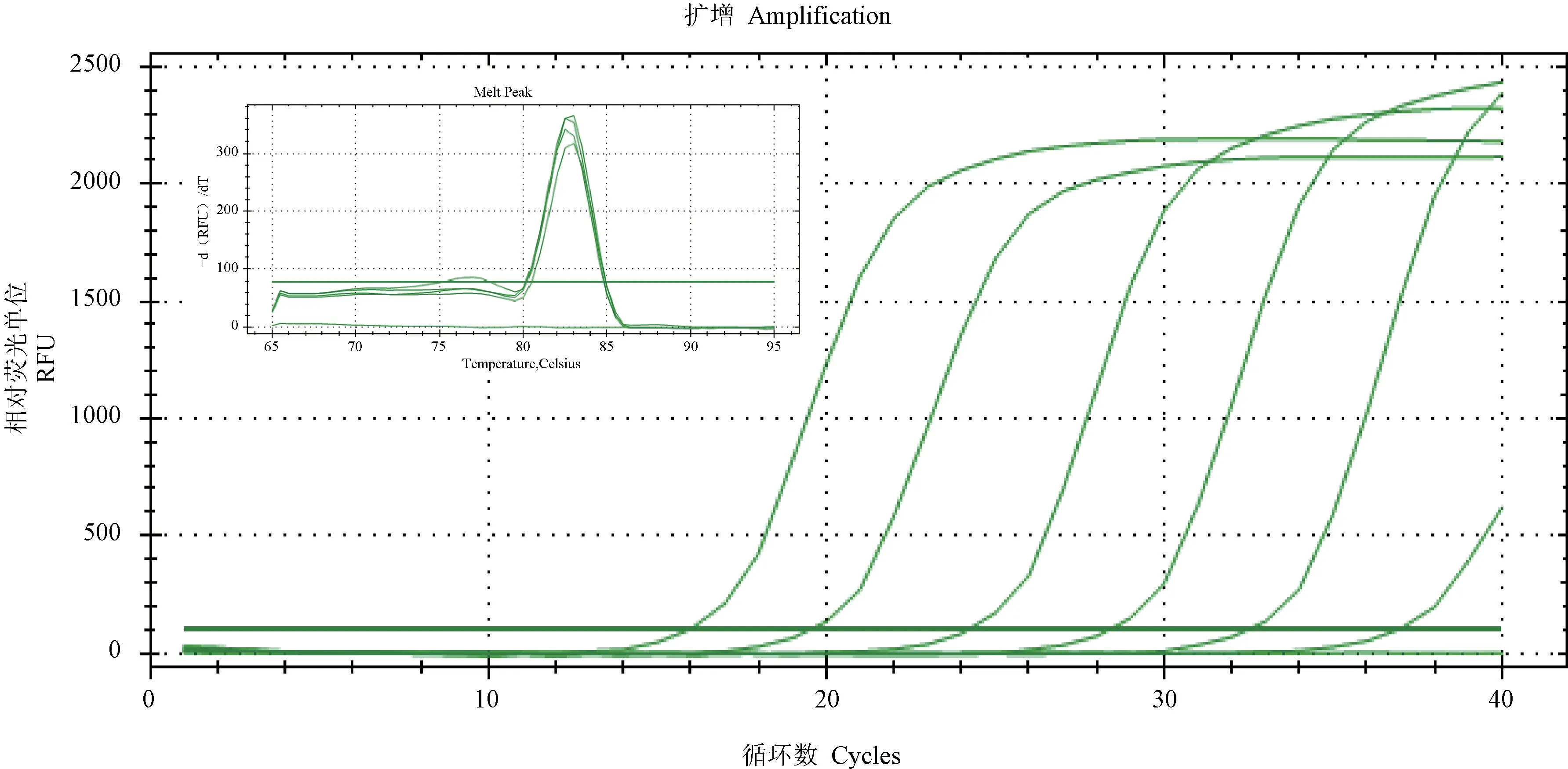
图2 木糖葡萄球菌qPCR 灵敏度检测结果Note. Amounts of DNA represented by the curves from left to right, 107 fg/μL, 106 fg/μL, 105 fg/μL, 104 fg/μL, 103 fg/μL and 100 fg/μL.Figure 2 Sensitivity for S.xylosus detected by qPCR
2.3 重复性结果
组内和组间Ct 值的变异系数均小于3%(表1),证明本方法重复性良好,且稳定可靠。
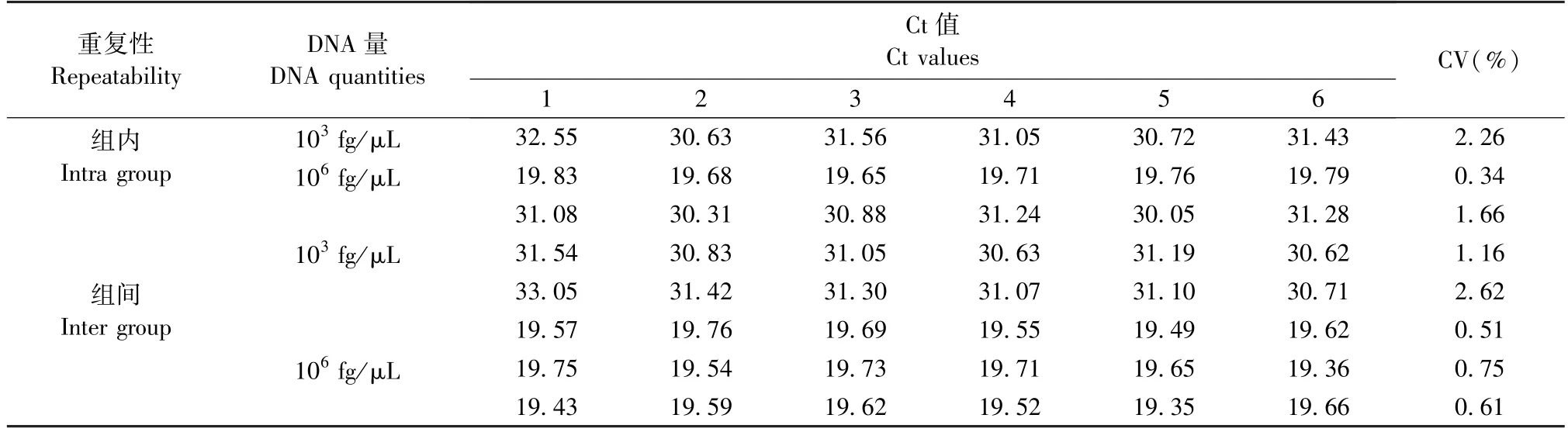
表1 组内和组间重复性结果(Ct 值和CV(%))(n =6)Table 1 Repeatability results (Ct and CV(%)) for intragroups and intergroups(n =6)
2.4 临床样品检测结果
阴阳性对照均符合结果判定要求,因此,60 份临床样本检测结果均有效。 其中,有5 份样品扩增曲线呈典型的S 型,可判定木糖葡萄球菌核酸阳性(图3)。 根据标准曲线,计算出其浓度分别为1798.99、1010.70、428.48、695.89 和590.14 fg/μL。
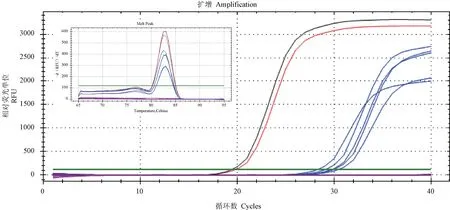
图3 木糖葡萄球菌qPCR 的临床检测结果Note. Black S curve. Positive control for nucleic acid extraction. Red S curve. Positive control for amplification. Straight purple lines. Negative controls and negative samples. Blue S curves. Positive samples.Figure 3 Clinical detection results for S.xylosus by qPCR detection
2.5 qPCR 产物测序分析
所测阳性样本的序列经BLAST 进行序列同源性比对,结果显示,该序列与木糖葡萄球菌的序列同源性为99.63%,表明该样本木糖葡萄球菌核酸阳性(图4)。
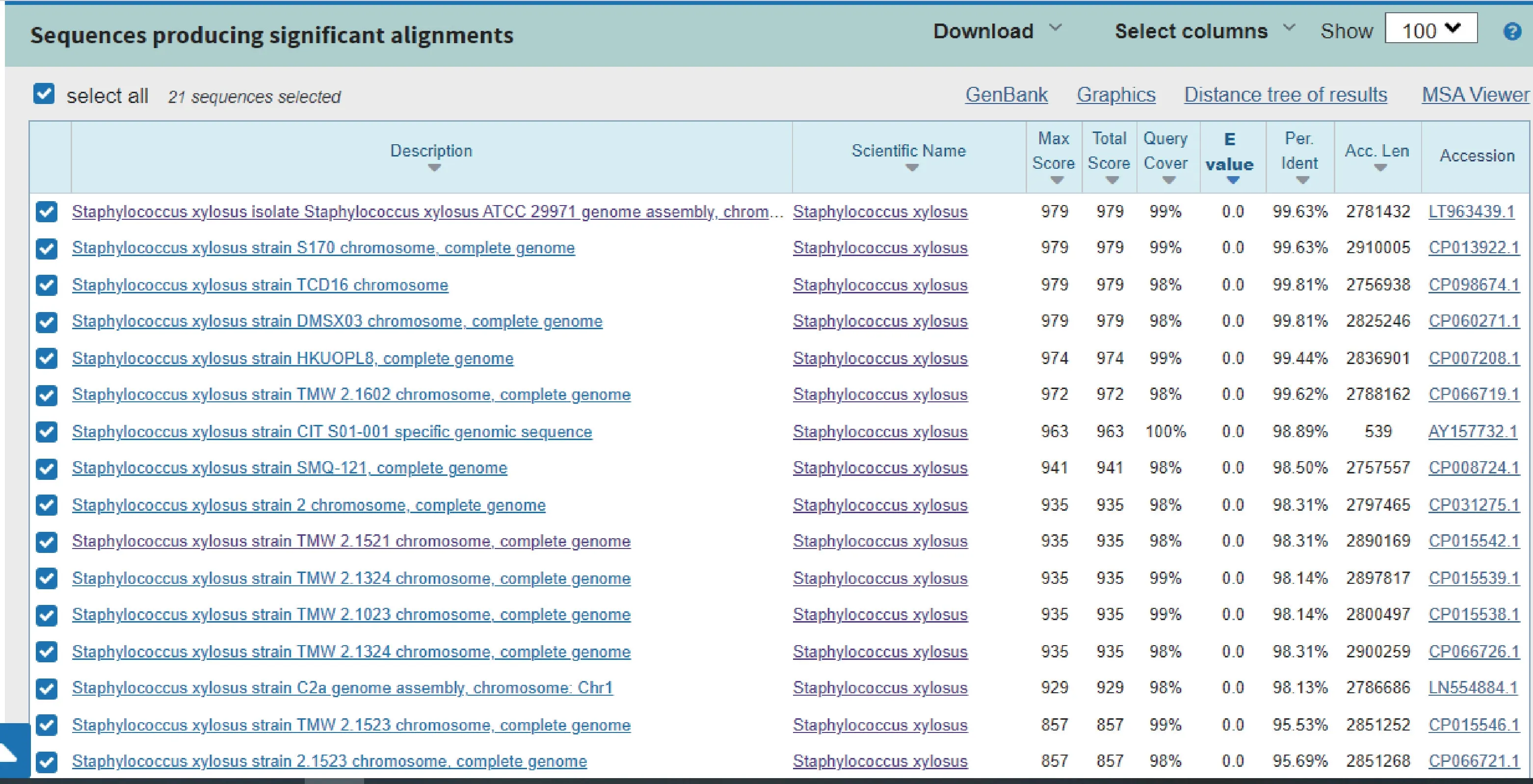
图4 qPCR 产物序列BLAST 比对结果Figure 4 Results of the sequence of qPCR product by BLAST
2.6 与金标准的对比实验
38 例大、小鼠粪便样本中,qPCR 法与培养法的木糖葡萄球菌阳性检出例数相同,均为1 例。 20 例EAD 样本中,qPCR 法的阳性检出例数为2 例,培养法为1 例。 2 例皮肤拭子样本的qPCR 法和培养法检出阳性样本均为2 例。 qPCR 方法所检样本的阳性率为8.3%,培养法得到的阳性率6.7%,qPCR 方法的灵敏度略高于培养法。
3 讨论
木糖葡萄球菌被认为是非致病菌,因此,其鉴定方法的研究文献较少,且主要集中在食品领域。16S rRNA 基因[17]和16S ~23S rRNA 区间序列可以进行木糖葡萄球菌鉴定[19-20]。 RANTSIOU 等[17]利用16S rRNA 基因的V1 ~V3 区可扩增出葡萄球菌属,再经变性梯度凝胶电泳(PCR-DGGE)可鉴定到种。 实验动物的木糖葡萄球菌可以用16S rRNA基因进行检测,但文献中是送到第三方实验室进行检测,并未对其性能等进行阐述[21-22]。
MOROT-BIZOT 等[23]报道了基于PCR-RAPD方法进行木糖葡萄球菌的鉴定,该方法特异性良好,缺点是需进行随机扩增多态性DNA 标记分析,操作繁琐,需要较长时间出结果。 木糖葡萄球菌编码酯酶的gehM基因片段,经RNA 点杂交实验[16]和PCR-DGGE 方法[17]验证,该片段可特异性地识别木糖葡萄球菌,因此,该gehM基因片段可作为木糖葡萄球菌种属特异的序列。 经查阅文献,未检索到该基因片段检测木糖葡萄球菌的qPCR 方法。
本研究以木糖葡萄球菌特异性gehM基因片段为靶序列,建立了大、小鼠木糖葡萄球菌qPCR 的检测方法,并进行了性能评估、临床应用、测序验证及与培养法比对等研究。 所建方法只能扩增出木糖葡萄球菌,特异性强;其最低检测限为100 fg/μL 的DNA 量,灵敏度高;重复性好,均小于3%。 阳性样本荧光PCR 产物序列与木糖葡萄球菌的基因序列同源性为99.6%,表明该样本木糖葡萄球菌核酸阳性。
大、小鼠粪便样本为常规送检样本(经与送检客户沟通,无皮屑等临床症状,共38 例),其qPCR法与培养法的木糖葡萄球菌阳性检出例数相同,均为1 例。 EAD-PCR 法(共20 例)的阳性检出例数为2 例,培养法检出阳性1 例。 皮肤拭子样本(严重皮屑裸鼠1 例,轻微皮屑裸鼠1 例,共2 例)的qPCR法和培养法检出阳性样本均为2 例。 qPCR 方法所检样本的阳性率为8.3%,培养法得到的阳性率为6.7%,qPCR 方法的灵敏度高于培养法。 分析EADPCR 培养法阳性检出率低的可能原因:一是按团体标准[15]进行细菌分离培养时,采用的是划线法接种的方式,阳性EAD 样本分离培养的平皿仅出现约2~6 个疑似单菌落,该接种方式可能会导致目标菌漏检;二是样本分离培养时,对木糖葡萄球菌的菌落和菌体的符合性判断经验不足,可能导致假阴性结果;三是EAD 为排风管道粉尘,细菌在粉尘环境中的存活力与粪便和皮肤环境相比可能较弱,导致EAD 中可培养的活菌相对较少;四是不同的方法学决定了不同的灵敏度,qPCR 的灵敏度优于培养法是有大量文献支撑的[25-26]。
本研究的局限性之一是非目标菌种和目标菌种的数量都有限,应采用更多的非目标菌种,以更好地验证检测结果的特异性,以及采用更多的目标菌种以提高检测方法的准确性;局限性之二是按团体标准[15]进行细菌分离培养时,采用的是划线法接种的方式,阳性EAD 样本分离培养的平皿疑似单菌落个数较少,该方式可能会导致目标菌漏检,应结合涂布法或倾倒法,以防止假阴性结果。
综上所述,本研究建立的木糖葡萄球菌qPCR检测方法,特异性强、灵敏度高、重复性好,结合全自动核酸纯化仪提取核酸,可高效快速地得出检测结果,经临床样本测序及方法学比对验证,可用于实验动物尤其是免疫缺陷动物木糖葡萄球菌的监测,以保障科研结果的准确性和科学性。

