冰冻切片免疫荧光 石蜡切片免疫荧光 石蜡切片免疫组织化学在系统性轻链型淀粉样变性肾病分型中的应用研究
代陆军 杨文秀

【摘要】 目的 探讨冰冻切片免疫荧光(frozen-immunofluorescence,F-IF)、石蜡切片免疫荧光(paraffin-immunofluorescence,P-IF)和石蜡切片免疫组织化学(immunohistochemistry,IHC)在系统性轻链型淀粉样变性肾病分型中的应用。方法 选取2020年5月—2022年5月在贵州医科大学附属医院确诊的52例系统性轻链型淀粉样变性肾病患者,所有系统性轻链型淀粉样变性肾病样本均进行F-IF、P-IF和IHC标记染色,比较这3种病理检验方法对于系统性轻链型淀粉样变性肾病分型的效能。结果 52例患者经F-IF检测分型50例,分型率为96.15%;P-IF检测分型34例,分型率为65.38%;IHC检测分型36例,分型率为69.23%。F-IF检测的分型率高于P-IF、IHC分型率,差异有统计学意义(P<0.05)。F-IF检测中仅κ+检出9例,仅λ+检出38例,双阳性(强度差较大,提示分型)3例;未分型2例,均为阴性。P-IF检测中仅κ+检出6例,仅λ+检出27例,双阳性(强度差较大,提示分型)1例;未分型18例,其中双阳性(强度差较小,分型困难)6例,阴性12例。IHC中仅κ+检出6例,仅λ+检出25例,双阳性(强度差较大,提示分型)5例;未分型16例,其中双阳性(强度差较小,分型困难)4例,阴性12例。3种方法检出率比较,差异有统计学意义(P<0.05)。结论 相较于P-IF和IHC,F-IF对系统性轻链型淀粉样变性肾病的分型诊断更为准确,可以在临床上作为辅助诊断的手段,指导诊疗方案的制定。
【关键词】 轻链型淀粉样变性肾病;分型诊断;病理检验方法
文章编号:1672-1721(2024)07-0107-04 文献标志码:A 中国图书分类号:R692
淀粉样变肾病是指淀粉样纤维大量沉积于肾脏引起的病变[1],主要表现为肾病综合征,进入晚期会导致肾功能衰竭[2]。系统性轻链型淀粉样变性肾病是其中的一种分型,是由漿细胞异常产生单克隆轻链沉积于各组织器官引起的疾病,临床主要表现为蛋白尿,随着病情进展可发展为终末期肾病[3]。系统性轻链型淀粉样变性肾病的分型与治疗方案与患者的预后密切相关,对于淀粉样变的分型做出正确的诊断具有重要意义。系统性轻链型淀粉样变性肾病根据其轻链类型可以分为κ型和λ型,其中κ型所占比例较λ型低[4],但是轻链型淀粉样变肾病κ型患者相较于λ型出现肝脏和肾间质受累的频率更高,器官病变会更加严重。肾活检病理检查是诊断轻链型淀粉样变的重要手段[5],在患者疾病早期做出正确判断,可改善轻链型淀粉样变性肾病患者预后。本研究探讨了常用病理检验方法在轻链型淀粉样变性肾病分型诊断中的效能,报告如下。
1 资料与方法
1.1 一般资料
选取2020年5月—2022年5月在贵州医科大学附属医院确诊的52例轻链型淀粉样变性肾病患者,患者年龄为26~50岁。本研究经医院医学伦理委员会审批,患者及其家属知情并签署知情同意书。
纳入标准:符合轻链型淀粉样变性肾病诊断标准[6];病理诊断为刚果红染色阳性,高锰酸钾预处理后样本的病理诊断仍为阳性,偏振光下会呈现出苹果绿色双折光,患者病理学检查结果显示为单一轻链阳性,物理检查下可见细纤维状结构,无分支,僵硬,排列紊乱。
排除标准:患者对研究中试剂有过敏史。
1.2 方法
样本采集:通过肾穿刺活检获取肾脏病变组织,分别进行F-IF、P-IF、IHC和激光显微切割术联用质谱(LMD/MS)分析。所有样本均行轻链的免疫标记(κ、λ)。
F-IF:冰冻切片置于室温晾干15 min,用组化油笔将待染组织圈好,放入磷酸缓冲盐溶液(phosphate buffered saline,PBS)中浸泡10 min,用含10%正常山羊血清的PBS室温封闭切片1 h,加入轻链抗体,37 ℃孵育1 h,PBS洗3次,15 min/次,封片后用荧光显微镜观察结果并记录。此过程中要注意,整个检测过程中要保证表面干燥,稀释、加入荧光抗体以及之后的洗涤过程中注意避光。
P-IF:60 ℃烤片2 h,二甲苯脱蜡15 min,重复3次。水化时,依次经过无水乙醇,体积分数为95%、90%、80%、70%的乙醇各5 min,蒸馏水(或自来水)5 min。
PBS洗5 min,重复步骤3次。使用0.01 M枸橼酸修复液煮沸(沸水浴)进行修复维持15 min,样本自然凉放置到室温。PBS再洗5 min,重复步骤3次。正常山羊血清封闭,在37 ℃下维持20 min,之后用PBS洗5 min,重复3次。4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)复染细胞核,1∶1 000稀释,室温作用5 min。防淬灭荧光封片剂封片,显微镜下观察并记录结果。
IHC:石蜡切片放置在60 ℃恒温箱中烘烤120 min,脱蜡和水化步骤是二甲苯(20 min)→二甲苯(20 min)→无水乙醇(5 min)→质量分数为95%的乙醇(5 min)→质量分数为80%的乙醇(5 min)。PBS洗2次各5 min,蒸馏水冲洗1次5 min。抗原修复时,当压力锅开始喷气时,盖上气阀,冷却时取下气阀,冷却至室温。蒸馏水洗1次
5 min,PBS洗2次各5 min,质量分数为3%的H2O2在室温下孵育30 min,PBS洗3次各5 min,滴加蓝色试剂,室温孵育30 min后倾倒,PBS冲洗3次各5 min,滴加黄色试剂,37 ℃孵育30 min,PBS冲洗3次各5 min,滴加试剂C(橙色),37 ℃孵育30 min,PBS冲洗3次各5 min,DAB显色5~20 min,自来水充分冲洗,苏木素复染2~3 min,自来水充分冲洗,盐酸酒精分化2 s,自来水充分冲洗。脱水后用中性树脂,加盖玻片(勿残留气泡),自然晾干。
LMD/MS分析[7]:对F-IF、P-IF、IHC均无法分型的样本采用LMD/MS进行分析,分离4~6个肾小球,每例取样3次;将病变组织收集到含缓冲液的试管中,充分涡旋振荡并水浴孵育60 min,40 kHz超声波处理30 min后,二硫苏糖醇还原及碘乙酰胺烷基化;将提取的蛋白37 ℃下胰蛋白酶酶解后液相色谱分离及串连质谱分析。
1.3 结果判断标准
1.3.1 F-IF和P-IF结果
“-”说明结果为阴性。“±”说明结果可疑,需要再次检测。“+”表示阳性,说明视野中仅见微弱荧光;“++”说明视野中荧光微弱稀散;“+++”说明视野下可以看到强荧光。
1.3.2 IHC结果
“-”说明视野中没有发现着色,样本中没有发现棕黄色;“+”(弱阳性)说明视野可见范围内≤10%的部分呈现不同程度的棕黄色着色,其他部位没有显色;“++”说明视野可见范围内10%~30%的部分呈现强的棕褐色着色,或者≤70%的部分呈现弱或中等强度的着色;“+++”说明视野可见范围内>30%的部分呈现强的棕褐色或≥70%的中等强度棕黄色着色。
1.3.3 LMD/MS分析结果
结果有高丰度κ轻链恒定区表达,显著高于其他淀粉样变致病蛋白,可以诊断为轻链型淀粉样变肾病κ型患者。结果有高丰度λ轻链恒定区表达,显著高于其他淀粉样变致病蛋白,可以诊断为轻链型淀粉样变肾病λ型患者。
1.4 统计学方法
采用SPSS 22.0统计学软件分析数据,样本的检出率等计数资料用百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 轻链型淀粉样变性肾病患者的F-IF、P-IF、IHC分型率比较
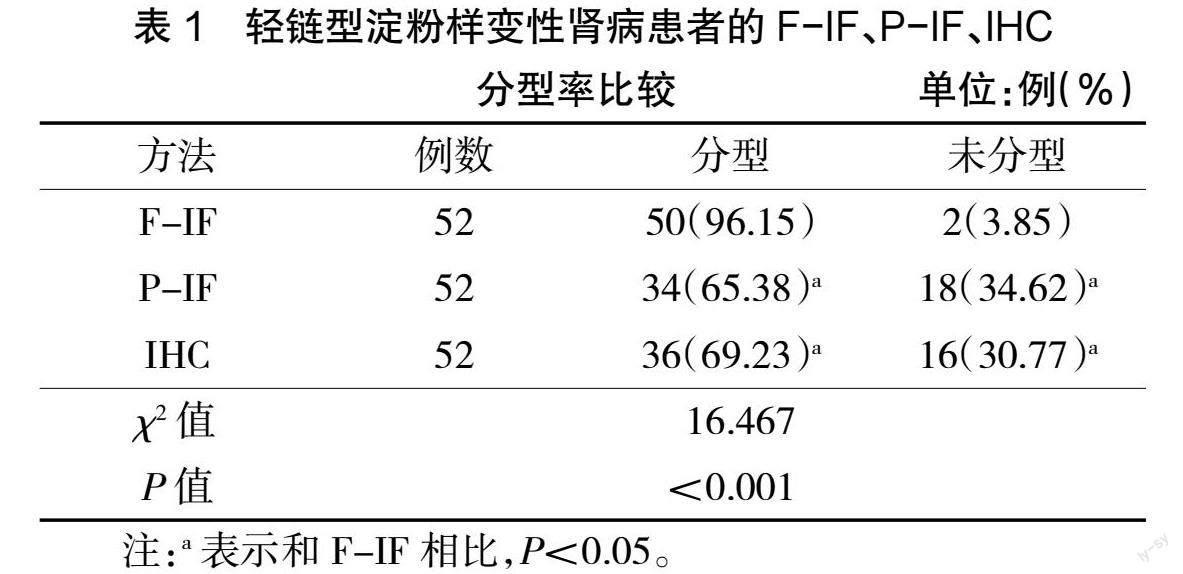
52例患者经F-IF、P-IF、IHC检测共分型50例,其中F-IF检测轻链型淀粉样变性肾病分型率为96.15%,P-IF的分型率为65.38%,IHC的分型率为69.23%。F-IF分型率高于P-IF、IHC分型率,差异有统计学意义(P<0.05)。未分型患者共2例,经LMD/MS分析均为λ型,见表1。
2.2 轻链型淀粉样变性肾病患者的F-IF、P-IF、IHC分型具体情况比较
52例患者经F-IF检测分型50例,其中仅κ+检出9例,仅λ+检出38例,双阳性(强度差较大,提示分型)3例;未分型2例,均为阴性。P-IF检测分型34例,其中仅κ+检出6例,仅λ+检出27例,双阳性(强度差较大,提示分型)1例;未分型18例,其中双阳性(强度差较小,分型困难)6例,阴性12例。IHC检测分型36例,其中仅κ+检出6例,仅λ+检出25例,双阳性(强度差较大,提示分型)5例;未分型16例,其中双阳性(强度差较小,分型困难)4例,阴性12例。3种方法检出率比较,差异有统计学意义(P<0.05),见表2。
3 讨论
淀粉样变常会侵犯机体多个器官和系统,导致患者出现不同程度的身体器官机能障碍。淀粉样变指一种形似淀粉样的物质沉降于机体各部位,可能侵犯于各个器官,也可能只存在于表皮,会对机体正常的生理功能产生一定的影响,其形成原因尚不明确[8]。淀粉样物质是由来源于各处的小分子前体蛋白通过一定的改变发生了异常变形,由一种可以溶解的物质最终形成了难以溶解的纤维丝,在体内各个器官沉积,导致器官发生功能障碍[9]。系统性淀粉样变性通过不同的前体蛋白分型可以分为12种,其中最为常见的是轻链型淀粉样变。轻链型淀粉样变性肾病是一种不可治愈性疾病,主要是单克隆免疫球蛋白轻链在折叠过程中发生了错误,沉积于体内,导致沉积部位的功能发生障碍,进而破坏其结构和发展。不同类型的这一疾病临床治疗方案不同,及早快速且准确地对患者进行疾病分型对于治疗方案的确立和预后转归的进展具有积极意义[10]。影响疾病正确分型的重要因素之一是样本的质量。轻链型淀粉样变性肾病主要侵害的器官是肾脏,肾脏进行活检的取材阳性率较高,且对患者身体的危害性较小,患者安全性较高。故本研究采用常用的病理检验方法来探究其在轻链型淀粉样变性肾病分型诊断中的效能。
本研究结果显示,52例患者经F-IF、P-IF、IHC检测共分型50例,F-IF检测轻链型淀粉样变性肾病分型率为96.15%,P-IF的分型率为65.38%,IHC的分型率为69.23%。F-IF分型率高于P-IF、IHC分型率。系統性轻链型淀粉样变性肾病可以分为κ型和λ型,早期分型诊断对于指导临床治疗具有重要意义。有研究[11]显
示,轻链型淀粉样变性分型方法有很多种,其中较好的是F-IF检测方法,与本研究结果基本一致。临床实践中,轻链型淀粉样变性肾病分型检测结果往往会受到多种因素影响,如标本的取材数量不够,或者标本的储藏条件不同,或者储藏条件发生改变等,这些因素都可能导致检测结果发生假阴性或者其他错误分型。P-IF和IHC是临床上进行轻链型淀粉样变性肾病分型诊断的重要辅助手段,但其分型结果容易受标本质量等因素影响,出现阴性、双阳性(无法分型)等无法分型的情况。IHC检测需要采用甲醛固定,可能对抗原表位产生不良影响导致其被覆盖,在检测时需要进行抗原修复,使其表位再次显露出来,操作较为烦琐。本研究结果提示,临床可优先采用F-IF检测方法对系统性轻链型淀粉样变性肾病进行分型诊断。目前,系统性轻链型淀粉样变性肾病的诊断分型尚存在许多问题需要解决,包括检测显示轻链型淀粉样变性阴性、双阳性(无法分型)等。有研究[12]显示,使用常规免疫病理技术无法对系统性轻链型淀粉样变性肾病分型时,可以使用LMD/MS技术。本研究结果显示,未分型患者共2例,经LMD/MS分析均为λ型,提示LMD/MS技术可以对常规免疫病理技术无法分型的患者进行分型,了解轻链型淀粉样变性肾病患者病理分型,改善患者的预后。淀粉样变性肾病目前在临床上已经不是罕见的疾病,尽可能快速且准确地明确其分型并做出诊断,把握疾病的发展方向,指导临床治疗,改善患者预后,是临床进行淀粉样变性肾病干预治疗、减缓疾病带来的机体损伤和改善患者预后的关键。F-IF不能作为金标准来对轻链型淀粉样变性肾病患者进行高准确率的分型,但是可以作为检测轻链型淀粉样变性肾病分型的重要辅助手段,指导临床诊断和治疗。
综上所述,相较于P-IF和IHC,F-IF对于系统性轻链型淀粉样变性肾病的分型诊断较为准确,临床可以优先采用F-IF检测方法对系统性轻链型淀粉样变性肾病进行分型诊断;对于3种方法均无法分型的患者,可以采用LMD/MS技术进行分型,指导治疗方案的制定,值得在临床上推广使用。
参考文献
[1] 袁博寒,朱斌,胡云琴,等.51例肾淀粉样变性临床病理特征及中医证候相关性分析[J].中国中西医结合肾病杂志,2021,22(10):898-900.
[2] 冯婕,孔冉冉,余晓洋,等.AL型淀粉样变性肾病临床及病理特征的性别差异[J].中日友好医院学报,2020,34(4):214-216,219.
[3] 路瑾.系统性轻链型淀粉样变性的疗效评估[J].肾脏病与透析肾移植杂志,2021,30(6):547-548.
[4] 林泽宇,陈文明.系统性轻链型淀粉样变的治疗进展[J].国际输血及血液学杂志,2018,41(1):79-84.
[5] 黄湘华,刘志红.积极应对系统性轻链型淀粉样变性诊治带来的挑战[J].中华医学杂志,2021,101(22):1631-1634.
[6] 中国系统性淀粉样变性协作组,国家肾脏疾病临床医学研究中心.系统性轻链型淀粉样变性诊断和治疗指南[J].中华医学杂志,2016,96(44):3540-3548.
[7] SUAREZ G M L,ZHANG P C,NASR S H,et al.The sensitivity and specificity of the routine kidney biopsy immunofluorescence panel are inferior to diagnosing renal immunoglobulin-derived amyloidosis by mass spectrometry[J].Kidney Int,2019,96(4):1005-1009.
[8] 孙志强,黄艳平,田华,等.反射式共聚焦扫描显微镜在原发性皮肤淀粉样变诊断中的应用[J].中国中西医结合皮肤性病学杂志,2021,20(2):169-171.
[9] 张帆,喻小娟,王素霞,等.常用的免疫病理方法在轻链型肾淀粉样变性分型中的作用[J].标记免疫分析与临床,2020,27(5):818-822.
[10] 中国系统性轻链型淀粉样变性协作组,国家肾脏疾病临床医学研究中心,国家血液系统疾病临床医学研究中心.系统性轻链型淀粉样变性诊断和治疗指南(2021年修订)[J].中华医学杂志,2021,101(22):1646-1656.
[11] 覃乔静,常凯利,赵仲华,等.56例肾淀粉样变性的病理分型及临床分析[J].复旦学报(医学版),2021,48(2):188-194.
[12] ADACHI M,KITAMURA M,MUTA K,et al.IgM monoclonal gammopathy with heavy-and-light-chain amyloidosis resembling fibrillary glomerulonephritis determined by tandem mass spectrometry:a case report[J].BMC Nephrol,2020,21(1):195-201.
(编辑:郭晓添)
参考文献
[1] 李晓君,谭俊青,潘慧娟,等.老年患者导尿管相关念珠菌泌尿系感染菌株分布及药敏分析[J].中国真菌学杂志,2020,15(3):161-163.
[2] 李晶昱,刘婷婷,罗文山,等.68例泌尿道感染并尿培养阳性患者菌群分布及耐药性分析[J].中国实验诊断学,2019,23(10):1791-1792.
(下转第110页)
(上接第106页)
[3] 赵芬芬,李萍,王花.重症患者尿管相关性尿路感染的病原菌分布及耐药性分析[J].山西医药杂志,2018,47(1):21-23.
[4] 杨丽,陈玉烛,车良菊,等.失效模式与效应分析对泌尿外科留置导尿患者尿路感染的影響[J].中华医院感染学杂志,2018,28(4):610-613.
[5] 严友纪,廖星富,陈忠军,等.泌尿外科患者尿路感染病原菌分布及耐药性分析[J].海南医学,2018,29(20):2869-2872.
[6] 王功立.泌尿系感染的诊断与治疗[J].中国执业药师,2007(8):16-17.
[7] MIURA K,TANAKA A,YAMAMOTO T,et al.Proton pump inhibitor use is associated with spontaneous bacterial peritonitis in patients with liver cirrhosis[J].Intern Med,2014,53(10):1037-1042.
[8] 关天佑,汪小明,郭志新,等.泌尿系统感染病原菌的分布及耐药性分析[J].广西医科大学学报,2017,34(2):213-213.
[9] 韩志梅.尿路感染患者尿液病原菌分布及药敏结果分析[J].中国民康医学,2021,33(6):111-113.
[10] 袁星,胥振国,曹雷.泌尿系感染病原菌的分布及大肠埃希菌的耐药性分析[J].华北理工大学学报(医学版),2019,21(1):27-31.
[11] 邢桂生.泌尿外科住院患者泌尿系感染临床及病原菌调查[J].中国卫生检验杂志,2019,29(19):2427-2430.
[12] 韩燕丽.老年尿路感染住院患者病原菌分布及药敏状况分析[J].航空航天医学杂志,2021,32(12):1464-1465.
(编辑:张兴亚)

