卵巢微乳头亚型浆液性交界性肿瘤临床病理与分子特征分析
宋 芳,陈汝蕾,马晓婷,吕京澴
卵巢微乳头亚型浆液性交界性肿瘤(micropapillary serous borderline tumor, MSBT)是浆液性交界性肿瘤(serous borderline tumor, SBT)的特殊亚型,1996年由Burks等[1]首次提出。MSBT与经典型SBT相比,其侵袭性强和预后差,但优于低级别浆液性癌(low grade serous carcinoma, LGSC)。由于MSBT组织学、分子学等特征较为独特,诊断和治疗存在较多难点。WHO(2014)女性生殖系统肿瘤分类[2]将卵巢MSBT单独列出,命名为“微乳头型交界性浆液性肿瘤/非浸润性LGSC”,ICD-O编码由原来的8442/1改为8460/2,以肿瘤内微乳头结构>5 mm或肿瘤面积>10%为重要鉴别点。WHO(2020)女性生殖系统肿瘤分类[3]对其进行调整,命名为SBT,微乳头/筛状亚型,ICD-O编码为8460/2,不推荐使用“非浸润性LGSC”术语。目前,临床和病理医师对其认识不足,缺乏鉴别MSBT和LGSC的免疫组化指标,国内有关MSBT分子遗传学的报道较少。本文着重探讨MSBT的临床病理特征、诊断和鉴别诊断,以提高对该肿瘤的认识,寻找有效的免疫组化标志物和了解分子遗传学特征。
1 材料与方法
1.1 临床资料收集2011~2022年我院14例MSBT标本,参考WHO(2020)女性生殖系统肿瘤分类标准,由两位病理科高级职称医师重新阅片。患者年龄27~56岁,平均41.7岁。肿瘤位于双侧卵巢者9例,右侧单发卵巢者5例。1例因阴道出血就诊,4例因下腹胀痛就诊,1例因月经改变就诊,其余患者均无症状由体检或复查发现。术前血液中肿瘤标志物CA125升高者11例;5例有多少不等的腹水,均可查见肿瘤细胞(表1)。另选取同时期7例LGSC标本作为对照,患者年龄30~65岁,平均46.6岁,肿瘤位于双侧卵巢者3例,左、右侧卵巢者各2例。
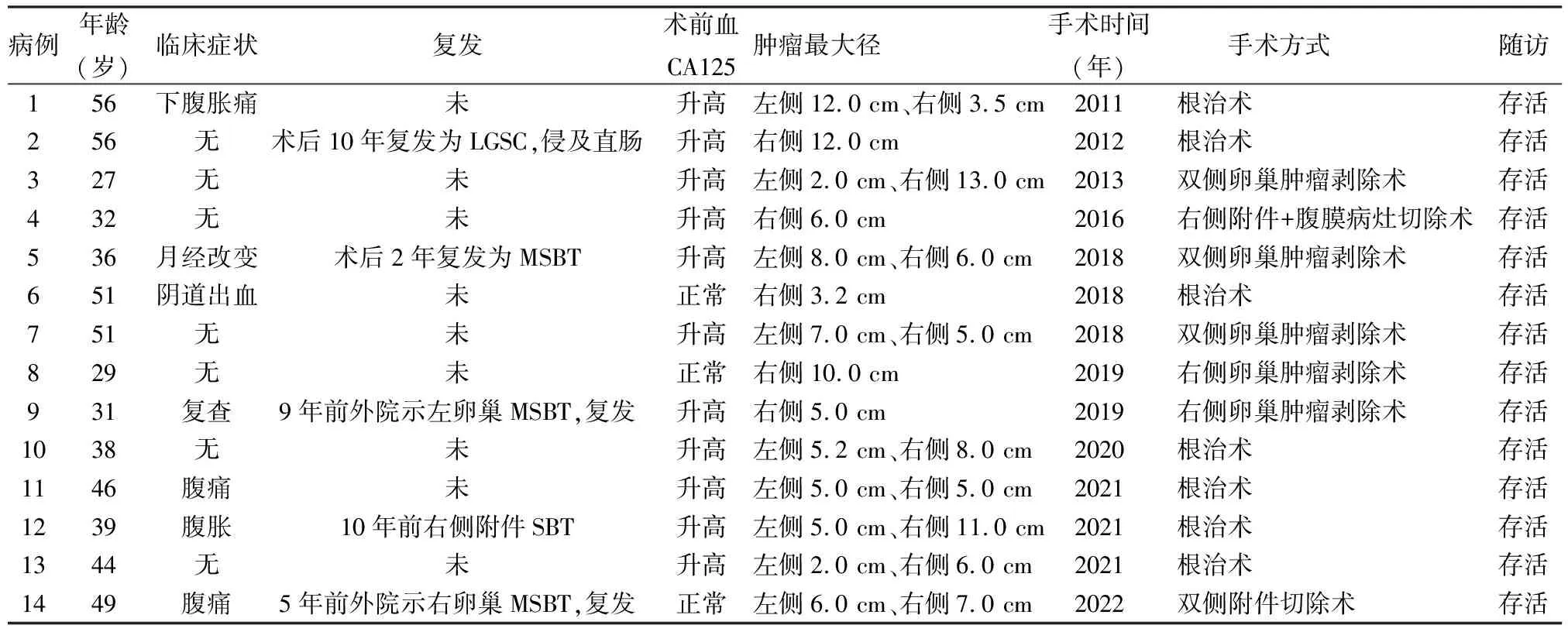
表1 14例MSBT患者的临床资料
1.2 免疫组化肿瘤充分取材,标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,切片,行HE、免疫组化EnVision法染色。抗体ER、PR、CA125、CK7、WT-1、HER2、p53和Ki67,均购自上海基因公司。IMP3抗体购自北京中杉金桥公司,具体操作步骤严格按试剂盒说明书进行。IMP3为胞质着色,以≥5%的肿瘤细胞胞质着色为阳性[4]。
1.3 基因检测采用qRT-PCR法和Sanger测序法,检测BRAF和KRAS基因突变。qRT-PCR法:选取检测的肿瘤区域,切片提取DNA,利用特异性引物和Taqman技术,使用荧光PCR仪进行扩增,收集荧光信号提示是否有突变。Sanger测序:样本中提取gDNA,利用特异性引物进行BRAF和KRAS基因的目的片段扩增。通过凝胶电泳法查看目的基因是否成功扩增,将PCR产物进行消化,去除非目的片段和多余的dNTP。应用测序引物行突变位点的特异性扩增,再纯化扩增产物,采用测序仪读取碱基序列并用专业软件进行结果分析。
2 结果
2.1 临床特点14例标本均为囊实性肿物,最大径2.0~13 cm。6例囊外壁光滑,8例囊壁表面见外生乳头状物。囊性区内含淡黄色液体或胶冻样物,囊内乳头多少不等,实性区呈灰黄和灰白色,质脆。
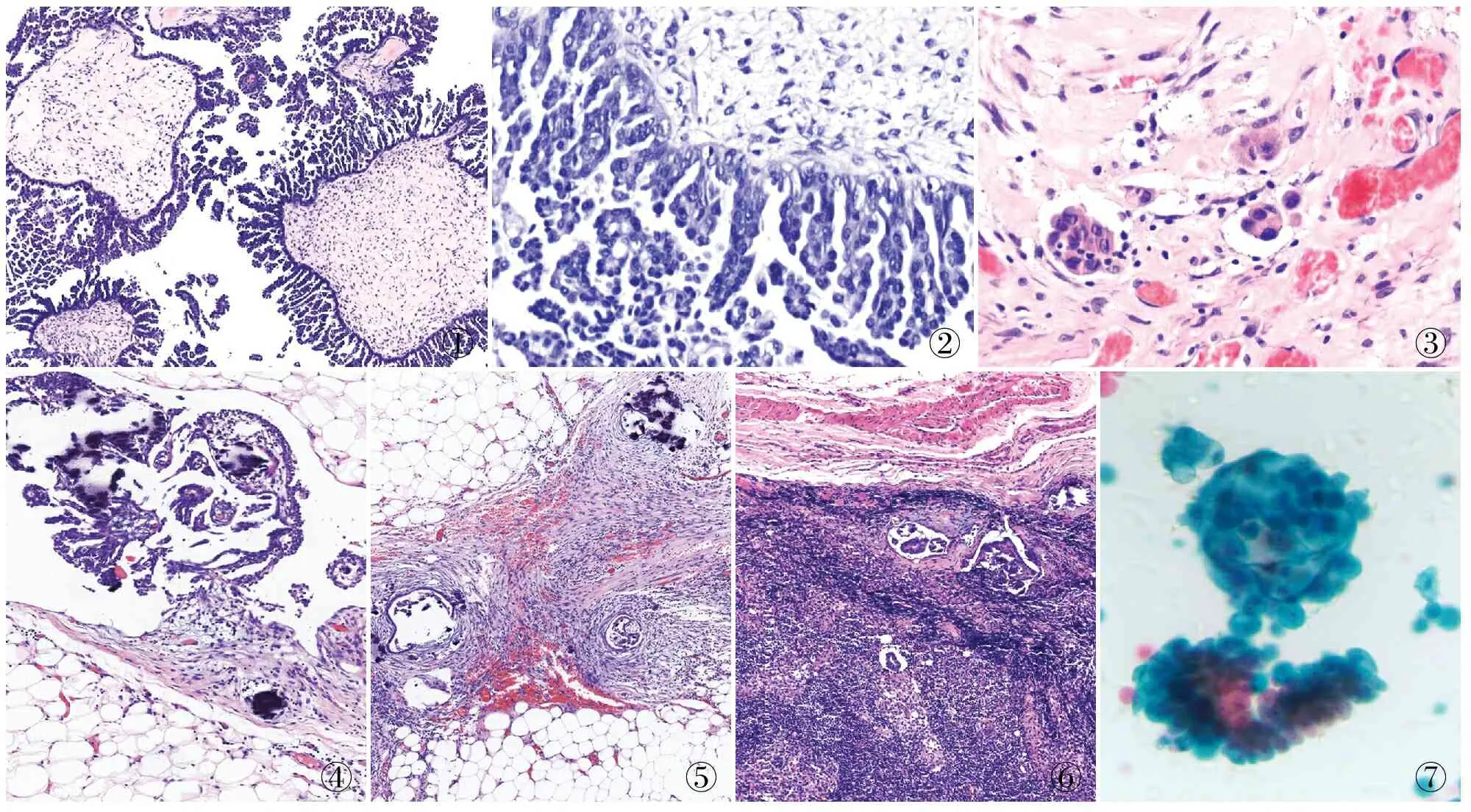
2.2 病理特征14例肿瘤镜下均呈乳头状结构,存在大量没有分支的、直接从大的纤维化乳头表面直接发散出细长的微乳头,呈“美杜莎头”样外观(图1)。微乳头未形成多级分支结构,无或有少量间质轴心,微乳头长宽比>5,被覆细胞呈立方至多角形,细胞核小且一致,核呈轻-中度异型性,核质比增高,可见小核仁(图2),微乳头范围均>5 mm。
①②③④⑤⑥⑦
本组5例伴微浸润,表现为纤维间质中出现单个的细胞和细胞团,或者简单的乳头结构,微浸润肿瘤细胞与周围间质见收缩间隙,无促纤维反应,间质未破坏(图3)。6例伴腹膜非浸润性种植,其中4例为非浸润性上皮型种植,种植成分与相邻的大网膜分界良好,无间质反应。在上皮内衬的间隙内可见典型的乳头和乳头簇结构。乳头含有低级别核特征的细胞,可见砂粒体(图4)。2例为非浸润性促结缔组织增生型种植,在促纤维增生间质中存在低级别腺体伴轻度复层上皮,反应性间质在种植上皮周围形成明显的袖带(图5)。3例伴淋巴结受累(图6)。5例患者伴腹水,腹水内见肿瘤细胞,呈乳头状结构(表2,图7)。
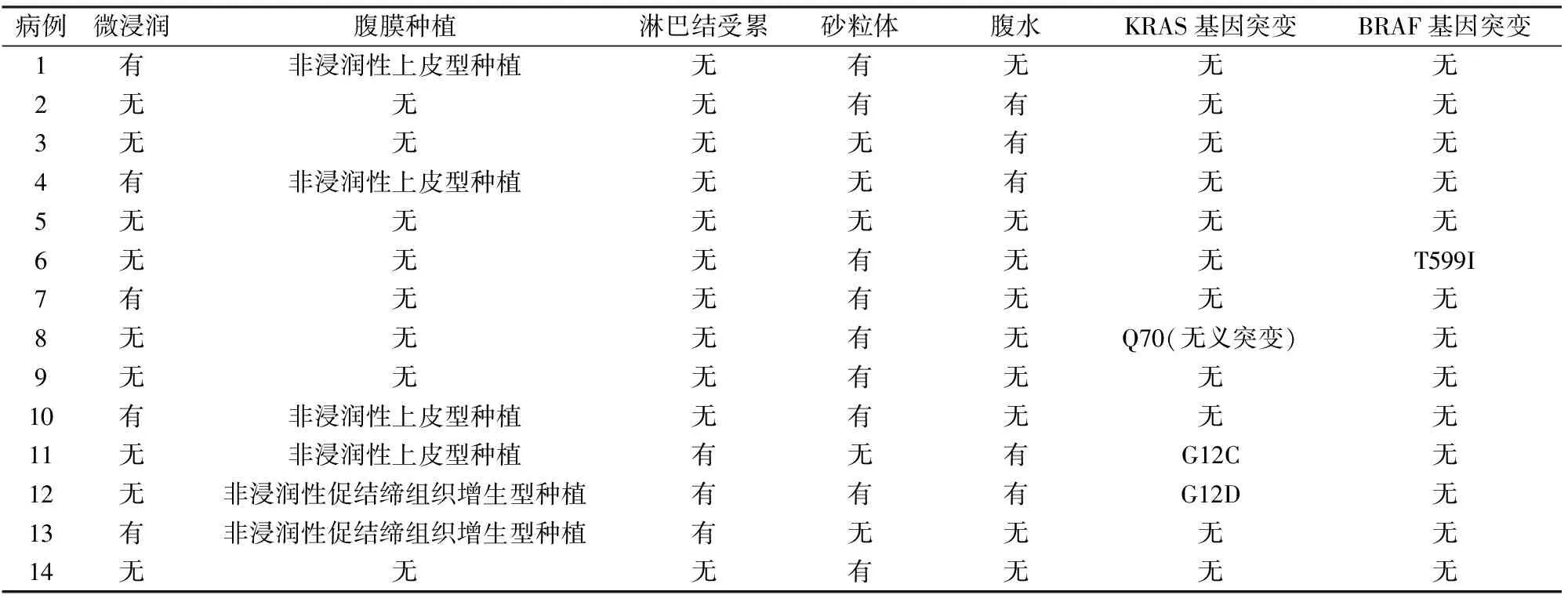
表2 14例MSBT患者的病理特征
2.3 免疫表型14例MSBT中ER(图8)、PR、CA125(图9)、CK7和WT-1均阳性,p53野生型(图10),HER2、IMP3均阴性(图11),Ki67增殖指数5%~30%(图12)。对照组7例LGSC中有4例(4/7, 57.1%)IMP3阳性(图13)。

⑧⑨⑩
2.4 分子学特征14例MSBT患者中有3例(3/14, 21.4%)检出KRAS基因突变,例11突变位点为G12C,例12突变位点为G12D(图14),例8突变位点为Q70(无义突变)。本组均未检出BRAF V600E突变,其中例6(1/14, 7.1%)检出T599I突变,为Ⅱ类基因改变(激酶激活性二聚体)(表2)。
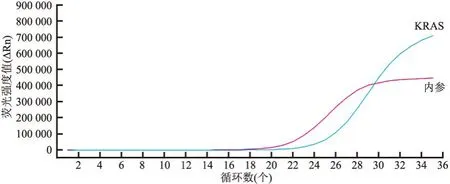
图14 qRT-PCR法检测基因扩增曲线:KRAS G12D突变
2.5 随访本组患者随访时间1~12年,其中5例有复发史,9例未复发。截至目前,患者均存活。
3 讨论
3.1 临床特征MSBT属于少见的卵巢上皮性肿瘤,低度恶性,好发于中青年女性,平均发病年龄45岁,比浆液性癌患者小10~15岁。患者多无明显临床症状,术前检查血清CA125水平多升高,多为双侧发病[5]。本组14例有9例为双侧病变(64.3%),经典型SBT约33.3%为双侧病变。
3.2 病理学特征MSBT镜下可见从大乳头分出大量细长微乳头,与经典型SBT不同,该微乳头缺乏逐级分支且长宽比>5,无或仅有少量纤维间质。肿瘤细胞比经典型SBT更具单一性,呈轻-中度异型性,缺乏或少见嗜酸性细胞和纤毛细胞,可伴局灶微浸润(浸润灶<5 mm)。病理检查时肿瘤应充分取材,防止漏诊LGSC。
SBT独特的病理特征包括微浸润、淋巴结受累和卵巢外病变/腹膜非浸润性种植等,本组MSBT患者中均可见类似表现。5%~10%的SBT可出现无破坏的间质浸润,肿瘤最大径≤5 mm,不限病灶数量。经典型SBT的浸润形式为单个或小簇状的嗜酸性细胞,其本质是退变的细胞,周围存在收缩间隙。MSBT是少见嗜酸性细胞,微浸润形式通常为结构简单的细胞簇,需注意无间质反应。部分MSBT伴腹腔淋巴结受累,Messini等[6]报道腹腔淋巴结受累与患者预后无关,与腹膜种植相关,受累淋巴结内常有输卵管内膜异位。本组患者有3例伴淋巴结受累,这3例均伴腹膜种植,均见输卵管内膜异位,与文献报道一致。WHO(2020)女性生殖系统肿瘤分类中规定若伴腹膜浸润性种植则诊断为LGSC,腹膜非浸润性种植又分上皮型和促结缔组织增生型,上皮型多位于腹膜外表呈赘生性生长,或在包裹腹膜表面间皮内陷处生长。促结缔组织增生型非浸润性种植与浸润性种植较难鉴别,前者为非破坏性浸润,病灶间质多、上皮少,且间质常呈明显水肿状伴炎症细胞浸润和肉芽组织,细胞轻-中度异型,上皮与间质和谐共生,常见上皮与周围间质细胞相互移行,砂粒体常见。Ardighieri等[7]发现种植物肿瘤细胞内存在与卵巢肿瘤细胞相同的基因突变,提示种植物肿瘤细胞来源于卵巢原发病灶。
3.3 免疫表型MSBT肿瘤细胞ER和PR通常高表达,多表达CA125、CK7和WT-1,p53野生型,Ki67增殖指数较低。IMP3属于RNA结合的癌胎蛋白,与细胞迁移、胚胎发生和肿瘤发生均有关,参与人类胚胎发生和致癌,通常只在胎儿组织中表达,在成人正常组织中不表达,也有文献报道随着恶性细胞的出现IMP3复表达[8-9]。Chisté等[10]报道IMP3在卵巢浆液性癌中高表达(68%),在交界性浆液性肿瘤中低表达(<5%)。本组14例IMP3均不表达,对照组7例LGSC中有4例(4/7, 57.1%)表达IMP3,提示IMP3可应用于卵巢SBT和LGSC的鉴别诊断。
3.4 分子学改变SBT的分子病理学改变主要为KRAS和(或)BRAF基因的激活突变,占50%~60%;其次是ERBB2过表达,缺乏TP53或BRCA基因突变[11]。国外一项大样本和长期随访发现,BRAF突变组SBT通常无微乳头变异型,MSBT的BRAF突变率为4.2%(1/24),KRAS突变率为33.3%(8/24),野生型为62.5%(15/24)。经典型SBT的BRAF突变率为28.8%(51/177),KRAS突变率为49.2%(87/177),野生型为22.0%(39/177)[12]。研究还发现,BRAF V600E突变SBT组织学有显著特征,即肿瘤细胞有丰富的嗜酸性胞质,且携带BRAF V600E突变的SBT发生浆液性癌风险较低。BRAF V600E突变可作为卵巢SBT的预后生物学标志物,KRAS突变预示患者预后较差[13]。Malpica等[14]研究显示SBT中KRAS突变率为17%~39.5%,携带KRAS突变SBT更易发展为LGSC,而携带BRAF V600E突变SBT较少进展为LGSC。本组14例MSBT中检测有KRAS突变3例,突变率为21.4%;BRAF突变仅1例,无BRAF V600E位点突变,与国外报道一致,提示MSBT的分子学改变可能无种族特异性。
3.5 鉴别诊断(1)经典型SBT:卵巢MSBT常可伴经典型SBT成分,MSBT存在大量没有分支的、直接从大乳头分出的微乳头为主要鉴别点,微乳头长宽比>5。若微乳头结构较少(<5 mm或10%)的肿瘤,可诊断为普通型SBT伴局部微乳头特征。(2)LGSC:卵巢LGSC临床少见,病灶中常伴SBT肿瘤成分。两者细胞形态无特异性鉴别点,分子学特征类似。MSBT可伴局灶间质微小浸润(<5 mm),若浸润灶>5 mm或伴浸润性腹膜种植应诊断为LGSC。(3)高级别浆液性癌(high grade serous carcinoma, HGSC):癌细胞高度异型,核分裂象多见。MSBT中的核异型一般为轻-中度,如果出现重度核异型则需考虑HGSC的可能。另外,MSBT中TP53多为野生型,HGSC多伴TP53基因突变,免疫组化标记为弥漫强阳性着色或完全不着色。
3.6 治疗与预后MSBT与经典型SBT相比,患者以双侧卵巢和卵巢表面受累更多见,且多伴外生乳头,乳头表面细胞脱落至腹腔,使其更易出现卵巢外种植。患者术后也更易复发,复发后恶性程度增加甚至发生癌变。Anglesio等[11]报道在尚未有腹膜转移的早期病变中,MSBT与经典型SBT的预后相似。Kokawa等[15]发现MSBT中唯一影响预后的因素,是腹腔内种植和种植类型。Messini等[6]也发现只有微浸润和存在侵入性植入物,与MSBT复发有关。本组14例患者随访时间1~12年不等,其中5例有复发史,截至目前患者均存活。本组3例双侧发病,3例伴外生乳头,1例伴腹膜非浸润性种植,1例伴KRAS基因突变,均是复发的高危因素。MSBT预后与经典型SBT相当,优于LGSC。
年轻MSBT患者有生育要求可选择保育手术,患者需长期随访防止复发,对无生育要求的MSBT患者建议行根治性手术+大网膜切除,是否同时行腹膜后淋巴结清扫还存在争议[16-17]。不伴腹腔内浸润性种植的患者术后无需化疗。Vasconcelos等[18]通过Meta分析显示,化疗对合并腹腔内浸润性种植的MSBT患者未能明显获益。
综上所述,卵巢MSBT临床病理特征复杂,治疗方案尚存较多争议,需积累更多病例进一步分析,以提供更精准的病理诊断、手术方案和治疗策略为患者服务。

