2014年黄骅港海域浮游植物群落结构季节变化及其影响因素
刘 栋, 吕振波, 王田田, 张晶晶, 任中华, 高彦洁, 王以斌, 郑 亮
(1.上海海洋大学 海洋科学学院, 上海 201306; 2.山东省海洋资源与环境研究院, 山东 烟台 264006; 3.鲁东大学滨海生态高等研究院, 鲁东大学, 山东 烟台 264003; 4.烟台市海洋经济研究院, 山东 烟台, 206006; 5.自然资源部第一海洋研究所, 山东 青岛 266061; 6.山东省海阳市海洋发展和渔业局, 山东 海阳 265100)
引 言
浮游植物是海洋生态系统中最重要的初级生产者,贡献了超过50%的海洋初级生产力,在全球碳循环中起着至关重要的作用,其群落结构及丰度的变化不仅直接影响上层海洋生物而且还影响生态系统的结构与功能和气候变化,因此常将其作为反映环境变化的指标[1-3],用于研究生态环境变化。海洋工程建设通过改变海域环境、水动力条件、水体营养物质扩散等直接或间接地对海域内浮游植物的群落结构特征产生影响[4],例如,象山港滨海发电厂的温排水和高浓度营养盐,使浮游植物的生物量明显增加,从而引发赤潮,造成了严重的经济损失与环境污染[5]。
渤海湾位于渤海西部,是典型的半封闭式海湾,海水的交换能力弱、自净能力差、环境承载力弱,该区域也是我国海洋开发利用和围填海的重点区域[6]。近年来,受海洋工程建设、陆源污染排放等人类活动影响,渤海湾海域富营养化水平较高,赤潮频发[7]。黄骅港位于渤海湾西南部,是集港口码头、滨海电厂、化工和钢铁企业等多种海洋工程于一体的现代化港口,其建设显著改变了海域的岸线形状、潮流场和温盐环境,从而影响海域内海洋生态环境[8]。海洋工程对海洋环境的影响具有分散和滞后的特点,且不同季节变化各不相同,目前针对海洋工程建设对渤海湾浮游植物季节性变化影响的研究较少。本研究于2014年对黄骅港海域开展春夏秋冬4个航次的调查,分析该区域不同季节浮游植物主要控制因素,为今后渤海湾近岸海域的生态修复工作提供科学支撑。
1 材料和方法
1.1 采样站位
2014年2月(冬季)、5月(春季)、8月(夏季)和11月(秋季)针对黄骅港海域进行四个航次的生态环境综合调查。监测海域范围为北纬38°14′42.00″~38°34′04.80″和东经117°42′25.20″~118°15′10.80″。2月航次调查共计布设12个站位,5月、8月和10月共布设15个站位(图1)。
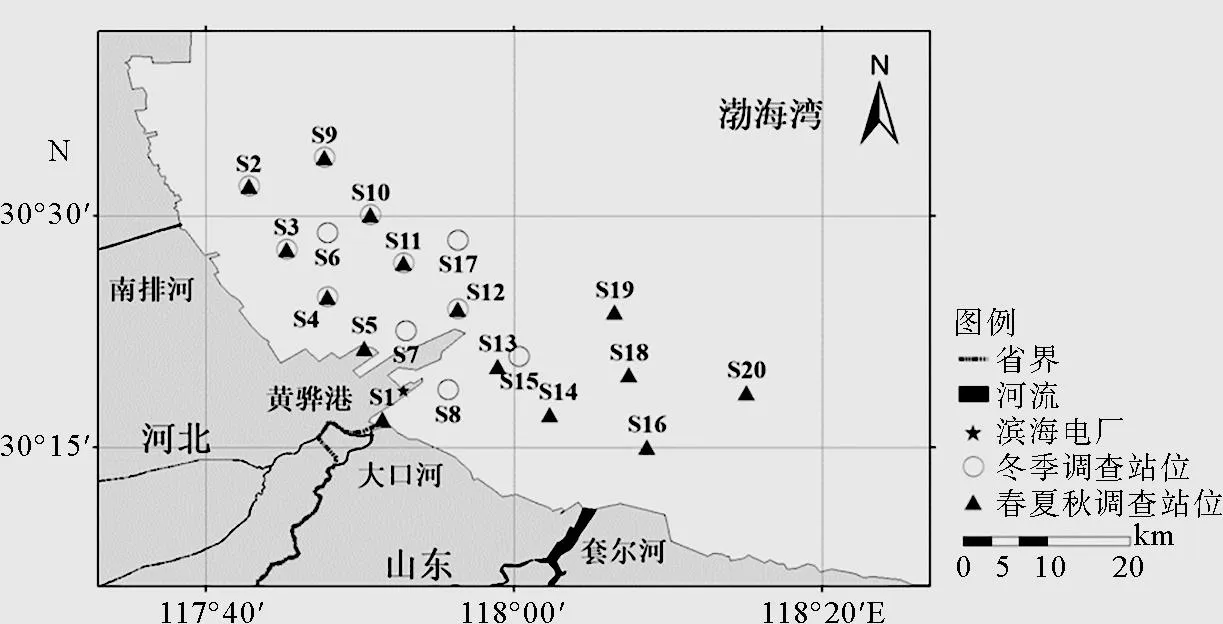
图1 采样站位
1.2 样品采集与处理
每个调查站位取表层水样监测温度(T)、盐度(SAL)、溶解氧(Dissolved oxygen,DO)、硝酸盐(NO3-N)、亚硝酸盐(NO2-N)、铵盐(NH4-N)、磷酸盐(PO4-P)和叶绿素(Chla);同时网采浮游植物进行鉴定。水温、盐度采用YSI水质分析仪现场测定;DO、NO3-N、NO2-N、NH4-N、PO4-P和Chla等指标根据《GB/T 12763.4 海洋调查规范:海水化学要素调查》于实验室内测定。浮游植物采集使用浅水Ⅲ型浮游植物网(直径37 cm、网口面积0.1 m2、网目孔径77 μm)自底至表垂直拖网,所采样品用浓度为5%的福尔马林溶液固定。浮游植物样品经浓缩,取0.1 mL样品在实验室内用Olympus CX31型显微镜下进行浮游植物鉴定计数,单位为104cells/m3。浮游植物鉴定过程主要参考《中国海藻志》《中国海域常见浮游硅藻图谱》和《海藻学》[9-11]。
1.3 数据分析与绘图
1.3.1 优势度
优势度Y指数计算公式为[12]:
(1)
式中,N为物种的总个体数;ni为第i种的个体数;fi为该种的出现频率。选取Y≥0.02的物种作为优势种群。
1.3.2 物种多样性
Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J′)计算公式分别为[13-14]:
H′=-ΣPilnPi
(2)
J′=H′/LnS
(3)
式中:S为种类数;N为某一物种的生物量;Pi为第i种物种生物量占其总生物量的比例。
1.3.3 图件绘制
选取在各季节浮游植物总丰度中占比超过1%的物种同环境因子之间进行冗余分析(redundancy analysis,RDA),浮游植物丰度数据与环境因子数据进行lg(x+1)转换,转换后的数据先进行除趋势对应分析(detrended correspondence analysis,DCA),结果显示4个轴最大梯度长度均小于4,因而选用线性模型的RDA分析研究环境因子和浮游植物群落结构的相关性[8],浮游植物群落结构与环境因子的RDA分析的排序图使用Canoco for Windows 4.5软件绘制;温度、盐度、DO、营养盐、Chla和浮游植物丰度空间分布图使用surfer 10.3绘制,浮游植物群落结构分布图采用ArcGIS 10.5进行绘制。
2 结果与分析
2.1 温盐时空分布特征
2014年黄骅港海域温盐时空变化见图2。2014年该海域表层水温年变化范围为1.96~28.10 ℃,夏季温度最高(27.48±0.33 ℃),冬季最低(4.45±2.37 ℃)。冬季该海域水温温差较大,呈现西北-东南逐渐升高的趋势,该海域东南-西北方向的沿岸流可能受港口工程建设的影响改变了流向,进而阻隔了滨海电厂温排水的热影响[15]。春季水温高值区移动至大口河河口海域,并由河口向四周辐射降低。夏秋季水温整体趋势相同,高值区均出现在离岸东南海域,低值区则逐渐向东北方向移动。
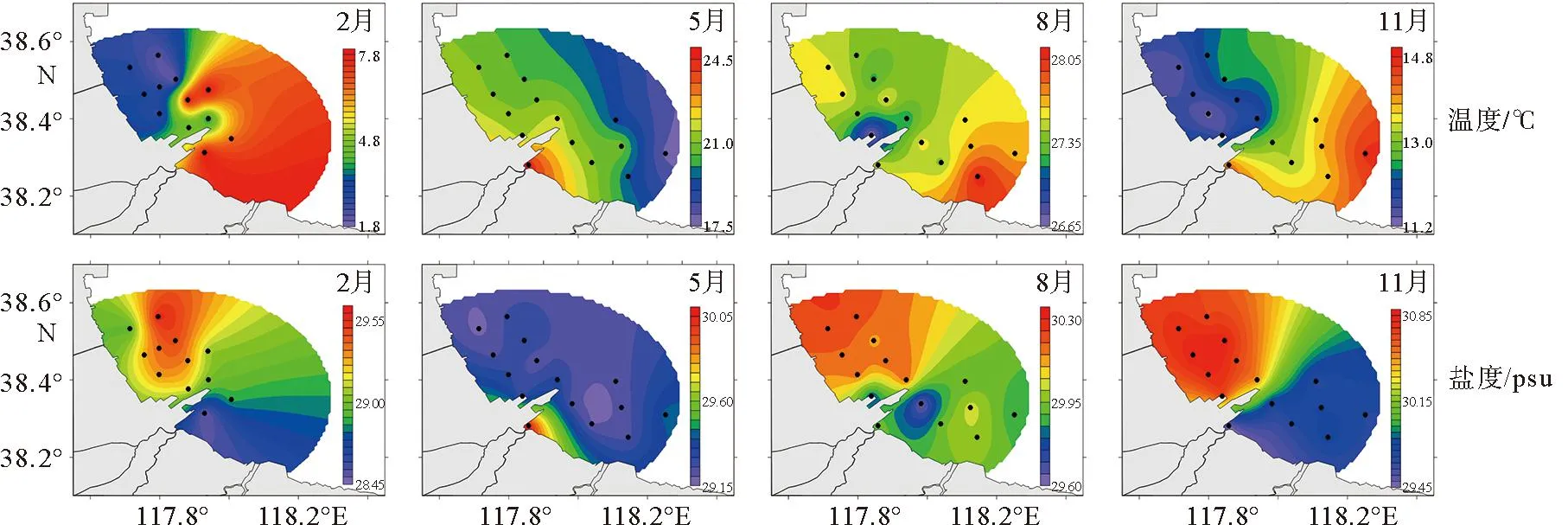
图2 黄骅港温度、盐度的时空分布特征
盐度全年波动较小,整体呈现秋季>夏季>春季>冬季的趋势,空间分布变化趋势与温度不同,夏、秋、冬三季该海域盐度均由西北-东南逐渐降低,高值区出现在南排河河口海域;春季高值区出现在大口河河口,并向四周辐射降低,其原因可能是在此期间周围盐场和养殖场将废水排放至河口海域所致,此外该海域北侧的海水淡化工程可能对盐度也有一定的影响[16]。
2.2 溶解氧和营养盐时空分布特征
2014年黄骅港海域溶解氧和营养盐时空分布详见图3,该海域DO浓度时空变化趋势为冬季最高,秋春次之,夏季最小,这可能是由于是海水DO的绝对含量受水温调控,并呈负相关关系[17]。夏、秋、冬三季该海域DO均呈现西北-东南逐渐降低的趋势,高值区位于黄骅港北侧的河北沧州海域,低值区均出现在港口附近,造成此现象的原因可能与水体污染物的增加及海域富营养化等有关[18-19]。春季DO变化趋势与夏秋冬三季相反,高值区位于套尔河河口海域。
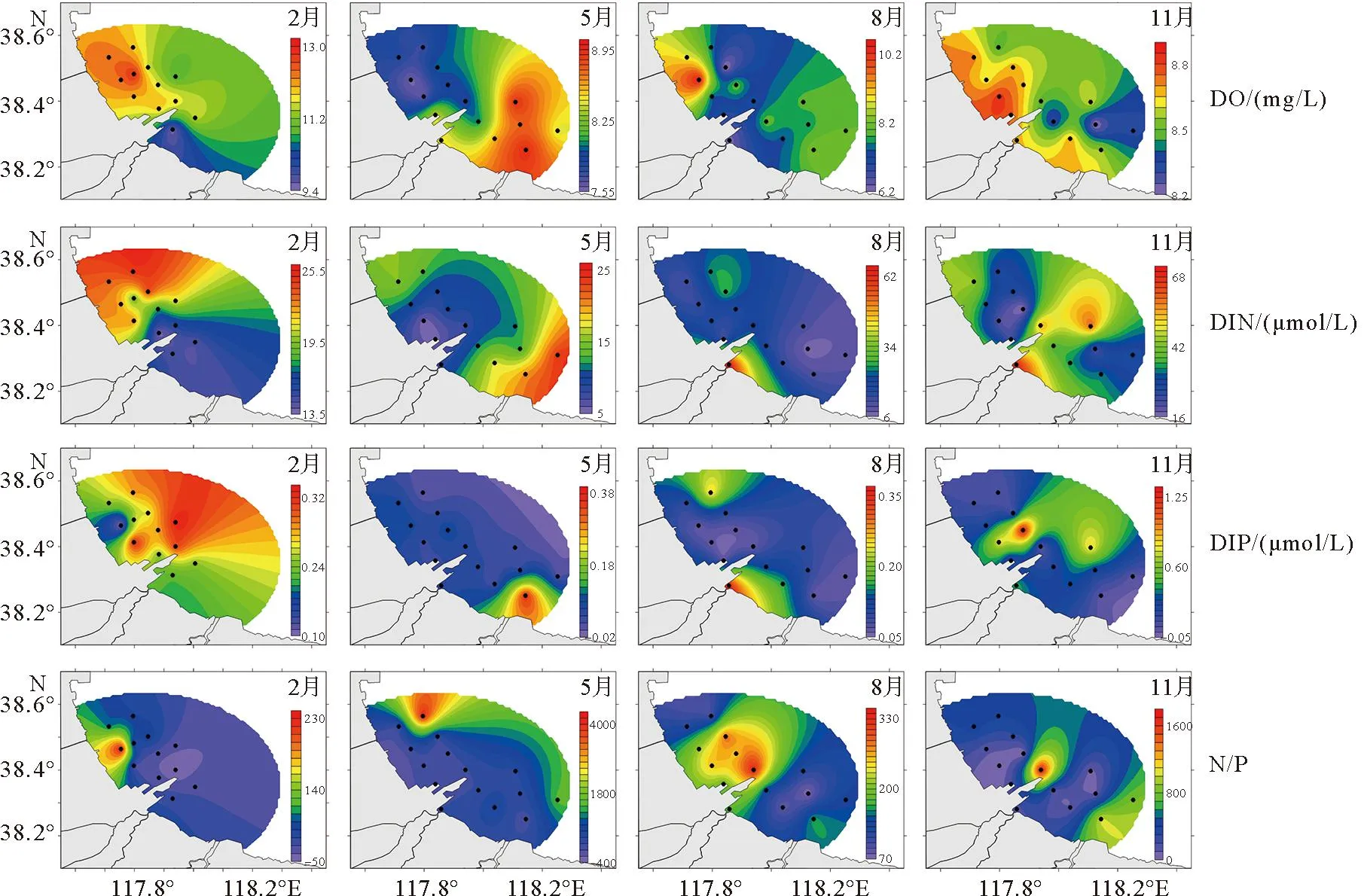
图3 黄骅港溶解氧和营养盐时空分布特征
2014年黄骅港海域可溶性无机氮(DIN,即NO2-N、NO3-N和NH4-N之和)和可溶性无机磷(DIP,即PO4-P)浓度均以秋冬季节较高,春夏较低。冬季DIN整体呈现西南-东北浓度逐渐升高的趋势,高值区出现在南排河河口;DIP则呈现由港口向外海逐渐升高的趋势,高值区出现南排河河口海域。春夏两季该海域营养盐浓度变化趋势大体一致,DIN和DIP高值区均出现在河口海域,中间的黄骅港港口航道附近为低值区。秋季该海域营养盐浓度最高,DIN高值区出现在大口河河口,DIP高值区出现在港口航道附近。综合四个航次营养盐分布规律,说明陆源排放是黄骅港海域营养盐的主要来源[20]。
浮游植物对海水中无机氮、无机磷的吸收是按Redfield比值16∶1进行的,若N/P比值<8,表现为氮限制型海水,藻类的生长受氮限制;而N/P比值>30,则表明是磷限制[21]。夏秋季节高值区位于黄骅港海域,春冬高值区则出现在港口北部海域,四个航次大面积水体N/P比远高于30,表明磷作为主要限制元素对黄骅港海域浮游植物群落结构起主要影响,这与彭士涛等[22]的研究结果相一致。不同季节N/P比差异较显著,这可能会对该海域浮游植物丰度以及群落结构造成一定的影响[23]。
2.3 Chl a时空分布特征
图4为2014年黄骅港海域Chla浓度时空变化图,其季节变化趋势为冬季>春季>夏季>秋季。春季Chla范围为0.8~12.5 mg/m3,平均浓度为2.88 mg/m3,高值区出现在港口海域,这可能与沿岸营养盐的输入有关[24]。夏季Chla的分布则呈现相对均匀的特征,Chla范围为0.86~3.84 mg/m3,平均浓度为2.04 mg/m3。夏季Chla低于春季水平,可能是由于在夏季水温较高,导致水体营养盐垂直运输减弱,又加上春季浮游植物生长繁殖过度消耗营养盐以及浮游动物摄食作用,所以夏季Chla浓度偏低[25-26]。秋冬季调查海域Chla平均浓度先略微下降再上升,冬季Chla范围为0.46~14 mg/m3,平均浓度为3.88 mg/m3;秋季Chla范围为0.06~6.91 mg/m3,平均浓度为1.78 mg/m3,最高值均出现在港口以北海域,分布趋势同浮游植物丰度基本相同,这可能是因为秋冬季营养盐含量高于春夏,水体富营养化程度较高,促进浮游植物大量繁殖,Chla也就随之升高,因此冬季调查海域Chla平均浓度最高[27]。
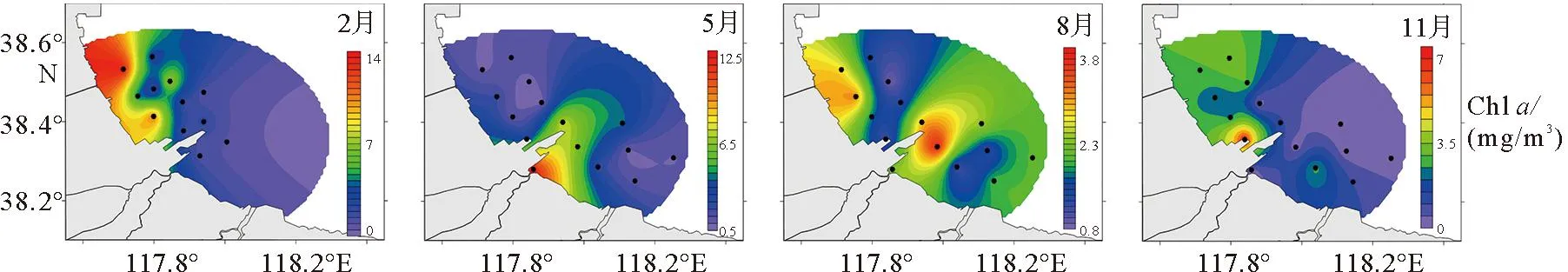
图4 黄骅港海域Chl a时空分布特征
2.4 浮游植物群落时空分布特征
2.4.1 种类组成季节变化
本次调查共鉴定出浮游植物3门32属82种,分属于硅藻、甲藻、蓝藻3个门类,其中硅藻76种,占所有物种的92.68%;甲藻仅在春夏秋少数站位发现微小原甲藻(Prorocentrumminimum)、叉状角藻(Ceratiumfurca)、三角角藻(Ceratiumtripos)、梭角藻(Ceratiumfusus)和叉形多甲藻(Peridiniumdivergens)5种,占所有物种的6.10%;而蓝藻则仅在春季发现平裂藻(Merismopediasp.)一种,占1.22%。夏季检出种类最多,为2门25属50种,秋季次之,为2门14属40种,冬季为1门18属34种,春季最低为3门14属24种。种类组成均以硅藻最多,以圆筛藻属和角毛藻属为主要类群,分别为16种、15种,这与徐玉山等[28]在渤海湾西南部的研究结果相类似。四季常见种类有刚毛根管藻(Rhizosoleniasetigera)、斯氏几内亚藻(Guinardiastriata)和细弱圆筛藻(Coscinodiscussubtilis)。
2.4.2 丰度的分布与变化
2014年黄骅港海域不同季节浮游植物丰度和空间分布存在明显差异,丰度及群落结构详见图5和图6。冬季调查海域浮游植物丰度范围为13.79×104~2 442.5×104cells/m3,平均值为695.06×104cells/m3,高值区出现在港口西北近岸区域,这与渤海湾浮游植物整体呈现近岸高于离岸的调查结果基本一致[29]。该海域氮营养盐含量较高,以对温盐耐受范围较广的广温广盐种为主[30],如尖刺拟菱形藻(Pseudo-nitzschiapungens)、鼓胀海链藻(Thalassiosiragravida)的丰度分别为128.83×104和119.08×104cells/m3。
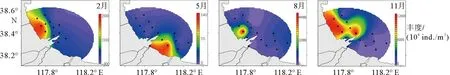
图5 黄骅港海域浮游植物丰度时空分布特征
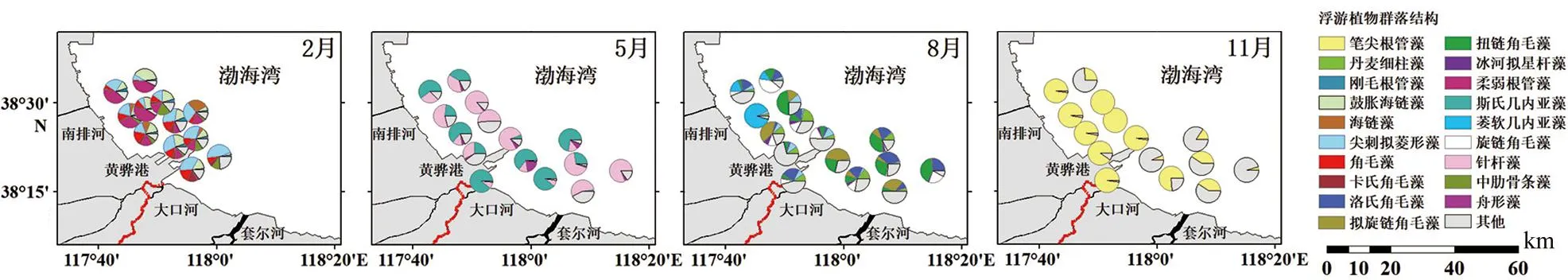
图6 黄骅港海域浮游植物群落结构的时空分布特征
春季调查海域浮游植物丰度最低,范围为1.57×104~133.4×104cells/m3,平均丰度为33.59×104cells/m3,呈现港口近岸高、离岸低的特点,高值区出现在S1、S14站位,以斯氏几内亚藻和针杆藻(Synedrasp.)为主,其丰度分别为21.66×104和8.09×104cells/m3,根据薛迪等[31]的研究,在低温高溶解氧的环境下,上述藻种易形成优势种群。
夏季调查海域浮游植物丰度最高,范围为101.5×104~47 200×104cells/m3,平均丰度为6 060.37×104cells/m3,这同杨世民等[24]的研究结果不同,这可能是因为黄骅港海域夏季温度较高,加上近岸海域入海河流、降水较多,为浮游植物的生长和繁殖提供了丰富的营养盐,导致浮游植物迅速增长[32]。8月调查海域浮游植物丰度高值区出现在港口近岸以北海域,以拟旋链角毛藻(Chaetocerospseudocurvisetus)和萎软几内亚藻(Guinardiaflaccida)为主,其丰度分别为2 313.07×104和1 606.84×104cells/m3。
秋季调查海域浮游植物丰度范围为1.81×104~12 411×104cells/m3,平均丰度为4 097.91×104cells/m3,11月调查海域浮游植物丰度高值区位于南排河河口海域,该海域盐度较高,以广温高盐种笔尖根管藻(Rhizosoleniaalata)等为主。而秋季浮游植物丰度之所以远高于夏春冬三季,主要是因为秋季该海域笔尖根管藻出现大规模爆发,个别站位如S2、S3、S4和S12等笔尖根管藻丰度甚至超过105cells/m3,此时笔尖根管藻的丰度变化即代表了秋季浮游植物丰度的变化。
浮游植物丰度组成四季终以硅藻占绝对优势,各季度均占99.00%以上。硅藻丰度季节变化趋势同浮游植物季节变化趋势相同,最高均为夏季,秋季次之,冬季、春季较低;甲藻丰度在春夏秋三季均无较大差别,冬季则未检测到甲藻;蓝藻仅在春季S12站位检测到,且丰度较低为0.25×104cells/m3。
2.4.3 优势种季节变化
2014年黄骅港海域浮游植物以优势度指数Y≥0.02为优势种,该海域优势种季节变化见表1,四季优势种均为硅藻,主要以角毛藻属、根管藻属为主,除秋季外春夏冬三季均为多种浮游植物优势种共存,秋季优势种仅笔尖根管藻一种。不同季节优势种交错程度较低,无四季优势种,仅尖刺拟菱形藻为冬季和夏季共同优势种,季节变化较显著。柳丽华等[33]认为,优势种对群落结构的稳定性有重要影响,优势种种类数目越多且优势度越小,则群落结构稳定性越好,反之稳定性越差。
2.4.4 物种多样性
Shannon-Winner多样性指数(H′)用于判断群落结构的复杂程度,均匀度指数(J′)用于判断群落是否成熟稳定[34-35]。从图7可以看出,各季节H′和J′平均值范围分别为0.91~1.95和0.40~0.73,浮游植物多样性指数和均匀度指数均较低,这主要是因为2014年浮游植物虽种类数较多,但在丰度组成上某些优势种优势度显著,这限制了其它藻类的生长和繁殖,因此多样性指数和均匀度指数较低。从全年来看,H′与呈现较为明显的季节变化。2014年冬季H′最高,高值区均位于港口海域附近;春季降到1.04,高值区逐渐向北部海域移动;夏季再次升高达到1.93,南排河河口海域附近出现低值区,整片海域H′均较高;最低值出现在秋季,高值区出现在港口东部海域,而港口附近H′较低。J′的时空变化趋势与H′相同,最低值均出现在秋季。
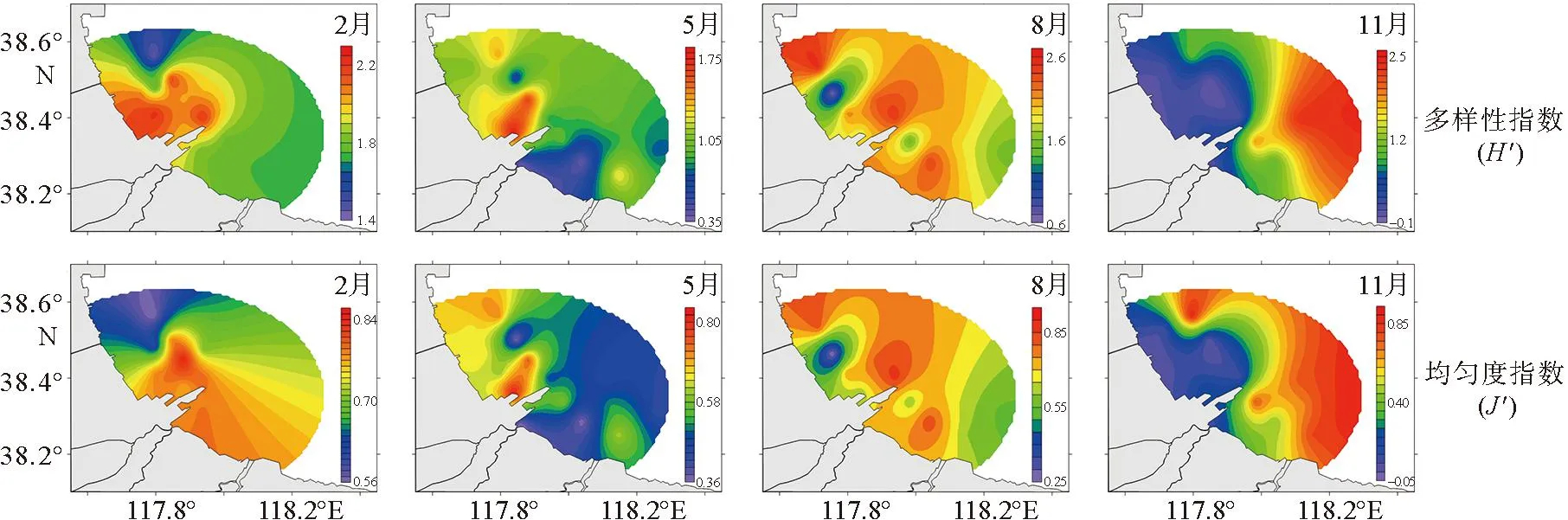
图7 黄骅港海域浮游植物多样性指数、均匀度指数季节变化
2.5 浮游植物群落结构与环境因子的排序分析
为进一步探究环境因子对黄骅港海域生态的影响,分别对春夏秋冬四个航次浮游植物进行筛选后同环境因子之间进行RDA分析,结果如图8所示,不同浮游植物对不同环境因子的反应不同是造成群落季节差异的主要原因,随着环境因子发生变化,浮游植物群落结构也相应的发生改变,进而造成其群落结构改变。图中所有浮游植物均为硅藻,因此其在排序图中的位置也比较接近。
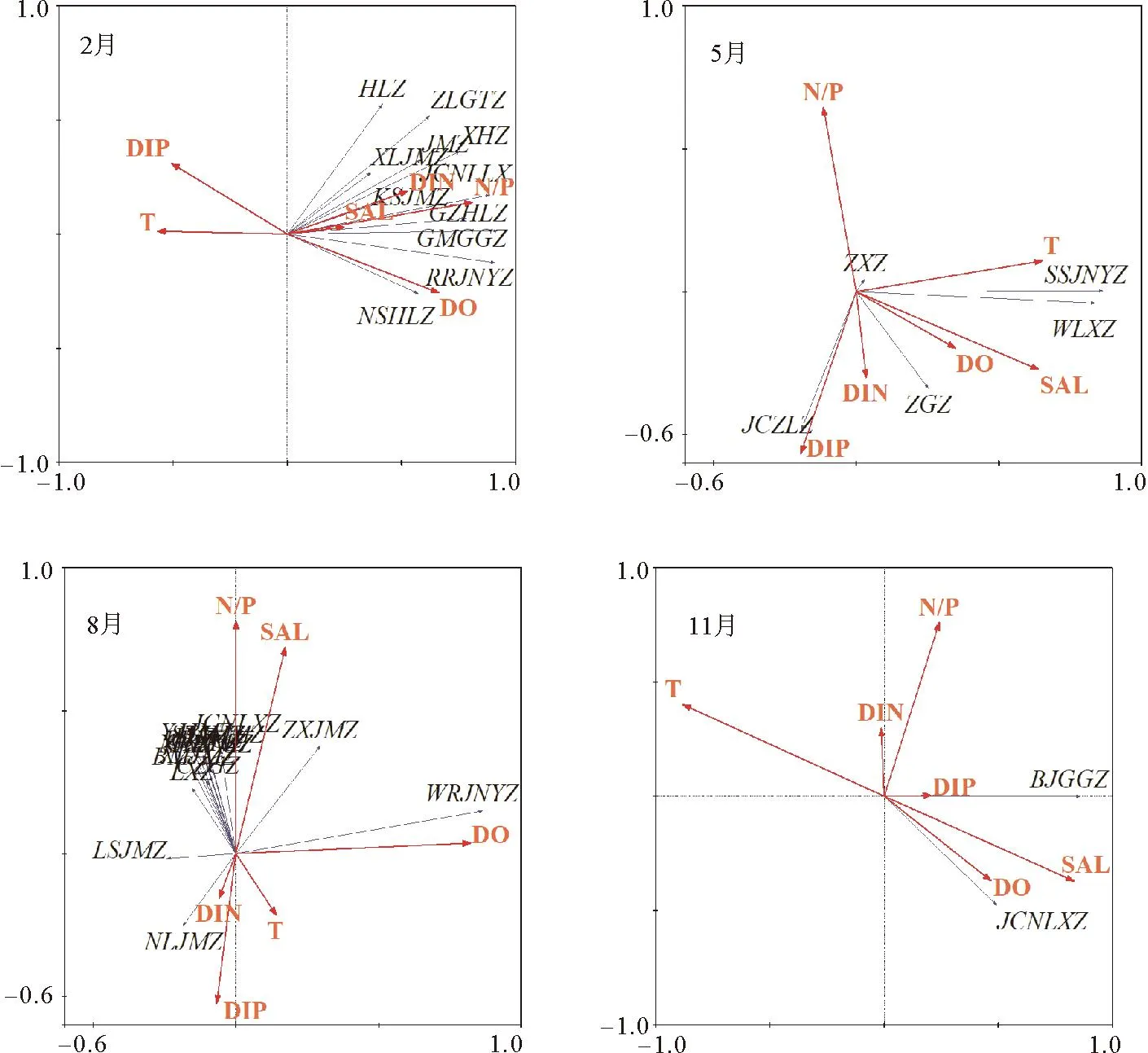
(BJGGZ:笔尖根管藻;BMJMZ:扁面角毛藻;BHNXGZ:冰河拟星杆藻;CZGZ:脆指管藻;DMJMZ:丹麦细柱藻;GMGGZ:刚毛根管藻;GZHLZ:鼓胀海链藻;HLZ:海链藻;JCNLXZ:尖刺拟菱形藻;JMZ:角毛藻;JCZLZ:具槽直链藻;KSJMZ:卡氏角毛藻;LXZ:菱形藻;LSJMZ:洛氏角毛藻;GBJMZ:冕孢角毛藻;NXLJMZ:拟旋链角毛藻;NLJMZ:扭链角毛藻;NSHLZ:诺氏海链藻;RRJNYZ:柔弱几内亚藻;STJMZ:双突角毛藻;SSJNYZ:斯氏几内亚藻;TMFGZ:透明辐杆藻;WLXZ:弯菱形藻;WRJNYZ萎软几内亚藻;XHZ:小环藻;XLJMZ:旋链角毛藻;YJJMZ:远距角毛藻;ZXJMZ:窄隙角毛藻;ZGZ:针杆藻;ZLGTZ:中肋骨条藻;ZXZ:舟形藻)
冬季第1轴和第2轴分别解释了72.2%和3.7%的物种变化。排序轴1主要受DO、DIN和盐度的影响,温度和DIP与浮游植物群落呈现明显的负相关关系。这可能是西北海域距离滨海电厂距离较远,加之沿岸流的阻隔作用,使其受温排水影响较小,水温较港口海域低,适宜硅藻生存,此外海链藻(Thalassiosirasp.)和中肋骨条藻(Skeletonemacostatum)等属于链状硅藻或群体硅藻,有利于吸收营养盐,因此浮游植物生长迅速,大量磷酸盐消耗,西北海域存在磷酸盐低值区可证实这一点[36]。
春季排序图第1轴和第2轴分别解释了72.7%和0.3%的物种变化,影响排序轴1的主要环境变量是温度和盐度,表明温度和盐度是影响黄骅港5月浮游植物组成的最重要的环境因子。斯氏几内亚藻、弯菱形藻(Nitzschiasigma)属广温广盐藻种,与温度和盐度呈现明显的正相关,在该季节内温盐的升高有益于其的生长[37]。此外,斯氏几内亚藻和舟形藻(Naviculasp.)与氮磷营养盐呈现负相关关系,针杆藻和具槽直链藻(Melosirasulcte)则与之相反,这可能是不同浮游植物对氮磷营养盐的响应不同造成的[38]。
夏季第1轴和第2轴分别解释了15.5%和8.9%的物种变化。排序轴1主要受DO的影响,排序轴2主要受盐度和N/P比的影响。该季节浮游植物群落中仅萎软几内亚藻与DO呈明显的正相关关系,此时西北海域存在一个DO高值区,浮游植物的生长和繁殖需要大量的溶解氧,因此在此期间内西北海域萎软几内亚藻优势地位显著[39]。除扭链角毛藻(Chaetocerostortissimus)和洛氏角毛藻(Chaetoceroslorenzianus)外其他浮游植物均与DIN和DIP呈明显的负相关关系,表现为DIP浓度下降,DIN浓度则略有升高,分析原因除与DIP作为主要限制因素参与浮游植物的生长繁殖外,还可能与港口航道等海洋工程所引起的营养盐变化有关[40]。
秋季第1轴和第2轴分别解释了73.7%和0%的物种变化。秋季该海域笔尖根管藻占据了绝对优势地位,尖刺拟菱形藻仅占该季节浮游植物总丰度的1.10%。笔尖根管藻属外洋广温高盐藻种,是近海赤潮种类之一,影响其的环境变量主要是盐度和DO,且与温度有极强的负相关关系。在港口运营时期笔尖根管藻通过依附于外来船舶从大洋进入黄骅港海域,秋季生长环境适宜,DO和盐度的升高也会促进笔尖根管藻大规模生长,进而占据绝对优势地位[41]。
3 结论
(1)2014年黄骅港海域温盐时空差异较显著,滨海电厂温排水的排放以及周边盐场和养殖场的废水等是引起这一变化的原因之一。溶解氧冬季浓度最高,秋春次之,夏季最小。氮磷营养盐浓度秋冬高,春夏低,四个航次大面积水体N/P比远高于30,表明磷酸盐是该海域限制浮游植物群落结构的重要因素之一。
(2)本次调查共鉴定出浮游植物3门32属82种,种类季节分布趋势和丰度季节变化趋势相同,均为夏季>秋季>冬季>春季,种类组成以硅藻为主,甲藻和蓝藻较少,表明硅藻在黄骅港海域占据优势地位。浮游植物群落结构季节演替明显,优势种除秋季外均为多种硅藻,秋季优势种笔尖根管藻在港口运营时期通过依附于外来船舶进入黄骅港海域,因环境适宜大规模生长进而占据绝对优势地位。
(3)2014年黄骅港海域浮游植物丰度和Chla季节变化较大,季节变化是引起此种变化的主要原因。随着环境因子发生变化,浮游植物群落结构也相应的发生改变,进而造成其群落结构改变。冬季影响浮游植物群落时空变化的主要因素是溶解氧、温度和磷酸盐,春季则是温度和盐度,夏季转变为溶解氧、盐度和磷酸盐,秋季盐度、温度和溶解氧为主要影响因素。

