菲律宾蛤仔血细胞吞噬作用的功能分析
刘 静,翟 冰,徐 涛,黄小丽,刘 栋,胡发文*
(1.青岛农业大学 分析测试中心,山东 青岛,266109;2.山东省海洋科学研究院,山东 青岛 266104;3.青岛市浅海底栖渔业增殖重点实验室,山东 青岛 266104)
引 言
双壳贝类的免疫系统无免疫球蛋白,属非特异性免疫,其免疫系统主要由血细胞免疫和体液免疫两部分组成,其中血细胞不仅可以通过吞噬、凝集和包囊等作用清除异物,进行伤口和外壳修复、营养消化和运输,还可以向血淋巴释放免疫因子,如溶菌酶、活性氧、抗菌肽等参与机体的免疫防御系统[1-4]。因此,血细胞既是贝类细胞免疫的承担者,也是体液免疫的提供者,在免疫防御中发挥着核心作用[5]。
菲律宾蛤仔隶属于双壳纲(Bivalvia)、帘蛤科(Veneridae)、蛤仔属(Ruditapes),是我国海水养殖中较为重要的经济贝类。菲律宾蛤仔的细胞免疫是免疫防御的第一道防线,主要靠血细胞的吞噬作用来完成[6],因此对血细胞吞噬的研究是探讨贝类免疫防御机制的必要条件和重要基础。目前关于菲律宾蛤仔血细胞吞噬功能的研究还较少[5, 7-8],并且在研究贝类血细胞吞噬功能时,吞噬物选择荧光微球[5, 8-9]和酵母菌较多[7, 10-11],尚未见有关菲律宾蛤仔对鳗弧菌、大肠杆菌、金黄色葡萄球菌吞噬作用的报道,鳗弧菌是贝类的致病菌,大肠杆菌是革兰氏阴性菌的代表,金黄色葡萄球菌是革兰氏阳性菌的代表,故本文利用光镜和电镜相结合的技术研究了菲律宾蛤仔血细胞对三种菌的吞噬率、吞噬细菌的过程及血细胞吞噬菌后的超微结构变化,同时利用扫描电镜和透射电镜研究了三种菌的形态结构,为分析菲律宾蛤仔对三种菌吞噬作用的差异提供理论依据,研究结果将为菲律宾蛤仔细胞免疫的后续研究提供基础数据。
1 材料与方法
1.1 试验材料
菲律宾蛤仔购自青岛城阳水产品批发市场,壳长(4±0.32)cm,壳高(2.70±0.14)cm,体质量(10.8±2.41)g。买回的实验蛤仔暂养于塑料水箱中,水温保持在16 ℃左右,每天早晚各换新鲜海水1次,暂养3 d后进行试验。
1.2 试验方法
1.2.1 实验菌株的准备
大肠杆菌、金黄色葡萄球菌、鳗弧菌来自青岛农业大学分析测试中心。鳗弧菌用LB固体培养基培养,大肠杆菌和金黄色葡萄球菌用营养琼脂培养基培养。将培养好的菌体用无菌磷酸缓冲液PBS(NaCl 28 g/L、KH2PO40.2 g/L、KCl 0.2 g/L、Na2HPO412H2O 2.9 g/L,pH=7.4)从培养基上分离下来,并用PBS将菌悬液的浓度调整为108个/mL。一部分菌液用来研究血细胞的吞噬作用,另一部分菌液利用扫描电镜和透射电镜观察三种菌的形貌结构。
1.2.2 血细胞的抽取与制备
选取健康有活力的菲律宾蛤仔,无菌海水冲洗干净后,用滤纸擦干菲律宾蛤仔,用1 mL的无菌注射器预先吸入一定量预冷无菌抗凝剂(葡萄糖20.8 g/L、EDTA 5.845 g/L、NaCl 20 g/L、Tris-HCl 0.05 mol/L,pH=7.4)[12],再从菲律宾蛤仔闭壳肌处1∶1抽取血淋巴,每个试验组抽取4只菲律宾蛤仔的血淋巴,迅速混匀,采用无菌PBS缓冲液(pH = 7.4)调整血细胞浓度为106个/mL。
1.2.3 瑞士—吉姆萨染色法观察菲律宾蛤仔血细胞的吞噬作用
将血细胞悬液与大肠杆菌、金黄色葡萄球菌、鳗弧菌悬液等比例加到无菌的离心管中,置于湿盒中室温孵育30 min,移至冰上静止15 min,终止血细胞的吞噬作用。取50 μL菲律宾蛤仔血细胞和细菌的混合液置于载玻片上,制成血涂片,室温干燥2 min,甲醇固定3 min,滴加瑞式—姬姆萨染液2~3滴覆盖整个血涂片,染1 min,滴加等量的0.01 M磷酸缓冲液(pH 6.4~6.8)分色5 min,之后用中性水冲洗载玻片,待血涂片干燥后,在光学显微镜(Leica DM500)下随机观察100个血细胞,每种菌的吞噬实验设置3个平行组,每个平行组制作2张血涂片,血细胞的吞噬率按照下列公式计算:
吞噬率(%)=吞噬细菌的血细胞/观察的血细胞×100%
1.2.4 三种菌扫描电镜观察
将上述制备的菌液,3 000 r/min离心(4 ℃)10 min,弃上清液,加2.5%的戊二醛4 ℃冰箱过夜,将固定后的菌液滴到8 mm圆形载玻片上,4 ℃下自然沉淀1 h,将盖玻片分别放置于体积分数为60%、70%、80%、90%、100%的乙醇溶液中梯度脱水10 min,叔丁醇:乙醇1:1脱水10 min,纯叔丁醇脱水两次,每次10 min,然后放于-20 ℃冰箱中30 min,最后真空干燥3 h,离子溅射仪喷金后,扫描电镜(日本电子7500F)下观察细菌形态。
1.2.5 三种菌透射电镜观察
将上述制备的菌液,3 000 r/min离心(4℃)10 min,弃上清液,菌液沉淀加入2.5%的戊二醛4 ℃冰箱固定过夜,0.1 M二甲胂酸钠缓冲液清洗6次,每次15 min,1%的锇酸固定2 h,0.1 M的二甲胂酸钠缓冲液清洗3次后,进行乙醇梯度脱水,Spi-pon812环氧树脂渗透、包埋和聚合,超薄切片机(Leica UC7)切成70 nm的薄片,经醋酸双氧铀和柠檬酸铅染色后,透射电镜(日立HT7700)下观察并拍照,加速电压80 kV。
1.2.6 透射电镜观察菲律宾蛤仔血细胞的吞噬作用
将血细胞悬液与大肠杆菌、金黄色葡萄球菌、鳗弧菌悬液等比例加到无菌的离心管中,置于湿盒中室温孵育30 min,3 000 r/min离心10 min,去掉上清液后,加入1 mL醛类固定液(2%多聚甲醛—2.5%戊二醛,2% NaCl,2 mmol/L CaCl2, pH=7.4),室温下固定2 h,后续透射电镜制样步骤与观察同1.2.5。
1.3 数据处理与分析
血细胞吞噬率以平均值±标准差表示,使用SPSS 20.0软件,并采用单因素方差分析(ANOVA)和Duncan检验法进行统计分析,以P<0.05作为显著差异性水平。
2 结果与分析
2.1 菲律宾蛤仔血细胞对大肠杆菌、金黄色葡萄球菌和鳗弧菌的吞噬作用
实验结果表明菲律宾蛤仔血细胞对三种细菌均具有吞噬作用,其中血细胞对大肠杆菌的吞噬率最高(38.7%),其次为金黄色葡萄球菌(30%),对鳗弧菌的吞噬率最低(24.4%);并且菲律宾蛤仔血细胞对三种菌的吞噬率具有显著性差异(P<0.05)(图1)。
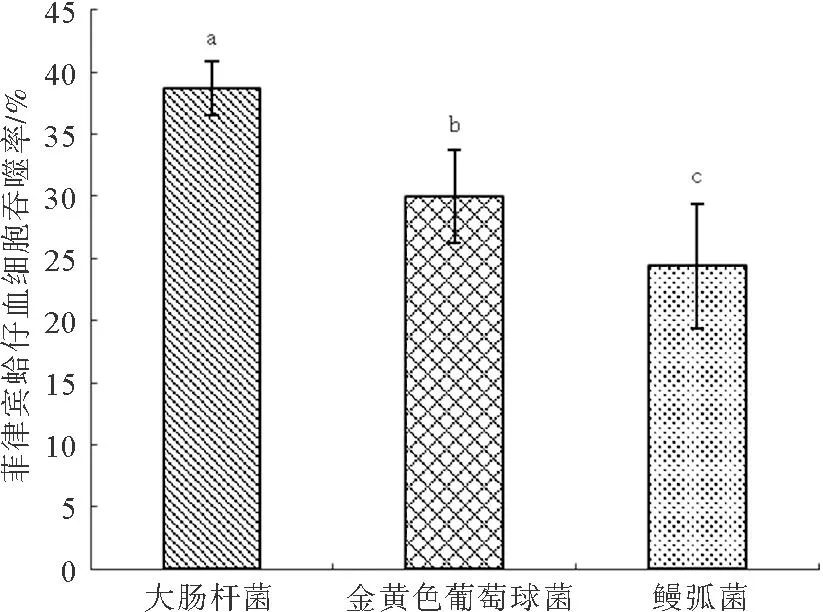
图1 菲律宾蛤仔血细胞对大肠杆菌、金黄色葡萄球菌和鳗弧菌的吞噬率
2.2 扫描电镜和透射电镜观察大肠杆菌、鳗弧菌和金黄色葡萄球菌形态结构
扫描电镜下可见大肠杆菌呈杆状,两端呈钝圆形,表面不光滑,长为1.0~2.4 μm,宽0.5~0.7 μm,平均1.6×0.6 μm(图2 a);鳗弧菌呈弧状,有一根细长的极生单鞭毛,菌体长1.0~2.1 μm,宽0.5~1.1 μm,鞭毛直径27.2~37.6 nm,长可达3.5~5.7 μm, 菌体平均1.3×0.7 μm,鞭毛平均4.5 μm(图2b);金黄色葡萄球菌表面光滑、圆润,呈球状,直径0.8~1.3 μm,菌体间界限分明,排列呈葡萄串状,菌体平均1.3×1.1 μm(图2c)。
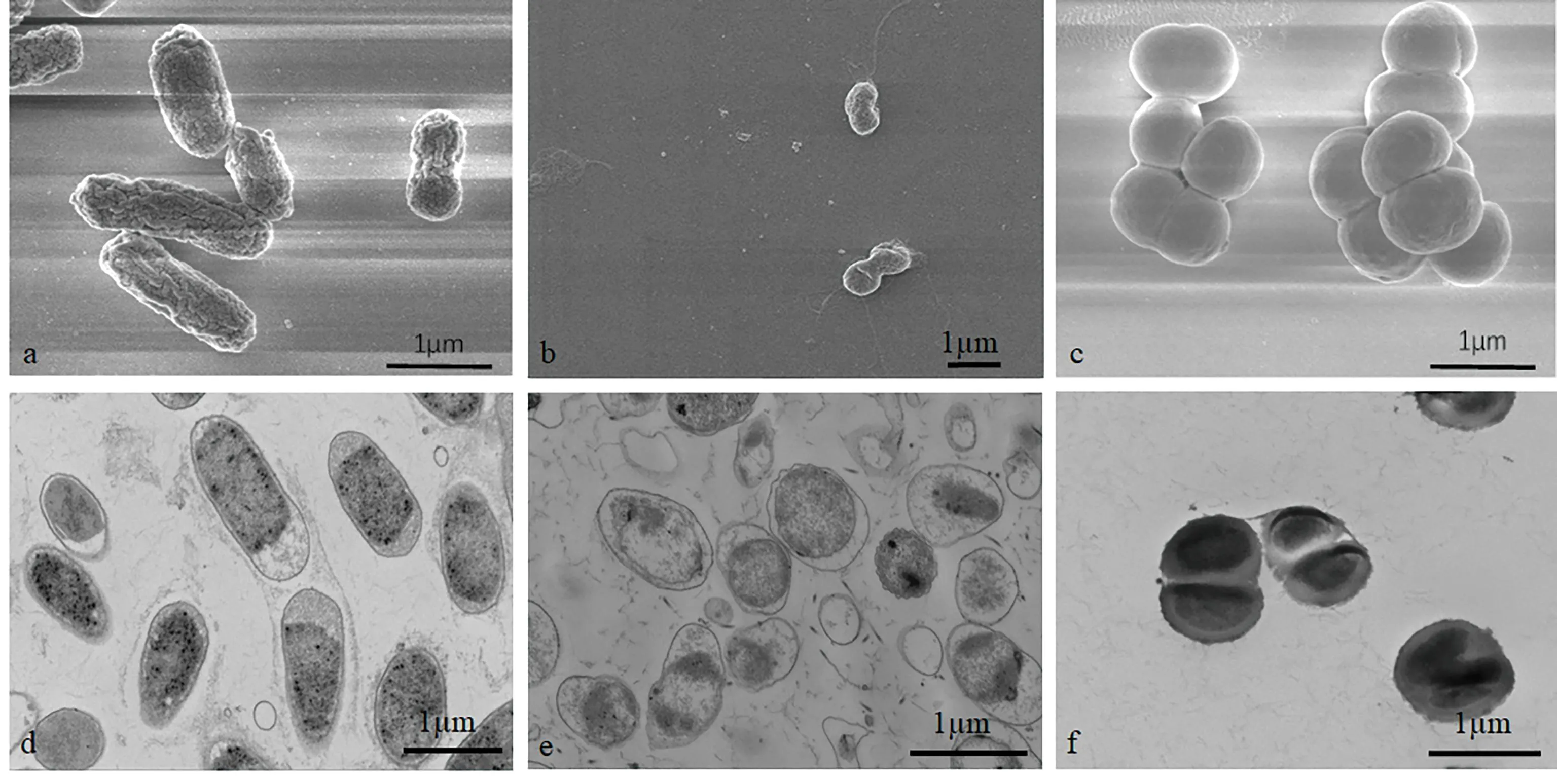
图2 扫描电镜和透射电镜下大肠杆菌、鳗弧菌和金黄色葡萄球菌形貌结构
透射电镜下,由于超薄切片切割角度不同,大肠杆菌呈现出杆状、椭圆或圆形的切面,细胞壁厚度适中(图2d);鳗弧菌切面呈弧状、椭圆状或圆状,细胞壁较薄,拟核明显,在超薄切片中能看到被切断的鞭毛(图2e),金黄色葡萄球菌菌体细胞壁较厚,菌体饱满,边缘清晰,单个或团聚存在(图2f)。
2.3 透射电镜观察菲律宾蛤仔血细胞对大肠杆菌的吞噬作用
在某些特定环境下,细胞表面会生出一些无定型细胞质凸起,呈现丝状或片状,分别称之为丝状伪足和片状伪足,细胞可随伪足伸出的方向移动,或以伪足为触手,接触并粘附外源物[13]。
透射电镜下观察菲律宾蛤仔对大肠杆菌的吞噬作用,实验结果发现血细胞完整,细胞质丰富,一个血细胞中可发现一个或多个被吞噬的大肠杆菌;血细胞可以伸出丝状伪足粘附、包裹大肠杆菌(图3a-c),血细胞伸出的一根丝状伪足上可以粘附、包裹一个大肠杆菌(图3a),也可以粘附、包裹多个大肠杆菌(图3b),一个血细胞可以同时伸出多条丝状伪足粘附大肠杆菌(图3c);血细胞还可以伸出片状伪足进行粘附和包裹(图3d-e),血细胞伸出的片状伪足可以包裹一个大肠杆菌(图3d),也可以同时包裹多个大肠杆菌(图3e);图3f显示了大肠杆菌被细胞吞噬的过程,e4为刚被血细胞粘附的大肠杆菌,e5为被血细胞吞噬一半的大肠杆菌,e6为被血细胞完全吞噬的大肠杆菌;被吞噬的大肠杆菌可被血细胞消化,图3a和3e中e7为被血细胞消化的大肠杆菌残体。

图3 透射电镜下观察菲律宾蛤仔血细胞对大肠杆菌的吞噬作用
2.4 透射电镜观察菲律宾蛤仔血细胞对金黄色葡萄球菌的吞噬作用
透射电镜下观察菲律宾蛤仔对金黄色葡萄球菌的吞噬作用,实验结果发现血细胞完整,细胞质丰富,一个血细胞中可发现一个或多个被吞噬的金黄色葡萄球菌;一个细胞可以伸出多根丝状伪足粘附、包裹金黄色葡萄球菌(图4a),一根丝状伪足上可以粘附、包裹多个金黄色葡萄球菌(图4b);血细胞还可以伸出片状伪足(图4c,s4)或者血细胞膜直接粘附金黄色葡萄球菌(图4c,s3);被丝状伪足、片状伪足粘附或直接粘附在血细胞膜上的金黄色葡萄球菌逐渐会被吞噬到细胞内,s5为尚未完全被血细胞吞噬的金黄色葡萄球菌(图4d),s6-s8为被血细胞完全吞噬的金黄色葡萄球菌,s6为刚进入血细胞,尚未和溶酶体结合的细菌(图4e),s7为被溶酶体融合但尚未消化的细菌(图4e,4f),s8为被血细胞消化的金黄色葡萄球菌残体(图4f)。
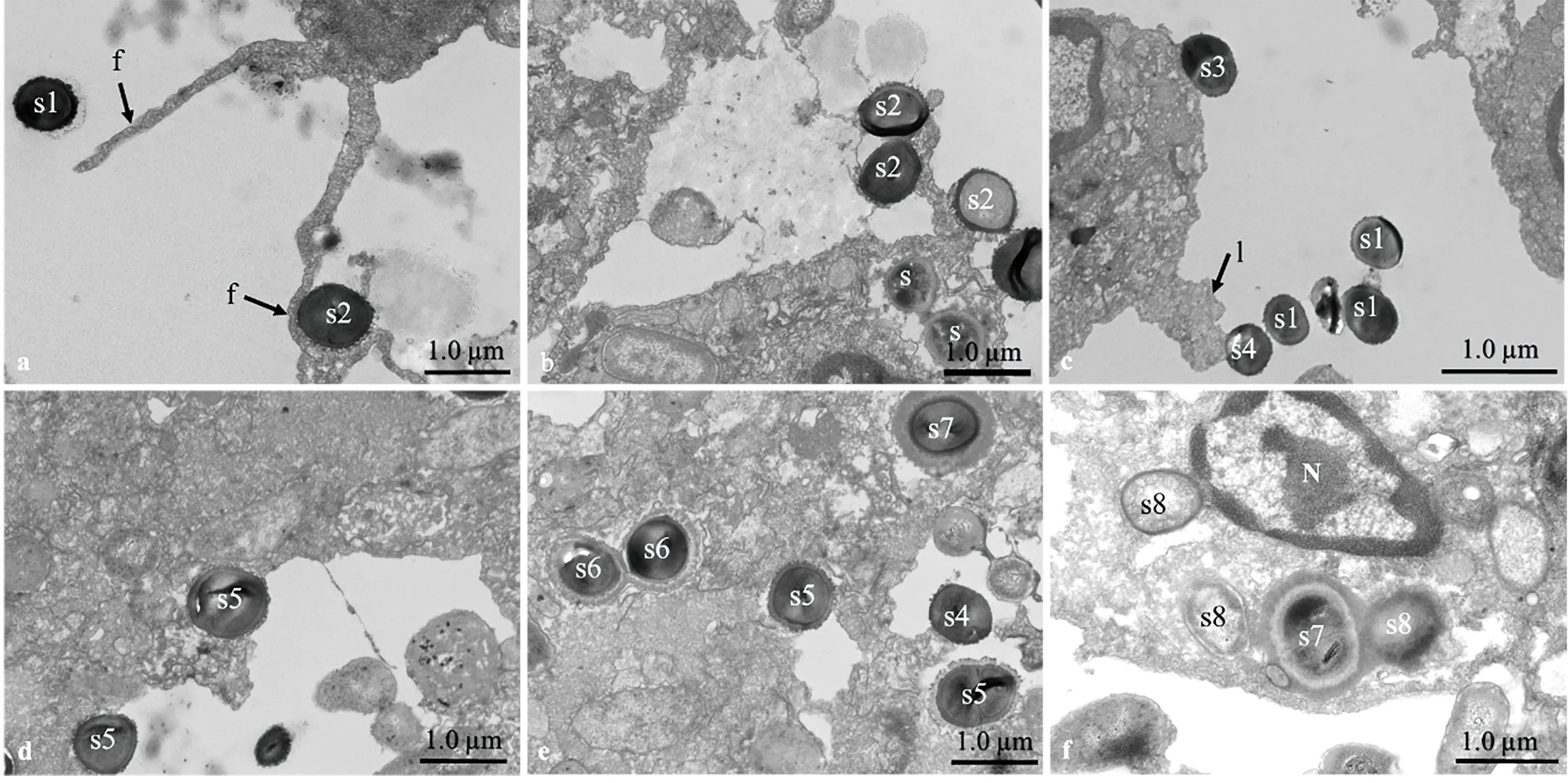
图4 透射电镜下观察菲律宾蛤仔血细胞对金黄色葡萄球菌的吞噬作用
2.5 透射电镜观察菲律宾蛤仔血细胞对鳗弧菌吞噬作用
透射电镜下观察菲律宾蛤仔对鳗弧菌的吞噬作用,实验结果发现血细胞和鳗弧菌孵育后,血细胞变得细长,细胞质基质丢失严重,细胞空白化(图5a);血细胞可以伸出丝状伪足粘附鳗弧菌,血细胞细胞核染色体凝集边聚化,细胞内形成自噬体,胞内高尔基体部分消融,变得模糊不清(图5b);透射电镜下较难找到吞噬了鳗弧菌的血细胞,吞噬鳗弧菌的血细胞同样出现细胞核染色质边聚化,细胞空白化现象(图5c);有的血细胞细胞膜已经出现破裂(图5d),甚至完全破裂解体(图5e),解体的血细胞残体中含有大量杯状自噬体和包裹了细胞器的自噬体(图5f)。
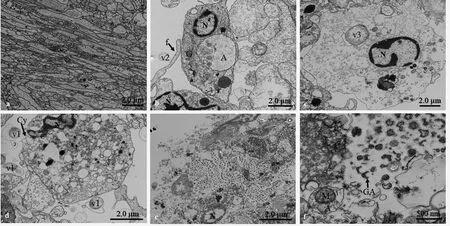
图5 透射电镜下观察菲律宾蛤仔血细胞对鳗弧菌的吞噬作用
3 讨论
3.1 菲律宾蛤仔血细胞对大肠杆菌、金黄色葡萄球菌和鳗弧菌吞噬率的差异性
贝类血细胞的吞噬作用是一种重要的免疫防御机制,血细胞能吞噬入侵机体的异物和病原体,还能清除自身损伤或死亡的细胞[7],故血细胞吞噬率是衡量机体健康状况及在环境或病原胁迫下的免疫防御能力的一个重要指标,在贝类免疫系统中扮演着极其重要的角色[8, 11, 14-17]。
研究发现不同贝类血细胞的吞噬率存在差异,同种贝类血细胞的吞噬率也不尽相同,如韩卓然等[18]发现毛蚶(Scapharcasubcrenata)血细胞对酵母聚糖的吞噬率跟孵育温度有关系,李进寿等[19]发现杂色鲍(Haliotisdiversicolor)血细胞的吞噬率与血细胞和吞噬物的比例有关。本文发现菲律宾蛤仔血细胞对三种菌的最大吞噬率仅为38.7%,而在相同孵育条件下,菲律宾蛤仔对1 μm荧光微球的吞噬率可达45.1%[5],作者推测相同贝类血细胞吞噬率的差异可能跟吞噬物的种类、大小以及孵育条件有关。
大肠杆菌、鳗弧菌属于革兰氏阴性菌,金黄色葡萄球菌属于革兰氏阳性菌,本文发现菲律宾蛤仔血细胞对这三种菌均有吞噬能力,说明菲律宾蛤仔血细胞对革兰氏阴性和阳性细菌均有吞噬能力,这与孙虎山等[20]发现栉孔扇贝血细胞对革兰氏阴性和阳性细菌均有吞噬能力的结论类似。菲律宾蛤仔血细胞对三种菌的吞噬能力表现为大肠杆菌>金黄色葡萄球菌>鳗弧菌,作者认为可能有以下原因:1)虽然金黄色葡萄球菌和鳗弧菌的平均菌体大小小于大肠杆菌,但大肠杆菌不易聚集,一般以单个菌体出现,而金黄色葡萄球菌往往多个菌体聚在一起呈葡萄状,大大增加了菌体体积,而鳗弧菌有长达5.7 μm的鞭毛,导致血细胞吞噬金黄色葡萄球菌和鳗弧菌相对大肠杆菌困难;2)鳗弧菌是贝类的致病菌[21-22],透射电镜下发现,菲律宾蛤仔血细胞吞噬大肠杆菌和金黄色葡萄球菌后,超微结构无明显损伤,但吞噬鳗弧菌后,血细胞超微结构发生明显损伤,细胞发生凋亡、细胞膜破裂或者血细胞直接解体,这导致血细胞的免疫功能大大下降,这也是导致血细胞对鳗弧菌的吞噬作用小于大肠杆菌和金黄色葡萄球菌的一个重要原因。
目前鳗弧菌的致病机理尚不完全清楚,但研究发现鳗弧菌的毒力与其外膜蛋白,胞外产物(如溶血素,蛋白酶)以及鞭毛上的鞭丝蛋白基因等相关[23]。鳗弧菌对贝类的致病机理研究较少,刘小莉等[24]研究发现鳗弧菌能引起菲律宾蛤仔组织的低渗胁迫,这也可能是本研究中鳗弧菌导致血细胞凋亡、膜破裂或解体的原因,其具体的损伤机制还需要进一步研究。
3.2 菲律宾蛤仔血细胞对大肠杆菌、金黄色葡萄球菌和鳗弧菌的吞噬过程
贝类血细胞的吞噬作用涉及复杂的细胞行为及多种生化反应,血细胞吞噬过程包括趋化、粘附、内吞和降解消化几个重要步骤[25]。Schmid等[26]发现了田螺(Viviparusmalleatus)血细胞可以被金黄色葡萄球菌以及细菌胞壁物质N-乙酰葡糖胺吸引,朱泽闻等[27]发现泥蚶(Tegillarcagranosa)血细胞对酵母聚糖和细菌有较强粘附能力,本文透射电镜下也发现菲律宾蛤仔血细胞对三种菌均具有趋化、粘附作用,血细胞主要通过伸出丝状伪足和片状伪足对细菌进行包裹,血细胞可以伸出一根或多根丝状伪足,一根丝状伪足可以对一个或多个细菌进行粘附、包裹,血细胞伸出的片状伪足也可以对一个或多个细菌进行粘附、包裹,丝状伪足或片状伪足相接触后细胞膜融合,形成吞噬小体进入细胞;血细胞除了伸出伪足外,还可以局部细胞质膜内陷形成内吞小体,将细菌吞噬到血细胞内,Cajaraville等[28]亦发现贻贝(Mytilusgalloprovincialis)血细胞可以由局部细胞质膜内陷形成有衣被或无衣被的内吞小体,从而完成内吞。
病原体被血细胞吞噬后,一方面细胞内的水解酶可与病原体融合,逐步将其水解消化,也可以通过伴随吞噬作用的呼吸爆发产生的多种活性氧中间体来杀伤病原微生物[29],作者在透射电镜下亦观察到菲律宾蛤仔血细胞中存在大量被吞噬的大肠杆菌、金黄色葡萄球菌以及被消化的残体。
4 结论
综上所述,菲律宾蛤仔血细胞对革兰氏阴性和阳性细菌均具有吞噬能力,血细胞可以通过丝状伪足、片状伪足或细胞膜内陷的方式对细菌进行粘附、内吞;伴随着水解酶的参与以及活性氧的产生共同杀伤、消灭吞噬到血细胞中的细菌。菲律宾蛤仔血细胞对三种菌的吞噬能力的差异跟三种细菌的大小、易聚集程度、致病性有关系,关于鳗弧菌对血细胞超微结构损伤及其致凋亡、致死的机制需要进一步研究。

