夫西地酸对分枝杆菌的体外抑菌效果评价
程梦丽 姜广路 霍凤敏 薛毅 于霞
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染引起的一种慢性传染病,严重威胁着全人类的生命健康[1]。MTB的不断进化导致了耐药菌株的产生,随着耐多药和广泛耐药菌株的出现和不断增多,对结核病的诊治工作带来巨大挑战。非结核分枝杆菌(nontuberculous mycobacteria,NTM)病是指人体感染了NTM,并引起相关组织脏器的病变[2-3]。根据NTM的生长速度,将其分为快速生长型分枝杆菌(rapidly growing mycobacteria,RGM)和缓慢生长型分枝杆菌(slowly growing mycobacteria,SGM)。近年来,NTM病呈快速增多趋势,分离率高达22.9%(2010年),而东南沿海地区甚至可超过30%[4],已成为威胁人类健康的重要公共卫生问题之一[5-7]。由于绝大多数NTM菌种对常用抗结核药物天然耐药,导致NTM病的治疗面临着极大挑战。耐药结核病及NTM病的天然耐药是目前分枝杆菌病治疗的两大难题。新的抗菌药物的研发及传统药物的发现极其复杂、费力、昂贵和耗时,而药物再利用无疑是一种高效的替代策略。
夫西地酸(fusidic acid,FA)对革兰阳性菌具有抗菌活性,早在1962年被用于抗菌治疗[8],最常用于葡萄球菌感染。FA是一种具有类固醇样结构的化合物,与β-内酰胺类和氨基糖苷类抗菌药物不同,它可在人体内广泛代谢和具有高度的亲脂性,与蛋白质的结合性强(95%~97%),具有良好的组织渗透性,半衰期长达5 h,单次口服给药500 mg,血清水平可达到(28.7±7.1) mg/L,反复给药后可高达80~100 mg/L,并渗透到巨噬细胞等细胞中[9]。这对治疗胞内细菌(如分枝杆菌)的感染至关重要。有病例报道FA对治疗MTB感染有明显的效果[10-12],可能可以作为分枝杆菌感染治疗的候选药物。本研究的主要目的是评价FA对MTB和NTM标准菌株及其临床分离株的体外抑菌活性,为临床应用FA治疗MTB和NTM感染提供依据。
材料和方法
1.菌株来源:(1)临床分离株:收集首都医科大学附属北京胸科医院2017年1月至2018年12月分离得到的MTB药物敏感株26株、耐多药(multidrug-resistant,MDR)MTB菌株29株、广泛耐药(extensive drug-resistant,XDR)MTB菌株30株、鸟分枝杆菌分离株23株和戈登分枝杆菌分离株21株。(2)标准菌株:45株分枝杆菌标准菌株(包括26株RGM和19株SGM)购自美国典型菌种保藏中心(ATCC)或德国微生物菌种保藏中心(DSM)。所有分枝杆菌标准菌株和临床分离株均为首都医科大学附属北京胸科医院菌株库保存。所有NTM临床分离株均通过对硝基苯甲酸生长试验,经16S rRNA、hsp65、rpoB和16S~23S rRNA序列测定和比对,鉴定至菌种水平[13]。
2.最低抑菌浓度(minimum inhibitory concentration,MIC)测定:将FA(购自美国Sigma公司)溶于二甲基亚砜,存储浓度为2 mg/ml,-80 ℃保存待用。参照美国临床和实验室标准化协会的指南进行肉汤稀释法药物敏感性试验(简称“药敏试验”)[14]。SGM和RGM的药敏试验分别采用含有OADC(油酸、白蛋白、葡萄糖、过氧化氢酶)和不含有OADC的Mueller Hinton(MH)肉汤培养基,MTB的药敏试验采用含有OADC的7H9培养基。用MH肉汤培养基或7H9培养基将FA进行2倍倍比稀释,浓度范围是0.0625~64 μg/ml。将细菌接种于罗氏培养基,待生长至对数期,将细菌接种至96孔微孔板,细菌载量为每孔1×105菌落形成单位/100 μl,置于37 ℃温箱孵育。3 d和7 d后,每孔加入20 μl 阿尔玛蓝(Alamar Blue)和50 μl吐温80(5%)的混合液,37 ℃温箱孵育24 h后,分别对RGM和SGM进行显色评价,即:液体由蓝色变成粉色或紫色表明细菌生长。MIC50、MIC90、MIC99分别是抑制50%、90%、99%受试菌生长的最低药物浓度。有研究报道,分枝杆菌对FA耐药的临界值是16 μg/ml[9,12,15-17],本研究将MIC≤16 μg/ml的菌株定义为FA敏感株。
结 果
1.FA对分枝杆菌标准菌株的MIC分布:(1)FA对RGM标准菌株的MIC分布:FA对RGM表现出较强的抑菌活性(表1)。在26株RGM标准菌株中,FA对20株菌株的MIC≤16 μg/ml,其中,MIC≤2 μg/ml、≤1 μg/ml和≤0.5 μg/ml的菌株数分别是13、11和8株;MIC≤2 μg/ml的菌株占50.0%(13/26)。FA对浅黄分枝菌酸杆形菌和杜氏分枝菌酸杆形菌的抑菌活性最强(MIC=0.125 μg/ml),对猪分枝杆菌和美容品分枝菌酸杆形菌的抑菌活性最差(MIC>64 μg/ml)。(2)FA对SGM标准菌株的MIC分布:FA对SGM表现出较强的抑菌活性(表2)。在19株SGM标准菌株中,FA对15株菌株的MIC≤16 μg/ml,其中,MIC≤2 μg/ml的菌株是MTB(H37Ra)、戈登分枝杆菌和MTB非洲变种,占15.8%(3/19)。FA对胞内分枝杆菌、次要分枝菌酸小杆菌、隐蔽分枝杆菌和副瘰疬分枝杆菌的抑菌活性较差(MIC=32 μg/ml)。
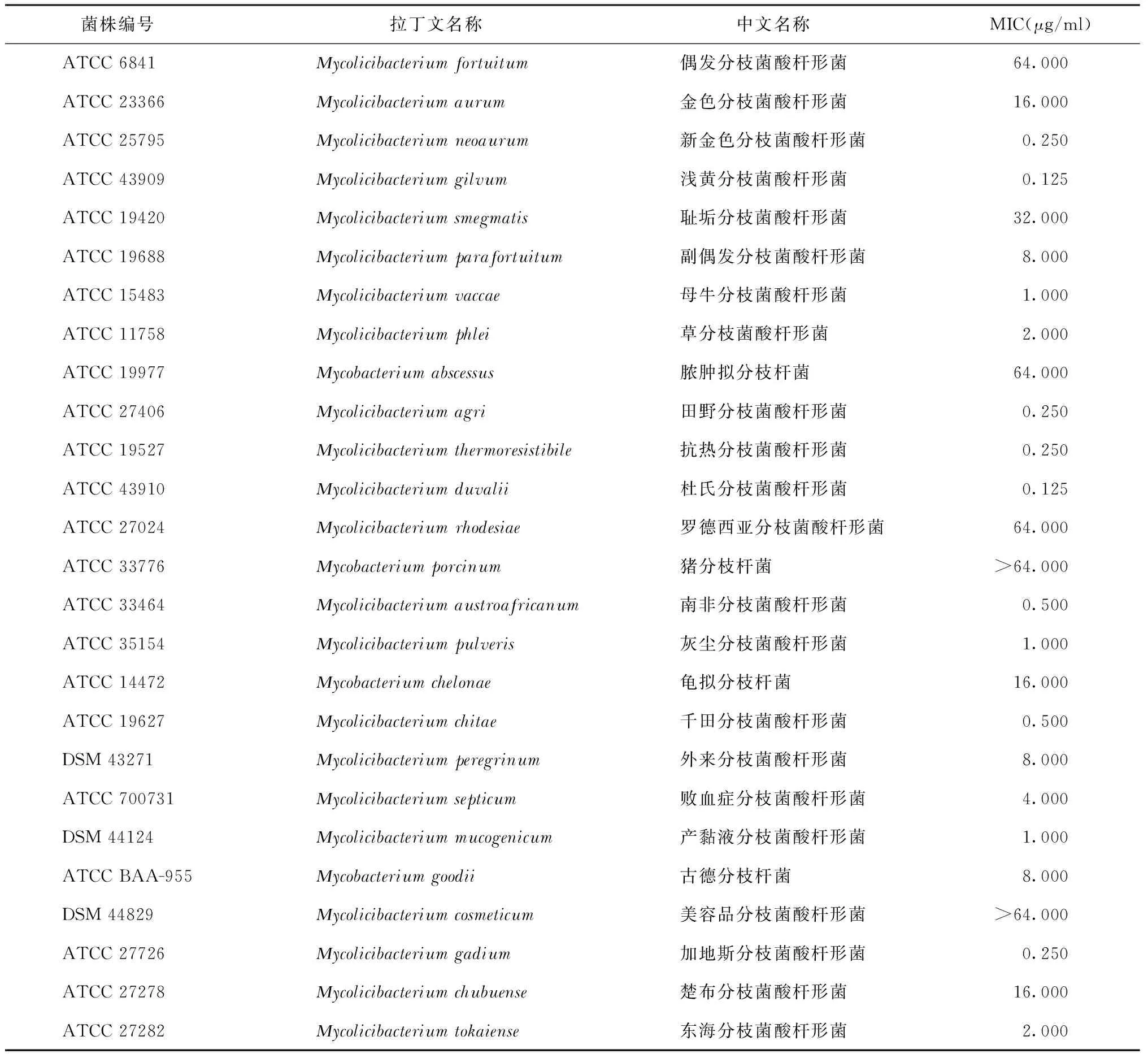
表1 夫西地酸对26株快速生长型分枝杆菌标准菌株的最低抑菌浓度

表2 夫西地酸对19株缓慢生长型分枝杆菌标准菌株的最低抑菌浓度
总体来看,FA对分枝杆菌标准菌株具有较好的抑菌效果,菌株耐药率为22.2%(10/45),其中,MIC≤2 μg/ml的菌株占35.6%(16/45)。FA对RGM和SGM具有相似的抑菌效果,菌株耐药率分别为23.1%(6/26)和21.1%(4/19)。
2.FA对分枝杆菌临床分离株的体外抑菌效果:(1)FA对MTB临床分离株的体外抑菌效果:评价FA对85株MTB临床分离株的抑菌活性,结果显示,FA对26株药物敏感临床分离株均具有很强的抑菌活性(MIC≤4 μg/ml),其中,16株菌株的MIC≤2 μg/ml。FA对药物敏感菌株的MIC50、MIC90、MIC99分别是2、10、10 μg/ml。在29株MDR-MTB临床分离株中,FA也均具有很强的抑菌活性(MIC≤16 μg/ml),其中有4株菌株的MIC≤2 μg/ml。FA对MDR-MTB临床分离株的MIC50、MIC90、MIC99分别是4、16、16 μg/ml。在30株 XDR-MTB临床分离株中,FA也表现出较强的抑菌活性,对27株菌株的MIC≤16 μg/ml,其中有2株菌株的MIC≤2 μg/ml,其余3株的MIC分别是32、32、>32 μg/ml,耐药率为10.0%(3/30)。FA对XDR-MTB临床分离株的MIC50、MIC90、MIC99分别是8、16、>32 μg/ml。在总体85株MTB临床分离株中,FA的MIC50、MIC90、MIC99分别是4、16、>32 μg/ml,菌株耐药率为3.5%(3/85)。(2)FA对NTM临床分离株的体外抑菌效果:在23株鸟分枝杆菌临床分离株中,FA对19株菌株的MIC≤16 μg/ml,其中有9株菌株的MIC≤2 μg/ml;其余4株菌株的MIC值分别为32、32、>32、>32 μg/ml,耐药率为17.4%(4/23)。FA对鸟分枝杆菌的MIC50、MIC90、MIC99分别为8、32、>32 μg/ml。在21株戈登分枝杆菌临床分离株中,FA对19株菌株的MIC≤16 μg/ml,且这19株菌株的MIC均≤2 μg/ml;其余2株菌株的MIC均>32 μg/ml,耐药率为9.5%(2/21)。FA对戈登分枝杆菌的MIC50、MIC90、MIC99分别为1、2、>32 μg/ml。在总体44株NTM临床分离株中,FA的MIC50、MIC90、MIC99分别为2、32、>32 μg/ml。
总体来看,FA对分枝杆菌临床分离株有较强的抑菌活性,菌株耐药率为7.0%(9/129),其MIC50、MIC90、MIC99分别为4、16、>32 μg/ml。
讨 论
耐药结核病及NTM病的天然耐药是临床诊治中的难点问题,迫切需要新的抗分枝杆菌感染药物的研发。研究发现,FA对MTB菌株具有较好的抑菌效果[10-12]。目前,关于分枝杆菌对FA敏感性的体内外研究数据有限。Van Caekenberghe[12]采用体外琼脂比例法对64株MTB菌株进行了测定,发现FA的MIC为16 mg/L。Fuursted等[16]采用BACTEC法对40株MTB菌株进行了测定,结果显示,其MIC50和MIC90均为16 mg/L,其对MTB牛变种菌株的MIC50和MIC90分别为16和32 mg/L。此外,Hoffner等[17]也采用BACTEC法对30株MTB菌株进行了测定, FA除对3株菌株的MIC为64 mg/L外,对其余菌株的MIC均低于32 mg/L。基于以上研究数据,本研究将MIC≤16 μg/ml的菌株定义为FA敏感株。
本研究通过药敏试验MIC值的测定系统评价了FA对分枝杆菌的体外抑菌活性,主要发现:(1)FA 对分枝杆菌标准菌株具有较强的抑菌活性,菌株耐药率为22.2%,其中RGM和SGM菌株的耐药率分别为23.1%和21.1%;(2)FA对MTB临床分离株具有很强的抑菌活性,菌株耐药率为3.5%,其中MTB药物敏感株、MDR-MTB和XDR-MTB菌株的耐药率分别为0、0、10.0%;(3)FA对NTM临床分离株具有较强的抑菌活性,其中鸟分枝杆菌和戈登分枝杆菌的耐药率分别为17.4%和9.5%;(4)FA对分枝杆菌临床分离株有较强的抑菌活性,菌株耐药率为7.0%,其MIC50、MIC90、MIC99值分别为4、16、>32 μg/ml,可为将来FA耐药值的设定提供依据。
本研究首次较为全面地评价了FA对分枝杆菌标准菌株的MIC值分布情况。FA对分枝杆菌标准菌株具有较好的抑菌效果,对RGM和SGM具有相似的抑菌效果;进一步分析发现,FA对RGM菌株中MIC≤2 μg/ml菌株的比例为50.0%,在SGM菌株中仅占15.8%,表明FA对RGM呈现出更强的抑菌活性。值得注意的是,猪分枝杆菌和美容品分枝菌酸杆形菌对FA可能耐药(MIC>64 μg/ml)。
FA对MTB临床分离株具有很好的抑菌效果。本研究中,MTB临床分离株对FA的耐药率为3.5%,与Cicek-Saydam等[15]报道一致,在其研究中,MTB临床分离株对FA的耐药率为1.8%(3/170)。本研究中,MTB临床分离药物敏感株对FA的耐药率为0,与Cicek-Saydam等[15]的报道结果也一致(2.0%,3/151)。此外,本研究中,MDR-MTB临床分离株对FA的耐药率为0,与Cicek-Saydam等[15]的研究结果一致。目前,FA对XDR-MTB临床分离株的体外抑菌情况尚无相关报道。本研究发现,FA对XDR-MTB临床分离株表现出很强的抑菌活性,耐药率为10.0%,这无疑为XDR-TB的治疗提供了新的希望。
NTM对大多数抗菌药物天然耐药是临床治疗的痛点问题。本研究发现,FA对鸟分枝杆菌和戈登分枝杆菌具有较好的抑菌效果,菌株耐药率分别为17.4%和9.5%。目前,FA对NTM抑菌活性的研究较少,且不同菌种间的抑菌活性差别很大。Hoffner等[17]发现鸟分枝杆菌复合群对浓度高达64 mg/L的FA高度耐药,耐药率高达94.1%(16/17),这与笔者研究结果不一致,可能是由于本研究中使用的是鉴定至菌种水平的鸟分枝杆菌,而Hoffner等使用的是鸟分枝杆菌复合群。Fuursted等[16]发现FA对MTB牛变种临床分离株具有很好的抑菌效果,耐药率为0(0/10)。在本研究中,FA对MTB牛变种标准菌株的MIC为4 μg/ml,与Fuursted等的研究结果也较为一致。Witzig等[18]发现尽管FA对堪萨斯分枝杆菌的MIC值为32 μg/ml,但所有菌株(19株)的MIC值均低于一次口服FA 500 mg后可接受的最大血清浓度(33 μg/ml)。目前,FA对戈登分枝杆菌临床分离株的体外抑菌情况尚无相关报道。此外,Hoffner等[17]发现尽管鸟分枝杆菌复合群对高浓度FA高度耐药,但是当FA与乙胺丁醇联用时,17株菌株中有11株有增效作用,其中5株菌株对FA(64 mg/L)和乙胺丁醇(4 mg/L)的组合完全敏感,表明FA作为治疗分枝杆菌感染的潜在补充药物值得深入研究。
综上所述,本研究发现FA对分枝杆菌具有很好的抑菌效果。同时,笔者建议在更大的样本量中进一步评价FA对分枝杆菌的抑菌活性及其与其他抗结核药物的联合抗菌效果,尤其是对广泛耐药和天然耐药的分枝杆菌菌株抑菌效果的研究,将来可首先在免疫缺陷的重症分枝杆菌感染患者中进行临床治疗尝试和临床试验。
利益冲突所有作者均声明不存在利益冲突
作者贡献程梦丽:酝酿和设计实验、实施研究、采集数据、分析/解释数据、起草文章、统计分析;姜广路:采集数据、分析/解释数据、对文章的知识性内容作批评性审阅、指导、支持性贡献;霍凤敏:实施研究、采集数据、对文章的知识性内容作批评性审阅、支持性贡献;薛毅:采集数据、对文章的知识性内容作批评性审阅、支持性贡献;于霞:酝酿和设计实验、对文章的知识性内容作批评性审阅、获取研究经费、指导

