误诊为嗜酸性肉芽肿性多血管炎的鸟分枝杆菌复合群肺病一例
高瑞月 王政 安立
非结核分枝杆菌(nontuberculous mycobacteria, NTM)是指除结核分枝杆菌复合群和麻风分枝杆菌以外的所有分枝杆菌,迄今已鉴定190余种[1]。由于其表面富含脂质外膜,自然界中无处不在。鸟-胞内分枝杆菌复合群(Mycobacteriumavium-intracellularcomplex, MAC)是NTM肺病中最常见的菌种之一[2],常罹患于有基础肺疾病或免疫抑制的人群。其影像学特征主要包括纤维空洞型和结节性支气管扩张型[3]。通常,宿主主要通过辅助性T细胞1(Th1)型免疫反应清除NTM感染[4-5],而Th2型炎性介质很可能会抑制宿主的抗分枝杆菌反应,导致持续性的NTM感染[6]。但当临床发生Th2型免疫反应,出现嗜酸性粒细胞和免疫球蛋白IgE均升高时,常会考虑过敏性疾病或嗜酸性粒细胞肺疾病等非感染性疾病,导致结核分枝杆菌或NTM感染疾病的误诊或漏诊。现笔者报道1例临床表现符合嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis, EGPA),即发热、嗜酸性粒细胞升高、周围神经病变、鼻窦炎、气道高反应、肾功能不全,但经组织病理特殊染色联合NTM基因检测及分型诊断为MAC肺病的患者,进一步加强临床对NTM肺病,尤其是MAC肺病的认识。
临床资料
患者,女性,57岁。因“咳嗽、咳痰3个月余,发热1个月余,肺部阴影范围逐渐增大”,于2021年3月24日入住北京朝阳医院呼吸与危重症医学科。患者既往有高血压病史,6年前因肺栓塞行溶栓治疗,口服华法林6个月后停用,长期口服阿司匹林(0.1 g/次,1次/d)抗血小板治疗。9个月前诊断为慢性肾小球肾炎,强的松治疗3个月,2020年12月开始泼尼松(40 mg/次,1次/d,每2周减5 mg)治疗,于2021年2月减停,期间联合尿毒清和利尿剂治疗。
患者3个月前无明显诱因出现咳嗽、咳痰,白痰为主,量多,易咳出,后出现发热,体温最高39.7 ℃,以夜间发热为主,伴气短、盗汗、食欲下降、全身乏力,间断恶心、呕吐,于2021年2月20日就诊于北京中医药大学东直门医院。血常规示嗜酸性粒细胞升高(13.1%;参考值0.4%~8%),C反应蛋白(CRP)升高(1.85 mg/L;参考值0~0.8 mg/L);胸部CT扫描示左肺下叶渗出影,考虑肺炎,予莫西沙星(0.4 g/次,1次/d)抗感染治疗3 d,体温未见明显下降,仍夜间发热,体温波动于37.2~39.7 ℃之间,遂加用头孢唑肟(2 g/次,2次/d)治疗,体温峰值和咳嗽均较前有所缓解。26日患者再次发热至38 ℃,复查血常规示白细胞计数、嗜酸性粒细胞(23%)和CRP(2.08 mg/L)均明显较前升高;痰细菌、真菌涂片、抗酸染色均阴性;期间间断高热,考虑感染控制欠佳,于3月4日调整抗生素为美罗培南(0.5 g/次,2次/d),复查CT示左肺下叶斑片影较前范围扩大,且局部机化,考虑不除外侵袭性肺曲霉菌病,加用伏立康唑(200 mg/次,2次/d)经验性抗真菌治疗,夜间体温仍波动于38~39 ℃。5日患者主动要求出院,至首都医科大学附属北京友谊医院通州院区继续治疗。因持续高热,考虑耐药革兰阳性球菌感染,先后予万古霉素联合美罗培南、伏立康唑、利奈唑胺、氟康唑等药物抗细菌及真菌治疗,仍间断高热,13日复查胸部CT示左下肺实变影较前范围增大,提示病情进展,为进一步排除肿瘤性病变,与家属协商后于20日完善正电子发射断层显像/X线计算机体层成像检查(PET-CT),结果显示肺部实变影为炎性病变且未提示大血管病变,21日患者主动要求出院,就诊于我院。
入院体格检查:体温36.4 ℃,脉搏79次/min,呼吸频率20次/min,血压140/73 mmHg(1 mmHg=0.133 kPa);患者神志清楚,全身皮肤瘙痒,双下肢及颜面部水肿;左肺下叶闻及湿性啰音,余未见异常。入院后完善血常规:除血红蛋白[58.00 g/L(参考值115~150 g/L)]明显降低、CD4(375个/μl)和CD8 T细胞计数(124个/μl)均明显低于正常限值(410~1120个/μl和240~880个/μl)、脑钠肽(BNP)[469 pg/ml(0~100 pg/ml)]明显升高外,其他指标均未检出异常。生化检测:白蛋白[31.8 g/L(40.0~55.0 g/L)]明显降低,肌酐[384.1 μmol/L(41.0~73.0 μmol/L)]明显升高;过敏原总IgE检测为 89.6 kU/L(参考值<60 kU/L),弓型虫抗体IgM阴性,寄生虫(镜检)未见;EB病毒DNA定量<5.0×102IU/ml,巨细胞病毒DNA定量<5.0×102copies/ml;肌钙蛋白、肌酸激酶同工酶均处于正常范围内;自身抗体十二项、抗核抗体、抗dsDNA抗体、抗蛋白酶3抗体、抗髓过氧化物酶抗体均为阴性。血降钙素原、1,3-β-D葡聚糖试验(G实验)、半乳甘露聚糖(GM)试验均在正常参考值内,痰细菌、真菌、GeneXpert MTB/RIF及TB-RNA检测均为阴性。
基于患者治疗史及入院体格检查,初步诊断为发热原因待查,肺部感染性疾病待排(肺结核?肺曲霉病?肺炎?),嗜酸性粒细胞升高(继发?原发?),嗜酸性粒细胞肺疾病待除外,重度贫血,心功能不全?肾功能不全,肺栓塞病史。予莫西沙星(0.4 g/次,1次/d)抗感染治疗,期间患者仍间断低热,但热峰较前下降,于3月31日复查胸部CT,可见左肺下叶不规则实变,肺动脉干增宽、下腔静脉增宽、左心房增大,间质性肺水肿,双侧胸腔积液,心包积液,纵隔及双侧肺门区多发肿大淋巴结(图1~5)。同时,估算的肾小球滤过率(eGFR)为11 ml·min-1·(1.73 m2)-1[参考值:80~120 ml·min-1·(1.73 m2)-1],明显降低,遂请肾内科会诊,考虑慢性肾功能不全Ⅴ期、肾性贫血,存在替代肾脏治疗指征,予以临时肾脏替代治疗并间断输血。4月1日行右侧胸腔穿刺术,胸腔积液检测结果:乳酸脱氢酶38 U/L,总蛋白19 g/L,腺苷脱氨酶(ADA)3 U/L,符合漏出液,不支持结核性胸腔积液。4月2日完善气管镜检查,可见左肺各叶段支气管开口通畅,黏膜光滑,局部轻度充血水肿(图6~9)。于左下叶基底背段行支气管肺泡灌洗液(BALF)刷片,结果显示细菌、真菌、GeneXpert MTB/RIF检测均为阴性,BALF 半乳甘露聚糖试验(GM试验) 0.55 ng/ml(参考值为0.5 ng/ml);4月4日完善支气管黏膜活检,可见左肺下叶支气管黏膜组织部分上皮脱失,残存上皮细胞未见异型性,间质少量淋巴细胞浸润。BALF高通量测序(NGS)回报肺炎链球菌170(序列数)、人类疱疹病毒4型11910(序列数)、人类疱疹病毒5型CMV16(序列数),考虑为上呼吸道定植。4月6日复查肺动脉增强CT,未见明显肺栓塞,左肺下叶实变较前有缩小趋势,但吸收不明显(图10~14)。于4月8日予阿昔洛韦口服(0.2 g/次,5次/d)抗病毒治疗7 d,体温仍控制欠佳,14日调整为静脉滴注哌拉西林钠他唑巴坦钠(4.5 g/次,2次/d)抗感染治疗6 d,期间体温再次出现高热。 遂进一步完善骨髓穿刺术,示嗜酸性粒细胞升高,结合先前的鼻窦CT扫描提示双侧上颌窦、双侧筛窦轻度炎症(图15);气道激发试验示气道高反应(图16)。肌电图符合周围神经病变;且结合血液、BALF病原学检测均为阴性,考虑非感染性疾病EGPA可能性大。为进一步明确诊断,行超声引导下穿刺留取肺组织病理检查(图17),并予以甲强龙(80 mg/次,1次/d,静脉滴注)治疗4 d,后序贯甲泼尼龙(40 mg/次,1次/d)口服治疗,未再发热,于4月19日出院。
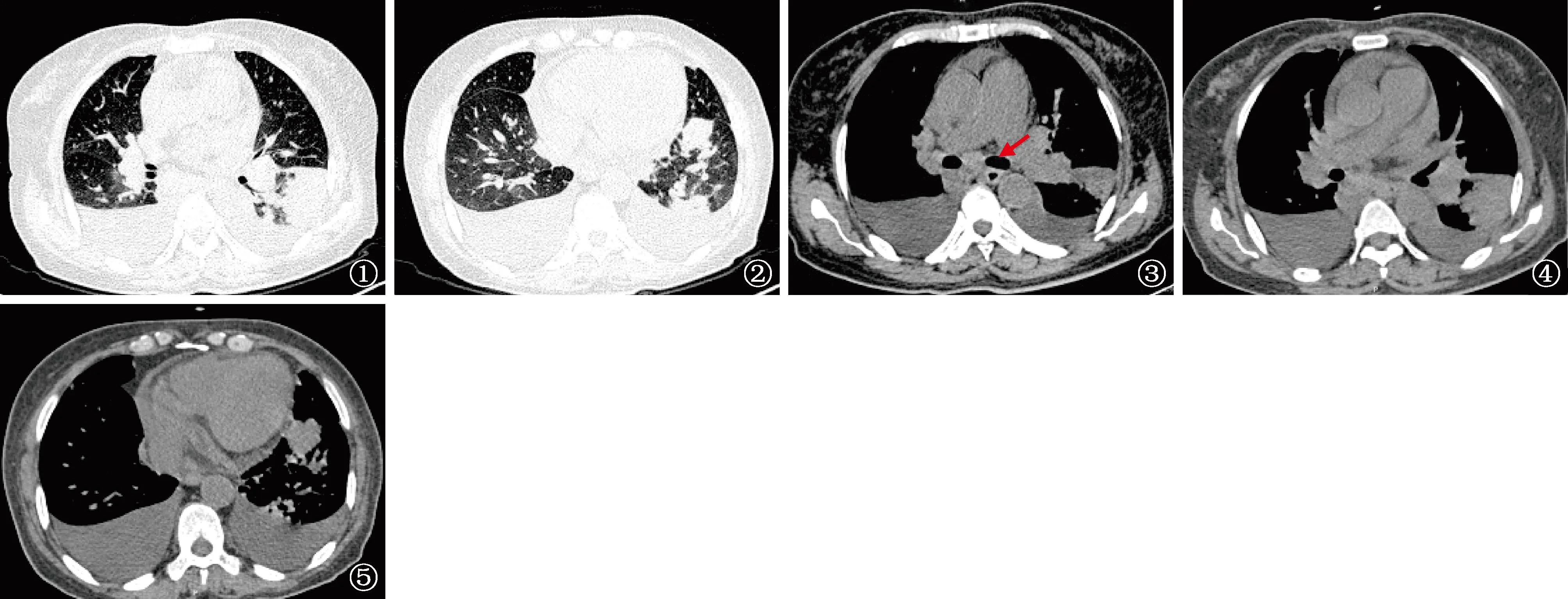
图1~5 患者,女,57岁,鸟-胞内分枝杆菌复合群肺病。胸部CT扫描(2021年3月31日)。图1、2为肺窗,可见左下肺多发结节,双侧胸腔积液;图3为胸部纵隔窗,可见纵隔淋巴结肿大(箭头所示);图4、5为纵隔窗,可见少量心包积液,左下肺实变影,伴有支气管扩张,双侧胸腔积液

图6~9 同一患者。气管镜检查(2021年4月2日)。可见左肺支气管黏膜炎性改变,以左上叶为著。从左至右依次为隆突、左主支气管、左上叶支气管、左下叶支气管
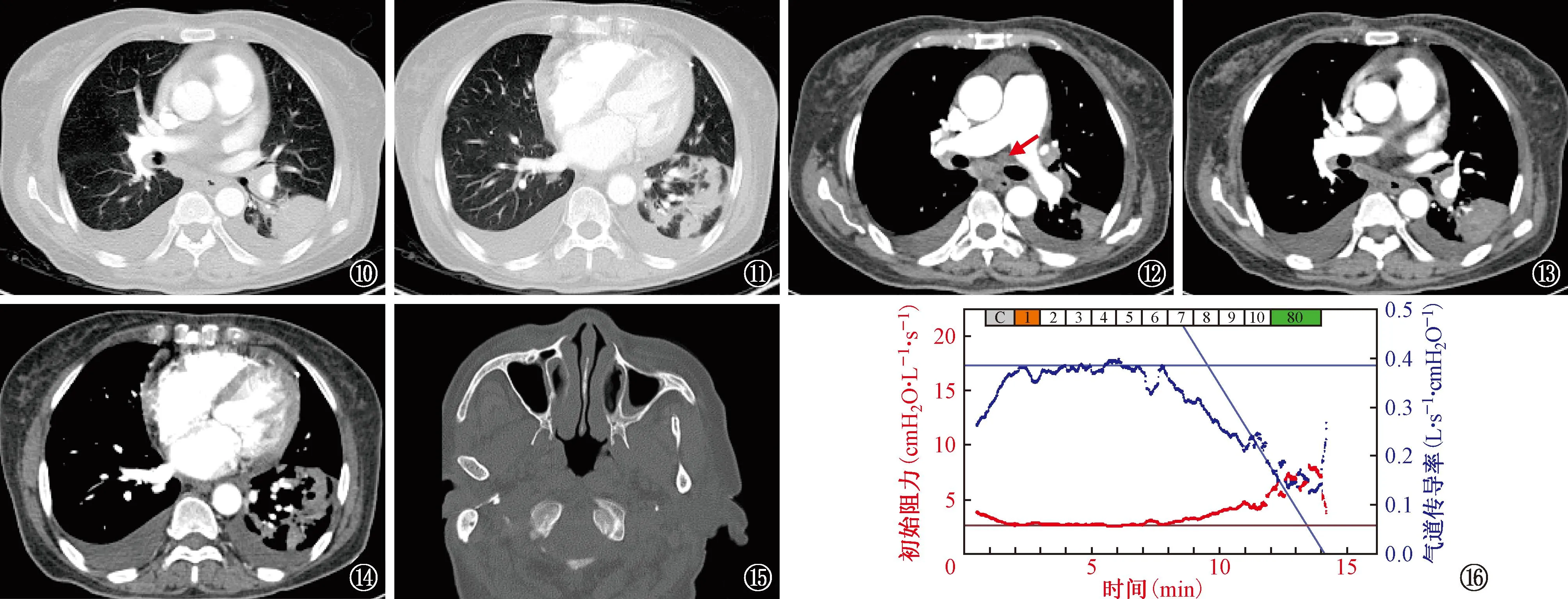
图10~14 同一患者。CT肺血管造影(2021年4月6 日)。图10、11为经过莫西沙星、哌拉西林钠他唑巴坦钠及更昔洛韦抗感染、强化利尿治疗7 d后的CT扫描肺窗,可见左下肺实变影周围渗出较前吸收,实变影较前吸收不明显,胸腔积液较前部分吸收。图12~14为纵隔窗,图12可见纵隔淋巴结(箭头所示)较前变化不大;图13、14可见左下肺实变吸收不明显,胸腔积液较前吸收,未见肺栓塞 图15~16 同一患者。图15为鼻窦CT扫描(2021年3月25日),可见双侧中下鼻甲轻度肥大,双侧上颌窦、双侧筛窦黏膜增厚,提示存在鼻窦炎;图16为气道激发试验(2021年4月8日),结果提示气道高反应
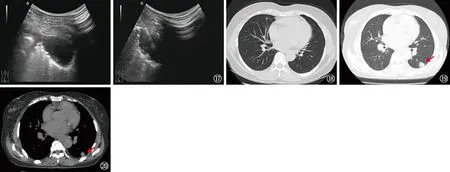
图17 同一患者。超声引导下行经皮肺组织活检术(2021年4月13日)。可见超声引导穿刺下类圆形低回声结节 图18~20 同一患者。图18为2021年9月11日接受克拉霉素、利福平、乙胺丁醇三联抗鸟-胞内分枝杆菌复合群肺病治疗后的胸部CT扫描,可见左下肺病变全部吸收。图19、20为2023年6月患者因再次出现咳嗽而行胸部CT复查,可见左下肺再次出现新病灶
患者出院后,左肺下叶肺穿刺病理回示肺组织间质纤维组织增生伴玻璃样变性,淋巴细胞浸润(因患者病理外借,无病理学图片),抗酸染色阳性(2021-04-21),遂使用结核分枝杆菌复合群核酸检测试剂盒(PCR-荧光探针法;北京鑫诺美迪基因检测技术有限公司)和分枝杆菌鉴定试剂盒(荧光PCR溶解曲线法;MeltPro®Myco厦门致善生物科技股份有限公司)完善肺组织结核分枝杆菌及NTM菌种检测,结果报告为鸟分枝杆菌复合群DNA阳性。遂修改诊断为MAC肺病,于4月27日开始快速减停甲泼尼龙,减量方式为每3天减4 mg,减至12 mg时每周减4 mg,直至5月29日减停。患者因合并肾功能不全入住中国人民解放军总医院第八医学中心,予克拉霉素(0.5 g/次,1次/d)、乙胺丁醇(1 g/次,1次/d)、利福平(0.6 g/次,1次/d)抗MAC治疗6个月,期间于9月11日复查胸部CT,可见病灶全部吸收(图18)。11月患者再次因四肢水肿、肾功能恶化接受血液透析,自行停止抗MAC治疗。2年后随访,患者再次出现咳嗽,CT扫描可见左下肺新发病灶(图19~20),再次就诊于中国人民解放军总医院第八医学中心,予克拉霉素、利福平、乙胺丁醇抗MAC治疗,目前随访症状较前好转。
讨 论
NTM因其细胞壁的疏水性形成生物膜广泛存在于自然水源、土壤、供水系统中,尤其是医院供水系统及血液透析中心的供水中均可分离到MAC或其他NTM[7],家庭和医院的淋浴喷头、水龙头、曝气机和热水浴缸中也均可检出[8],当机体合并肺部基础疾病或存在严重免疫抑制状态等处于免疫力低下状态时,极易因吸入土壤或灰尘、接触水源或受污染的设备时受到感染[9],临床上以肺部NTM感染和MAC肺病最为常见[10]。本例患者为老年绝经女性,同时存在慢性肾功能不全病史,发病前3个月接受类皮质醇激素的免疫抑制治疗,是MAC易感的高危人群。
NTM肺病的病理生理学涉及细菌、气道和免疫之间的三角关系。宿主成功防御、清除NTM主要通过Th1型免疫反应,但这一过程可能抑制巨噬细胞和其他免疫细胞的功能。当黏液纤毛清除能力受损和Th1免疫缺陷时可导致NTM细菌的复发和持续感染。NTM感染本身也会损伤气道纤毛,导致黏液纤毛清除率进一步降低,引起的气道炎症和过度中性粒细胞炎症也会损害气道,导致气道病理重构,以及结节、支气管扩张和死腔的形成[4]。有文献报道,NTM感染患者的外周血嗜酸性粒细胞计数明显高于肺结核患者,其中MAC感染的嗜酸性粒细胞和IgE显著更高[11],这可能是由于Th2相关气道炎症(如哮喘、变应性支气管肺曲霉菌病和嗜酸性慢性阻塞性肺疾病)在接受吸入性类固醇激素治疗后增加了感染NTM的风险[12];另外,Th2型炎症本身也可能导致MAC持续感染,这主要是由于NTM主要依赖Th1型免疫反应,且在较小程度上需要功能性Th17免疫反应,而不是Th2型反应[13]。结合本例患者发病前接受中等剂量类皮质醇激素治疗3个月,入院后完善T细胞亚群提示CD4和CD8 T细胞计数明显低于正常限值,这也是患者出现肺部感染后,出现Th1型免疫反应不足,并伴随出现以嗜酸性粒细胞升高为主的Th2型免疫反应的原因。
NTM肺病易发生于有基础肺病的患者,如慢性阻塞性肺疾病、支气管扩张、囊性纤维化及免疫抑制人群。其症状具有与肺结核相似的临床表现,但无特异性,包括咳嗽、咳痰,可存在全身中毒症状,但较肺结核轻。影像学上NTM肺病主要存在纤维空洞型和结节性支气管扩张型[3],其中,支气管扩张伴小叶中心结节是MAC肺病的重要征象,且更易见薄壁空洞伴支气管扩张和肺小结节[14]。而NTM肺病的诊断需要同时包括肺部临床症状及影像学表现,或微生物学中的其中一条,即:(1)至少有2个单独痰液样本的培养阳性结果,如果无法诊断,可考虑重复查痰抗酸杆菌涂片和培养;(2)至少1次支气管冲洗液或肺泡灌洗液的培养结果呈阳性;(3)支气管或其他途径肺活检发现分枝杆菌肺病组织病理学特征性改变(肉芽肿性炎症或抗酸杆菌染色阳性),并且1次及以上的痰液/支气管冲洗液/肺泡灌洗液的NTM培养阳性和分子生物学检测阳性[15];其中mNGS在NTM肺病的诊断中具有较高的敏感度,但存在特异度较低的局限性[16]。结合本例患者BALF的mNGS检测阴性,极易使临床医生除外NTM诊断。虽然本例患者在支气管镜下表现为左上叶局部黏膜充血水肿更为明显,但受到患者合并心功能不全、局部黏膜水肿的影响,本例采样选择镜下左下叶BALF,这或许是采样部位致mNGS检测阴性的原因,提示mNGS阴性并不能完全除外NTM诊断。
EGPA以血管外形成坏死性肉芽肿、嗜酸性粒细胞增多症和组织浸润以嗜酸性粒细胞为主为特点。任何脏器均可受累,肺部、皮肤、鼻窦、心血管系统、肾脏、周围神经系统、中枢神经系统、关节、胃肠道均是最常见的受累部位。EGPA的诊断应基于高度提示性的临床特征、血管炎的客观证据(例如来自组织学的证据)和抗中性粒细胞胞浆抗体(ANCA)[17],且符合2012年的教堂山会议共识(≥4条分类标准),其诊断敏感度为85%,特异度为99.7%[18]。尽管本例患者存在气道高反应、鼻窦炎、嗜酸性粒细胞升高、肺部浸润和肾功能不全等提示EGPA的临床特征,但缺乏血管炎的客观证据如病理证据,且ANCA检测为阴性,因此,临床应积极完善肺部或肾脏的病理组织活检,在证实为嗜酸性粒细胞浸润或血管炎证据后再进一步进行诊断。
本例患者为老年女性,发病前因慢性肾小球肾炎合并肾功能不全病史接受糖皮质激素治疗3个月后出现咳嗽、咳痰、间断高热3个月,影像学出现左肺下叶炎症、结节状实变,伴牵拉性支气管扩张,首先考虑感染性疾病,在接受多种广谱抗生素及抗真菌药物的治疗后发热仍无明显改善,但病情进展缓慢,中毒症状相对较轻,认为长时程的发热疾病也是一些非感染性病变如血管炎、结缔组织疾病及肿瘤等疾病的表现,结合本例患者发生一过性嗜酸性粒细胞升高、并发周围神经病变、鼻窦炎、气道高反应等表现,临床符合EGPA,且患者在糖皮质激素治疗下病情有所缓解,也支持EGPA的临床诊断。但诊断过程中未能充分重视肺组织肉芽肿的病理抗酸杆菌染色阳性表现,忽视了这可能是不典型病原体,如结核分枝杆菌、努卡菌等的病理表现,也未考虑胞内菌在血液或肺泡灌洗液中的感染可无明显病原学证据,暴露出综合医院对分枝杆菌病诊断的不足。但值得庆幸的是,为了明确诊断,在患者出院前再次留样行病理检查,在组织病理再次提示抗酸杆菌阳性时,及时行基因检测鉴定为鸟分枝杆菌复合群阳性。提示当患者伴发嗜酸性粒细胞升高和IgE升高时,应考虑到MAC肺病较肺结核更易伴发TH2型免疫反应[11]。
目前,MAC肺病的治疗通常包括大环内酯类药物、利福霉素和乙胺丁醇。对于结节性支气管扩张型MAC肺病,临床指南有条件推荐每周服用上述药物3次,而对于晚期或重度结节性支气管扩张型MAC肺病则推荐每日治疗方案[1];对于空洞性NTM肺病,则可另外静脉注射阿米卡星或肌肉注射/静脉注射链霉素;对于难治性MAC肺病,治疗方案则至少需要4种药物,即大环内酯类药物、利福霉素、乙胺丁醇和阿米卡星脂质体吸入混悬液;对于空洞性 NTM肺病和难治性NTM肺病,建议每日给药,但氨基糖苷类药物可每周给药 3次,治疗应持续至培养阴转后12个月[15]。本例患者规律接受克拉霉素、乙胺丁醇、利福平三联抗NTM治疗6个月后病灶完全消失,按照指南建议应在痰培养阴转后继续巩固抗MAC治疗1年,但患者在治疗6个月后自行停药,2年后再次咳嗽,复查胸部CT提示MAC肺病复发。
综上所述,MAC肺病临床表现并无特异性,临床表现与EGPA高度重叠,故诊断不典型病例具有一定难度;另外,肺泡灌洗液mNGS可呈阴性,必要时需完善病理NGS检测和组织培养以明确诊断。
利益冲突所有作者均声明不存在利益冲突
作者贡献高瑞月:临床管理及撰写文章;王政:提供基金支持;安立:提供诊疗建议及批评性审阅

