结核分枝杆菌潜伏感染者外周血单个核细胞转录组学研究
尚雪恬 董静 黄麦玲 孙琦 贾红彦 张蓝月 刘秋月 姚明旭 王颖超 姬秀秀 杜博平 邢爱英 潘丽萍
结核分枝杆菌潜伏感染(latent tuberculosis infection,LTBI)是一种在体内存在“休眠”的持续存活的结核分枝杆菌(Mycobacteriumtuberculosis,MTB),能够对MTB抗原刺激产生持久性的反应,但没有活动性结核病临床症状的状态[1-3]。全球约有1/4的人口感染MTB,LTBI者中约有5%~10%的个体会发展为活动性结核病[4]。目前,用于诊断LTBI的方法主要是免疫学检测,包括结核菌素皮肤试验和γ-干扰素释放试验,但在部分特殊人群,如儿童、老年人、免疫抑制人群等的应用中受限[5]。一些研究表明,有相当比例的活动性结核病是由LTBI者体内的MTB重新激活发展而来,特别是在合并其他疾病的情况下,如肿瘤、HIV感染、糖尿病等,发展为活动性结核病的风险更高[6-8]。目前,对于LTBI发生的原因,以及LTBI人群发展为结核病的机制并未完全解析。探索LTBI者中结核抗原特异的免疫应答基因谱,对于揭示LTBI成因及发现更优的LTBI诊断标志物具有重要意义。
高通量分析技术的发展为揭示疾病发生发展机理提供了手段,既往基于结核病血液转录组学的研究扩展了对宿主抗结核免疫反应机制的认识,并有助于结核病的鉴别诊断、治疗和监测[9-10]。但既往研究多以未经MTB特异性抗原刺激的外周血全血或外周血单个核细胞(peripheral blood mononuclear cells,PBMC)作为研究对象,而且多是基于传统的差异基因分析(differentially expressed gene analysis,DEG),以及简单的京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析和基因本体论(geneontology,GO)生物信息学分析等,未能达到对转录组数据的深入探究和挖掘。因此,为了探究LTBI应对MTB特异性抗原的免疫应答谱,寻找LTBI免疫应答过程中重要的信号通路和免疫细胞,本研究对LTBI者和健康对照(healthy control,HC)者经MTB特异性抗原刺激后的PBMC进行mRNA微阵列芯片分析,应用加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)选择与LTBI相关的重要基因模块,并对相关性最大的两个模块中的基因分别进行GO分析和KEGG分析,结合基因集富集分析(gene set enrichment analysis,GSEA)确认与LTBI相关的关键通路;通过免疫浸润分析鉴定参与LTBI的重要免疫细胞;通过STRING数据库蛋白相互作用(protein-protein interaction,PPI)网络分析绘制两模块中差异基因相互作用网络图,以期为深入分析LTBI发生发展中的宿主免疫应答机制提供理论基础。
对象和方法
一、研究对象
本研究用于微阵列芯片检测的临床标本,于2009年12月在首都医科大学附属北京胸科医院招募而来,包含4例LTBI者(LTBI组)和4名HC者(HC组)。本研究用于差异基因qPCR验证的临床标本,于2022年10月至2023年1月在首都医科大学附属北京胸科医院招募而来,包含10例LTBI者和10名HC者。受试者人口学特征见表1。研究得到首都医科大学附属北京胸科医院伦理委员会的批准(伦理审批编号:YJS-2022-12)。在采集血样前,均获得每名(例)参与者的书面知情同意。

表1 研究对象人口学特征
纳入标准:(1)LTBI个体符合以下标准:γ-干扰素释放试验阳性,胸部影像学检查无异常,无活动性结核病的临床症状。(2)HC个体符合以下标准:γ-干扰素释放试验阴性,胸部影像学检查无异常,无活动性结核病的临床症状。
排除标准:(1)HIV阳性、乙型肝炎病毒或丙型肝炎病毒阳性。(2)合并糖尿病、恶性肿瘤或严重自身免疫性疾病。(3)服用免疫抑制剂或免疫增强剂。(4)妊娠或哺乳期妇女。(5)年龄<18岁。
二、体外抗原刺激
使用肝素抗凝管采集6 ml外周血,在采集后4 h 内使用Ficoll淋巴细胞分离液采用密度梯度离心法分离PBMC。使用10 μg/ml纯化的MTB特异性抗原:早期分泌抗原靶6(6 kDa early secretory antigenic target,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)(上海晶诺生物科技有限公司),与PBMC共同孵育,在37 ℃、含5%二氧化碳的细胞培养箱中共同孵育20 h后收集PBMC,使用TRIZOL试剂裂解,冻存于―80 ℃直至用于芯片检测,期间无反复冻融。
三、RNA提取
使用miRneasy®Mini试剂盒(德国QIAGEN公司)从PBMC中提取总RNA。使用无核糖核酸酶的脱氧核糖核酸酶(德国QIAGEN公司)去除基因组DNA污染。使用安捷伦2100生物分析仪(美国安捷伦科技有限公司)对RNA的完整性和质量进行评估。使用具有2100 RIN(RNA完整性数)≥ 7.0和28S/18S>0.7的RNA进行微阵列芯片检测和qPCR验证。
四、微阵列芯片检测
采用美国安捷伦科技有限公司生产的人类全基因组寡核苷酸芯片(4×44 K,包括41 000个基因和转录本),以每份样本中提取的总RNA作为模板进行荧光标记和杂交,并在美国安捷伦科技有限公司微阵列扫描仪上进行扫描。采用Feature Extraction软件10.7(安捷伦技术)进行原始数据提取,并采用GeneSpring软件12.6.1(安捷伦技术)中的分位数算法进行数据归一化。微阵列实验于2010年在上海伯豪生物科技有限公司完成。微阵列数据保存在GEO数据库,编号为GSE98461。
五、生物信息学分析
使用TBtools 2.042软件[11]进行WGCNA分析(https://github.com/ShawnWx2019/WGCNA-shinyApp),寻找与LTBI相关的基因模块,通过WGCNA自带cor函数使用皮尔逊相关性分析计算相关性,得到与LTBI最显著正相关和负相关性的两个模块(cor值越接近1或―1,P<0.05)。使用DAVID(https://david.ncifcrf.gov/)在线分析工具对模块中的基因进行GO富集分析和KEGG信号通路分析。通过微生信平台(https://www.bioinformatics.com.cn)进行GSEA分析[12],鉴定发挥重要功能的信号通路。通过微生信平台进行免疫浸润分析[12],鉴定与LTBI相关的重要免疫细胞。重要模块中的差异基因在STRING数据库(https://cn.string-db.org)中进行PPI网络分析,运用cytoHubba插件对PPI网络图进行运算,鉴定与LTBI相关的重要差异表达基因。
六、qPCR检测
按照SuperRT cDNA Synthesis Kit(康为世纪生物科技股份有限公司)说明书将mRNA反转录成cDNA,再根据Power SYBR Green PCR Mater Mix[赛默飞世尔科技(中国)有限公司]说明书对差异基因进行表达量验证分析。qPCR检测在ABI公司Quantistudio7实时荧光定量PCR仪上完成。以GAPDH为内参基因,计算2-△CT,以确定基因相对表达量。qPCR引物:mRNA IL2-F:TATGCAGATGAGACAGCAACCAT,mRNA IL2-R:TTGAG-ATGATGCTTTGACAAAAGG,mRNA SPINK1-F:TCTATCTGGTAACACTGGAGCTG,mRNA SPINK1-R:ACACGCATTCATTGGGATAAGT,mRNACHI3L1-F:GTGAAGGCGTCTCAAACAGG,mRNACHI3L1-R:GAAGCGGTCAAGGGCATCT,mRNA TNF-a-F:CAGCCTCTTCTCCTTCCTGAT,mRNA TNF-a-R:GCCAGAGGGCTGATTAGAGA,mRNA RASGRP2-F:ACAATCCCGGAAGGACAACTC,mRNA RASGRP2-R:GTCTATGTCGATTAGGCTGCTG,mRNA TPM2-F:CTGAGACCCGAGCAGAGTTTG,mRNA TPM2-R:TGAATCTCGACGTTCTCCTCC,mRNA CAMK1G-F:CCTGAGATCACCATCACCGA,mRNA CAMK1G-R:GCCATTGACCAGGCAGTTGA,mRNA SUCNR1-F:GACAATGGCACCACCTGTAATG,mRNA SUCNR1-R:CTGCTTTAGGAAGAGAGCAATCTTG,mRNA HCAR3-F:ACCATACAGACACACGCCACTT,mRNA HCAR3-R:CAT-CTCGGAACACACAGCAGT,mRNA IL18BP-F:GACACCAGACCTCAGCCCTT,mRNA IL18BP-R:TCTGCGAGACAGGTGTGGCT,mRNA GAPDH-F:TGACTTCAACAGCGACACCCA,mRNA GAPDH-R:CACCCTGTTGCTGTAGCCAAA。qPCR 反应程序设置:50 ℃,2 min;95 ℃,10 min,预变性;95 ℃,变性15 s;60 ℃退火延伸1 min;变性和退火延伸两步循环40次。
七、统计学处理
结 果
一、差异基因分析及验证
采用全基因组微阵列分析方法获得LTBI和HC个体经MTB特异性抗原刺激后PBMC内差异基因表达谱。基于差异基因进行主成分分析(principal component analysis,PCA),结果显示,LTBI个体与HC个体之间存在明显分群,说明差异基因能够较好地分辨LTBI和HC个体(图1)。分析表达谱数据,以组间差异倍数(fold change,FC)>2或<0.5和组间差异有统计学意义(P<0.05)为阈值,筛选出两组间差异有统计学意义的393个基因,其中281个基因在LTBI组明显上调,112个基因在LTBI组明显下调(图2)。以微阵列芯片标准化数据中任一组表达量均值(Mean值)>7和组间差异P<0.01为阈值,筛选其中组间差异倍数最为明显的10个上调基因和10个下调基因,见表2。针对LTBI组和HC组差异表达基因绘制聚类分析热图(图3),结果显示LTBI组和HC组之间的基因表达存在明显差异,差异基因能够很好地对LTBI和HC进行分组。

图1~3 LTBI和HC个体经结核分枝杆菌特异性抗原刺激后的外周血单个核细胞全基因表达谱。图1为主成分分析。图2为火山图。图3为差异基因的聚类分析热图,s1m~s4m为HC样本,s1p~s5p为LTBI样本
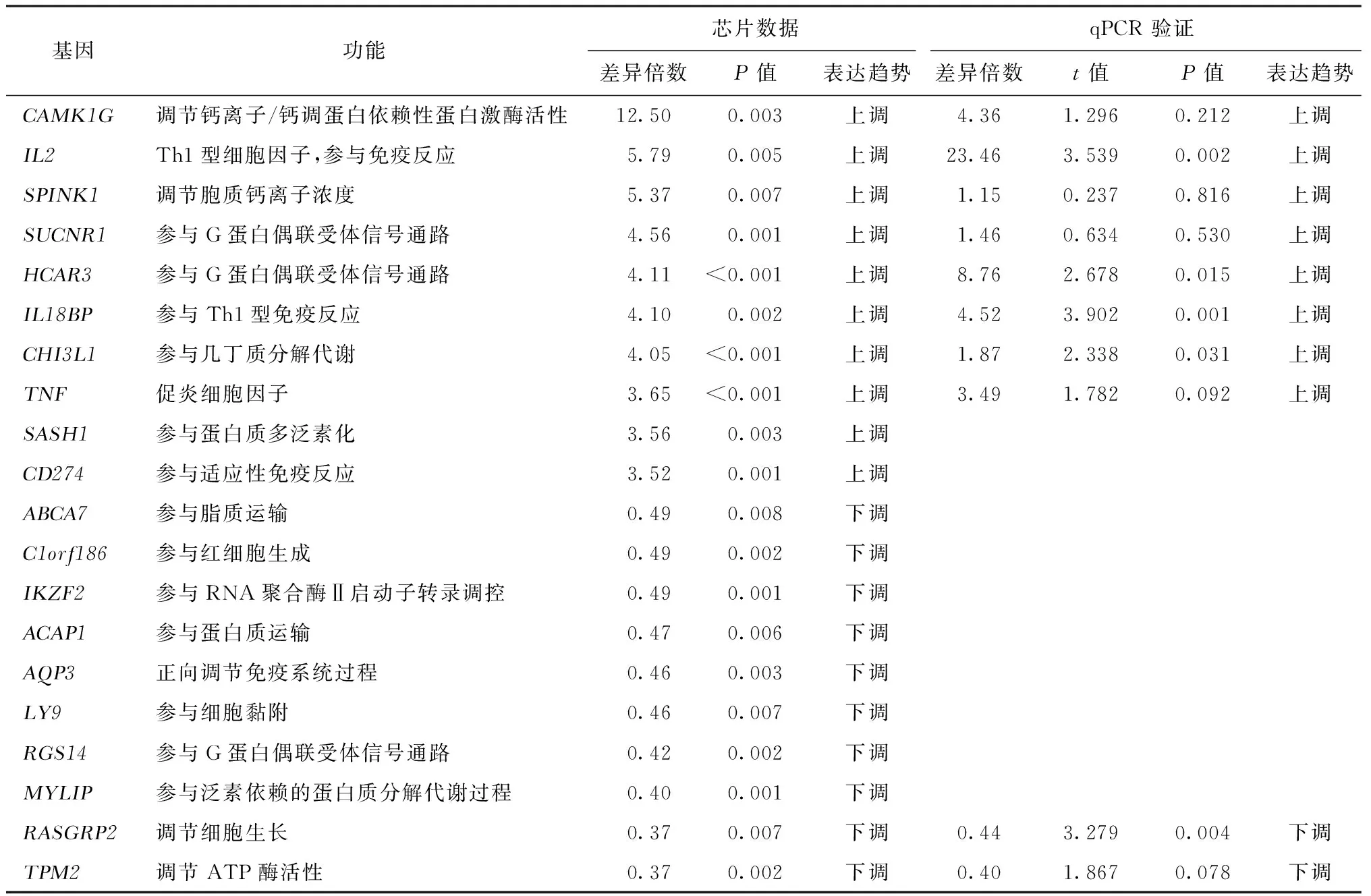
表2 LTBI组和HC组间表达差异最为明显的 10 个上调基因和10个下调基因
为了验证微阵列芯片的结果,本研究选择LTBI组中上调差异最大的8个基因和下调差异最大的2个基因进行qPCR验证。如表2和图4所示,10个基因经qPCR验证的表达模式均与芯片结果一致。

注 a:P<0.05, b:P<0.01, c:P<0.001;HC:健康人, LTBI:结核分枝杆菌潜伏感染者图4 上调差异最大的8个基因和下调差异最大的2个基因qPCR验证散点图
二、WGCNA分析鉴定与潜伏感染相关的关键模块
为了挖掘基因共表达网络,以进行更深度的表达调控分析,本研究对转录组进行了WGCNA网络的构建。WGCNA分析基于19 643个基因,软阈值β设置为28(R2=0.8),然后评估模块与疾病分组(LTBI和HC)之间的关系,如图5所示,蓝色模块(MEblue)的特征基因与LTBI之间存在强烈的正相关(cor=0.88,P=0.004),其中包含1079个基因;而蓝绿色模块(MEturqoise)的特征基因与LTBI之间存在强烈的负相关(cor=―0.93,P=0.001),其中包含1207个基因。
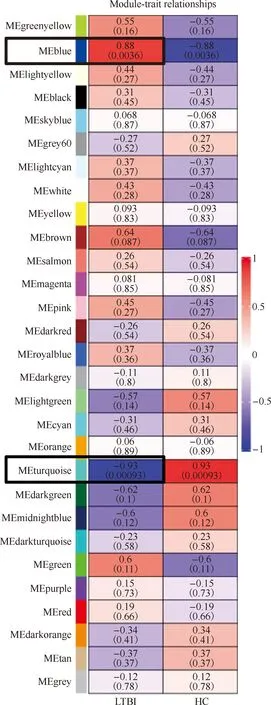
注 黑色框标注的是相关性最强的正相关模块和负相关模块图5 WGCNA基因模块与分组信息的相关性热图
三、LTBI相关基因模块的功能注释分析和PPI网络分析
针对与LTBI相关性最强的蓝色和蓝绿色模块基因进行GO分析(表3)。其中生物过程(biological process,BP)分析发现,蓝色模块的基因主要富集在炎症应答、细胞器内酸化过程、细胞因子介导的信号通路、肌动蛋白细胞骨架组织、白细胞介素-1β产生的正向调节等生物过程;蓝绿色模块的基因主要富集在转录调控、炎症应答、染色质重塑、细胞周期、细胞凋亡等生物过程。分子功能(molecular function,MF)分析显示,蓝色模块的基因主要参与蛋白结合、细胞因子受体活性、信号受体活性、质子转运ATP酶活性、锰离子跨膜转运体活性等分子功能;蓝绿色模块的基因主要参与蛋白结合、脂质结合、DNA结合、染色质结合、转录共抑制因子活性等分子功能。细胞组分(cellular component,CC)分析显示,蓝色模块的基因主要涉及胞质、质膜、细胞器膜等细胞组分;蓝绿色模块的基因主要涉及核膜、核内、胞质等细胞组分。

表3 蓝色模块和蓝绿色模块中基因GO富集分析
针对与LTBI相关性最强的蓝色和蓝绿色模块基因进行KEGG分析(表4),发现蓝色模块中的基因主要富集在溶酶体、吞噬体、结核病、凋亡、铁死亡和趋化因子信号通路等相关信号通路;蓝绿色模块的基因主要富集在FcγR介导的吞噬作用相关信号通路、B细胞受体信号通路、凋亡、C型凝集素受体信号通路和趋化因子信号通路。

表4 蓝色模块和蓝绿色模块中基因KEGG信号通路分析
对两模块中的差异基因通过STRING数据库构建PPI网络图(图6~9),并用Cytohubba插件中最大互相关(maximum cross correlation,MCC)方法鉴定出每个模块中的前10个关键基因,包括蓝色模块中的PTPRC、CD40、IL10、IRF8、CCR1、CD80、TLR8、CLEC7A、CD83和CD274;蓝绿色模块中的TNF、ICAM1、TNFRSF4、HAVCR2、CD276、CCL4、CD33、IL1RN、NCF1和FGR。这些基因多富集在与固有免疫相关的信号通路中,与固有免疫有关。
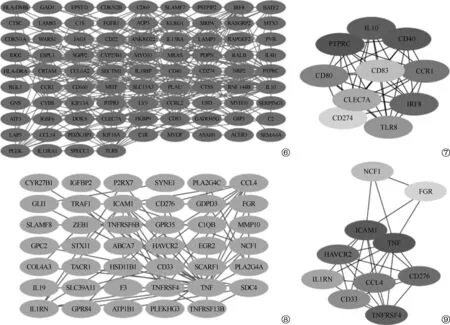
图6~9 蓝色模块和蓝绿色模块基因的PPI网络分析。图6为蓝色模块差异基因PPI网络图。图7为蓝色模块10个Hub基因。图8为蓝绿色模块差异基因PPI网络图。图9为蓝绿色模块10个Hub基因。图7和图9中基因颜色越深,表示相关性越强
四、全转录组GSEA分析鉴定重要信号通路
为了更充分地了解LTBI和HC组间全转录组的差异,本研究进行了GSEA研究分析。GSEA主要关注的是整个基因集的表达,而不只是差异表达基因。基于GSEA分析中的通路分析,对比GSEA分析获得的重要信号通路,以及WGCNA中蓝色和蓝绿色模块的基因KEGG通路分析结果,发现3个共同通路(图10),即趋化因子信号通路(P<0.001)、凋亡信号通路(P=0.003)、癌症信号通路(P<0.001),可能与LTBI的发生发展密切相关。
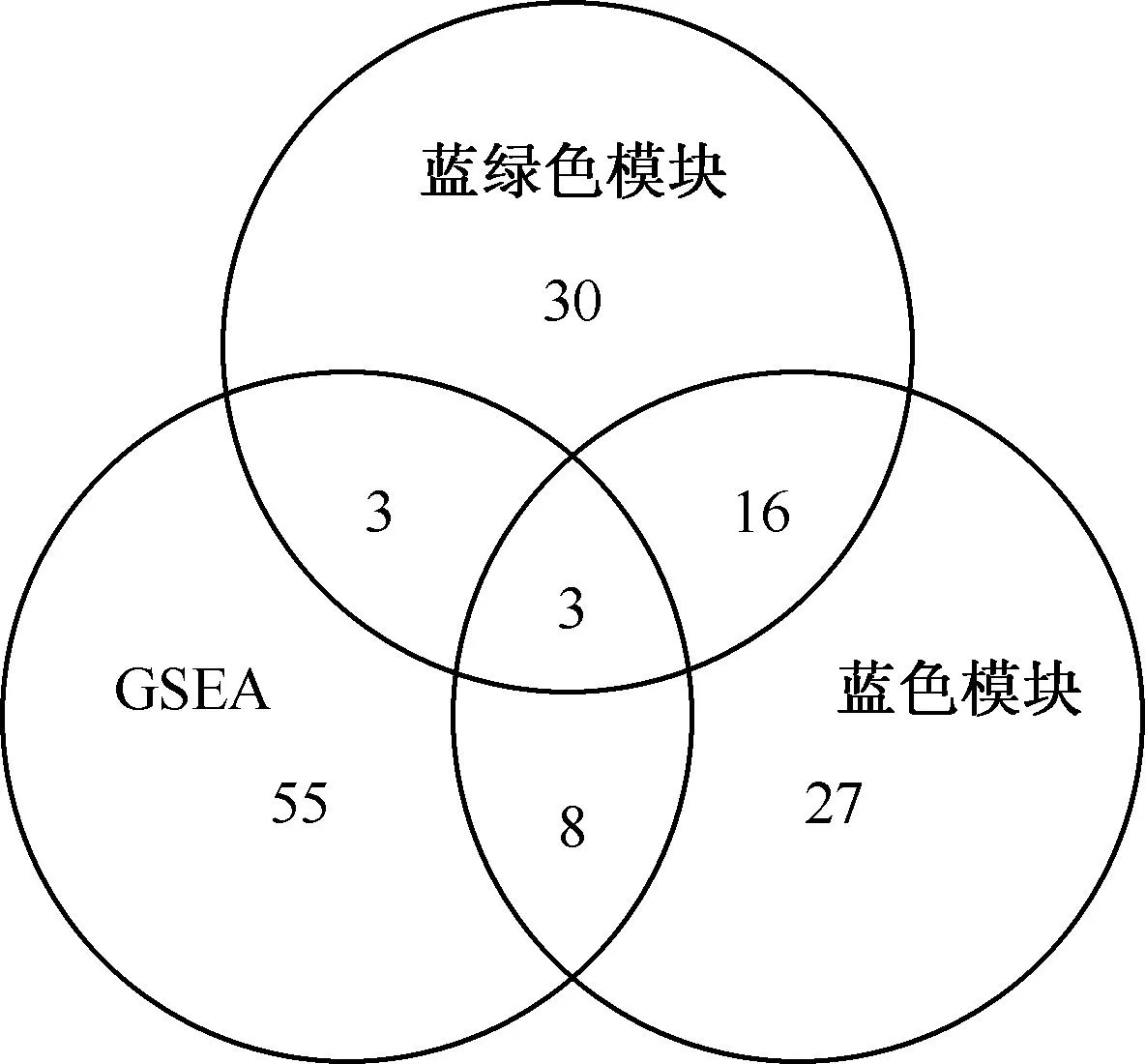
图10 GSEA分析及WGCNA蓝色模块和蓝绿色模块基因KEGG通路分析的韦恩图
五、免疫细胞浸润分析
为了进一步了解LTBI个体对MTB特异性抗原的免疫反应情况,本研究通过免疫浸润分析寻找参与LTBI对MTB特异性抗原免疫应答过程的重要免疫细胞,如图11~13所示,HC与LTBI组间的22种浸润性免疫细胞类型的比例存在差异,其中5种免疫细胞有明显差异:嗜酸性粒细胞(P<0.001)、M1型巨噬细胞(P=0.029)、M2型巨噬细胞(P=0.001)、中性粒细胞(P<0.001)和调节性T细胞(P=0.003)。其中,M1型巨噬细胞比例在LTBI中上调,嗜酸性粒细胞、M2型巨噬细胞、中性粒细胞和调节性T细胞比例在LTBI中均下调。
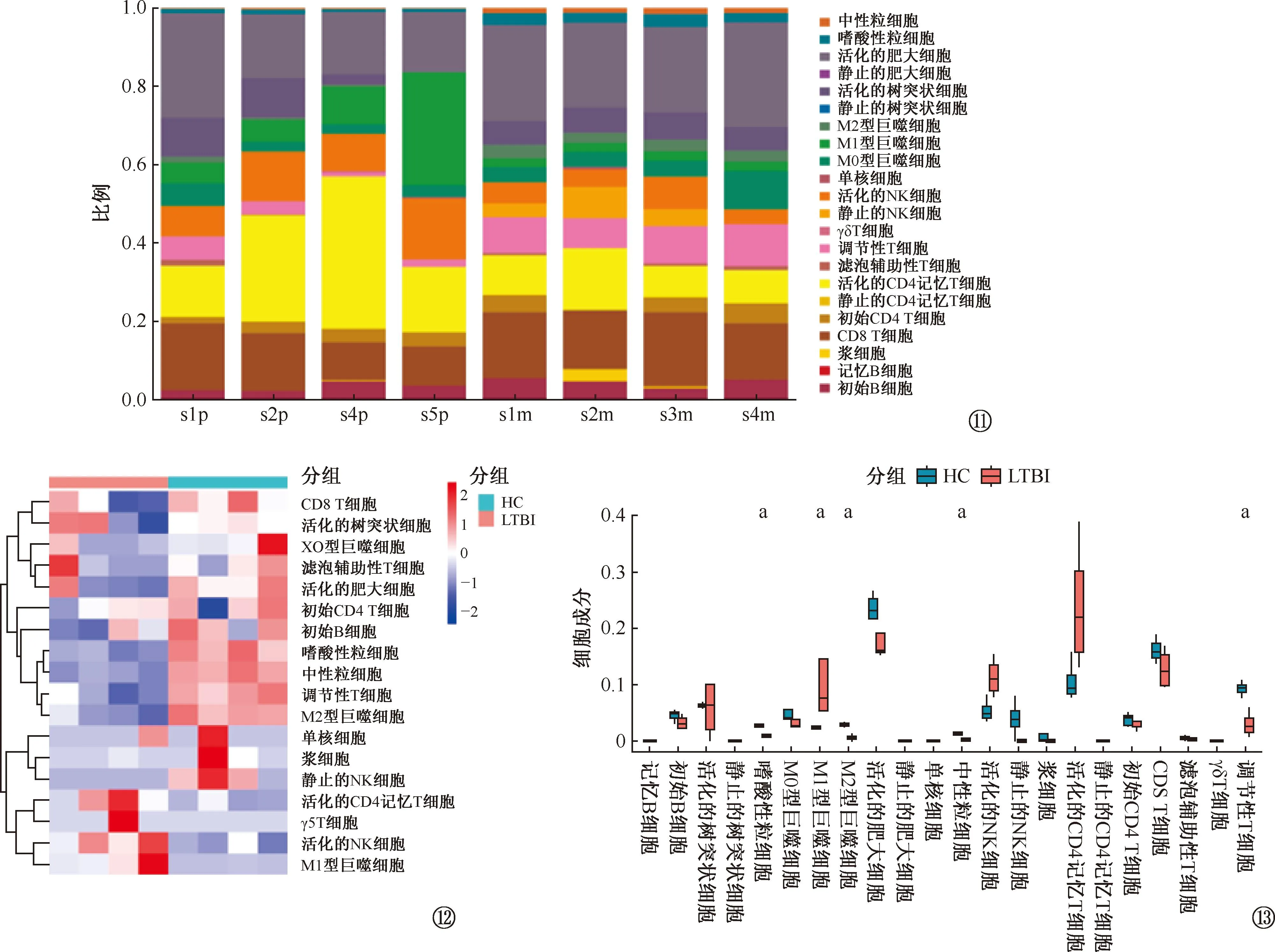
图11~13 免疫浸润分析。图11为HC与LTBI组间不同免疫细胞相对丰度图。图12为HC与LTBI组间免疫浸润差异的聚类热图。图13为HC与LTBI组间免疫浸润差异的箱形图(a:P<0.05)。HC:健康人;LTBI:结核分枝杆菌潜伏感染者
讨 论
MTB一旦进入宿主并感染肺泡巨噬细胞,肺泡巨噬细胞将吞噬并试图通过溶酶体依赖的吞噬小体来消除病原体。然而,MTB可抑制吞噬溶酶体融合并在宿主巨噬细胞内复制,维持一种休眠的低代谢潜伏状态[14]。在LTBI阶段,MTB长期处于不活跃状态,在表型上对抗结核药物不敏感,并保持其复苏和增殖的能力[15]。但在合并感染和其他免疫抑制因素下可以促使其复苏和复制,从而导致活动性结核病,并增加MTB传播风险。在本研究中,应用微阵列芯片比较了LTBI和HC个体PBMC经MTB特异性抗原刺激后的基因转录谱,可以帮助了解LTBI个体对结核抗原特异的免疫应答谱,为识别新的LTBI生物标记物、深入分析LTBI发生发展的机制提供可靠的数据。
与既往使用未经结核抗原刺激的全血或PBMC完成的微阵列研究不同,本研究检测了MTB特异性抗原刺激后的PBMC转录谱,有利于发现MTB特异性抗原引发的免疫应答相关的差异基因,研究结果也证实MTB感染状态下的PBMC对MTB特异性抗原的免疫应答存在明显差异,这些差异有可能成为LTBI诊断的潜在标识。在本研究中,将传统的差异表达基因筛选方法和WGCNA网络分析结合起来,以提高识别 LTBI特异表达基因的能力。同时,将WGCNA分析中获得的重要模块进行GO和KEGG分析,并与GSEA分析相结合,共同鉴定与LTBI相关的重要信号通路,发现不同生物信息学分析中共同鉴定的通路包括凋亡信号通路和趋化因子信号通路。细胞凋亡是一种受调控的细胞死亡过程,通过激活天冬氨酸特异性半胱氨酸蛋白酶来消除受损或多余细胞[16]。细胞凋亡对于MTB感染的结局很重要。目前对于细胞凋亡对MTB感染后机体的保护作用及机制研究较多[17-18]。对于MTB来说,通过自身效应蛋白抑制宿主巨噬细胞凋亡也是促进自身在宿主体内存活的关键步骤[19]。目前在宿主导向的免疫治疗和疫苗研发中也提到,通过调节巨噬细胞凋亡达到免疫效果[20]。凋亡信号通路在LTBI者体内被激活可能促进了机体对MTB的控制。
本研究中,笔者发现LTBI组的特异表达基因显著聚集在趋化因子信号通路。趋化因子是由细胞分泌的小分子蛋白,其信号通常由免疫细胞上表达的趋化因子受体转导,在发生炎症反应时招募和引导免疫细胞迁移至炎症部位,因此对宿主的免疫保护作用至关重要。趋化因子受体通常在单核细胞、巨噬细胞、树突状细胞和活化的T细胞等多种免疫细胞表达[21]。MTB感染后可以诱导产生趋化因子,进而招募免疫细胞到肺组织以发挥抗结核感染的作用[22]。MTB感染人气道上皮细胞后在细胞基底侧倾向于分泌趋化因子[23],以便招募循环系统中的免疫细胞。树突状细胞和巨噬细胞在MTB感染早期均会产生趋化因子,招募不同免疫细胞到达炎症部位[24]。而且MTB感染的一个主要病理特征是肉芽肿的形成,肉芽肿的形成需要招募大量细胞到感染部位,已有研究证实,在MTB感染过程中,可通过CC趋化因子配体激活趋化因子受体,诱导结核抗原特异性细胞到达感染部位,促进肉芽肿的形成[25-26]。结核病患者淋巴细胞中CCR-2的低表达导致肉芽肿形成延迟和肉芽肿形成不完全[27]。因此,LTBI个体中趋化因子信号通路的激活可能是宿主抗结核感染的重要步骤。
过去有研究指出,T细胞对MTB休眠状态相关抗原的反应可能在潜伏期占主导地位[28],γ-干扰素释放试验也是源于T细胞对结核抗原反应的原理来确定结核感染。不过CD4+T细胞反应既可以限制全身的疾病,也可以促进肺内进行性破坏性病变的发展[29]。潜伏感染状态下究竟哪类细胞起到关键作用,实际上还需要更深入的分析。为了进一步探究免疫细胞在LTBI人群中的作用,本研究对转录组数据进行了免疫浸润分析,发现HC与LTBI组间的22种浸润性免疫细胞类型的比例存在差异,其中5种免疫细胞有明显差异,即嗜酸性粒细胞、M1型巨噬细胞、M2型巨噬细胞、中性粒细胞和调节性T细胞。嗜酸性粒细胞是Ⅱ型炎症反应中的主要先天效应细胞[30]。尽管对体内嗜酸性粒细胞反应的研究历来集中在过敏反应和寄生虫感染,但最近一项研究发现,嗜酸性粒细胞能被招募到受感染的肺组织中,在控制小鼠MTB感染中发挥保护作用[31]。中性粒细胞可以吞噬MTB,分泌趋化因子和细胞因子,吸引循环中的单核细胞;促进初始抗原特异性CD4+T细胞的激活,触发适应性免疫反应[32]。虽然嗜酸性粒细胞和中性粒细胞在LTBI中下调,但是在LTBI人群中M1型巨噬细胞增加且M2型巨噬细胞下降,提示促炎免疫应答占优势,而且调节性T细胞有所下降,说明免疫抑制作用减弱,这表明LTBI人群免疫微环境中巨噬细胞介导的固有免疫对结核抗原刺激发挥重要的作用,巨噬细胞功能改变和分泌的细胞因子在MTB感染中发挥了重要作用。现有研究已经证实,M1型巨噬细胞通过Toll样受体配体的诱导,可以吞噬并清除病原体,分泌促炎因子,激活T细胞免疫,促进辅助性T细胞1(type-1 helper T cells,Th1)免疫应答,促进初期炎症反应;M2型巨噬细胞则通过产生白细胞介素(interleukin,IL)-4和IL-10等细胞因子参与抗炎反应[33]。因此,与M2型巨噬细胞相比,M1型巨噬细胞在细胞内控制MTB更有效[34]。本研究结果也提示,以M1型巨噬细胞为主的促炎免疫应答水平上升,与既往研究发现的MTB可以抑制巨噬细胞向M1型极化是一致的[35]。综上所述,巨噬细胞介导的固有免疫在LTBI发生中发挥重要的作用,这有可能是MTB在LTBI个体内被控制的必不可少的免疫过程。
本研究应用多种生物信息学方法对LTBI与HC两组人群的转录组进行深入挖掘,揭示了LTBI转录组学特征性模块,并鉴定到参与LTBI发生的重要信号通路和免疫细胞,强调了固有免疫细胞、凋亡和趋化因子信号通路等固有免疫应答在LTBI抗结核免疫中的重要作用,这为探索宿主抗结核免疫机制提供了理论基础。本研究也存在不足之处,一方面芯片样本数量有限,且用于芯片检测的样本均为女性,可能会存在一定的性别偏倚,但是在后续qPCR验证中入组对象包含男性和女性人群,结果提示qPCR验证中基因表达趋势与芯片检测中基因表达趋势一致,表明性别偏倚对上述基因的影响不大。另一方面,未能在扩大样本中对筛选到的重要模块和信号通路中的基因进行进一步的验证,因此未能鉴定到可能实现潜伏感染诊断的新标识,也没有在特定的免疫细胞中对特定基因的功能进行实验验证。后续需要对这些基因,以及在特定免疫细胞中的功能进行深入的研究,以阐明其在潜伏感染诊断中的作用,以及潜伏感染发生过程中的潜在病理机制。
利益冲突所有作者均声明不存在利益冲突
作者贡献尚雪恬:酝酿和设计实验、实施研究、采集数据、分析解释数据、起草文章、统计分析;董静:分析解释数据、指导、对文章的知识性内容作批评性审阅;黄麦玲、刘秋月、姚明旭、王颖超、杜博平、邢爱英:采集数据;孙琦、贾红彦:实施研究、采集数据;张蓝月:指导和对文章的知识性内容作批评性审阅;姬秀秀:分析解释数据;潘丽萍:酝酿和设计实验、分析解释数据、对文章的知识性内容作批评性审阅、指导、获取研究经费、行政/技术或材料支持

