β-微管蛋白在不同部位结肠癌组织中表达差异及与患者预后相关性
张 婷, 姚宁华, 王 馨, 张 召, 王雅丽, 巫 丹
1.镇江市第一人民医院 肿瘤科,江苏 镇江 212000;2.南通大学附属医院 肿瘤放疗科,江苏 南通 226006
结肠癌为常见的消化道肿瘤,是由饮食、环境、遗传等因素引起的大肠组织黏膜上皮病变[1]。有研究报道,结肠癌存在多条致癌途径,包括染色体不稳定性(累及左半结肠)、微卫星不稳定性及锯齿途径(累及右半结肠)等[2]。随着诊疗技术的发展,我国结肠癌早期诊断率提高,但部分中晚期患者预后不佳,因此,寻找一种可评估结肠癌预后的生物学标记物至关重要。微管是细胞骨架的主要组成部分,β-Ⅲ微管蛋白(β-TubulinⅢ)属于微管蛋白家族中一种亚型,其为紫杉类药物耐药的常用生物标志物[3-4]。有研究报道,β-TubulinⅢ阳性表达与乳腺浸润性导管癌组织学分级及分子分型具有相关性[5]。本研究旨在探讨β-微管蛋白(β-Tubulin)在不同部位结肠癌组织中的表达差异及与患者预后的相关性。现报道如下。
1 对象与方法
1.1 研究对象 选取镇江市第一人民医院自2018年1月至2020年1月收治的104例结肠癌患者为研究对象。纳入标准:经病理活检确诊结肠癌[6];临床资料完整。排除标准:心肝肺肾等组织器官功能异常者;术前行放化疗者;认知、精神异常者;恶性肿瘤者。其中,男性48例,女性56例;年龄35~75岁,平均年龄(58.73±5.21)岁。收集所有患者的癌组织标本(设为结肠癌组)及对应的癌旁组织标本(设为癌旁组)。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 研究方法 采用免疫组化法检测β-Tubulin在结肠癌组织及癌旁组织中的表达情况。主要试剂与仪器:鼠抗人β-tubulin单克隆抗体(北京中杉金桥生物技术有限公司)、羊抗兔二抗IgG(艾美捷科技有限公司)、免疫组化试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色盒(福州迈新生物技术有限公司)、显微镜(江苏世泰实验器材有限公司)。检测方法:采用4%多聚甲醛常规固定结肠癌组织、癌旁组织标本,60℃熔点石蜡包埋切至4 μm,再进行二甲苯脱蜡、不同梯度乙醇脱水处理,柠檬酸钠溶液在高压高温下行抗原修复,冷却后加入磷酸盐缓冲液(phosphate buffer solution,PBS),冲洗3次,5 min/次。随后加入5%山羊血清抗体进行封闭,4℃冰箱内孵育过夜,加入PBS冲洗3次,加入鼠抗人β-tubulin单克隆抗体(稀释比1∶1 000),37℃下孵育30 min,PBS冲洗3次。取DAB染色试剂盒显色,苏木精复染、乙醇脱水、树脂胶封片,高倍显微镜下观察β-Tubulin蛋白表达水平情况。由两位副高职称的病理医师进行结果判定,显微镜示细胞质内出现棕黄色或棕褐色颗粒为阳性细胞[8]。阳性细胞百分比:占比<5%为0分、5%~25%为1分、25%~50%为2分、50%~75%为3分、占比>75%为4分。阳性细胞染色强度:无着色为0分、浅黄或黄色为1分、棕黄色为2分、棕褐色为3分。阳性表达:染色指数(staining index,SI)>3分,阴性表达:SI≤3分。通过电话、门诊复查等方式对出院结肠癌患者行随访,连续3年,记录患者生存状况,随访截止时间为2023年1月。

2 结果
2.1 两组不同部位结肠癌组织中β-Tubulin蛋白阳性表达率比较 结肠癌组在左、右半结肠癌组织β-Tubulin蛋白阳性率均高于癌旁组,差异均有统计学意义(P<0.05)。见表1。

表1 两组不同部位结肠癌组织中β-Tubulin蛋白阳性表达率比较/例(百分率/%)
2.2 结肠癌患者的预后生存情况及单因素分析 104例结肠癌患者连续随访3年后,累积存活率为60.58%(63/104)。见图1。结肠癌患者预后与性别、年龄、病理类型、肿瘤直径无关(P>0.05),与不同部位、分化程度、临床病理(tumor node metastasis classification,TNM)分期、浸润深度、淋巴结转移情况、β-Tubulin蛋白表达水平相关(P<0.05)。见表2。
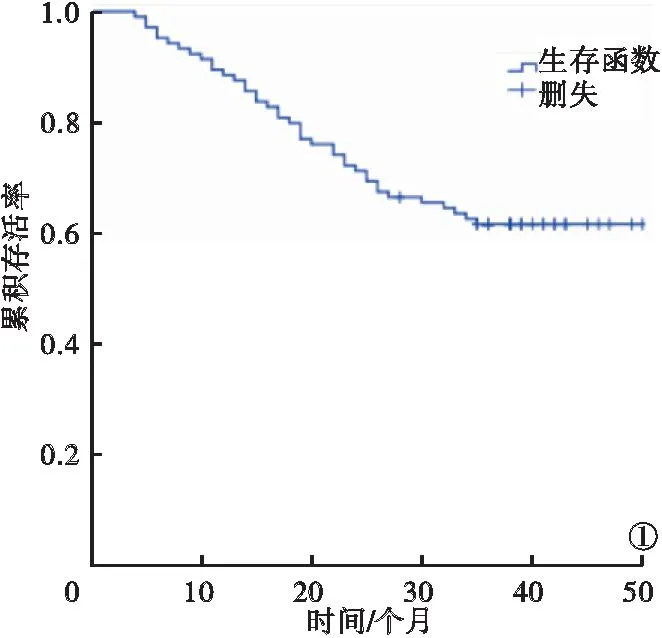
图1 结肠癌患者的预后生存曲线图

表2 结肠癌患者预后的单因素分析/例(百分率/%)
2.3 结肠癌患者预后的多因素Cox回归分析 多因素Cox回归分析结果显示,右半结肠癌、低分化、TNM分期Ⅲ~Ⅳ期、β-Tubulin蛋白阳性表达均为结肠癌患者预后的危险因素(P<0.05)。见表3。

表3 结肠癌患者预后的多因素Cox回归分析
3 讨论
结肠癌为全球较常见的癌症,早期无明显症状,中晚期表现为腹胀、消化不良、排便习惯改变等[7]。结肠癌为受多基因、多步骤、多途径参与的生物过程,包括癌基因的激活、抑癌基因的失活、错配修复基因的缺失[8]。临床以筛查预防为主,现阶段常通过基因筛查或行预后评估为治疗提供指导。有研究报道,左、右结肠癌组织中存在不同基因,其在表达方式、致癌机制上存在差异[9]。
本研究结果显示,结肠癌组在左、右半结肠癌组织β-Tubulin蛋白阳性率均高于癌旁组,差异均有统计学意义(P<0.05)。这提示,β-Tubulin蛋白的异常高表达参与左/右半结肠癌的发生发展过程。微管由微管蛋白二聚体及多种微管结合蛋白组成[10]。β-Tubulin显露的一端为正端,可与三磷酸尿苷-异二聚体结合装配,延长微管,在癌细胞迁移/侵袭、细胞内物质转运中起重要作用[11]。紫杉醇类化疗药物抗肿瘤的作用机制为影响肿瘤细胞微管聚合、解聚,β-Tubulin Ⅲ和紫杉醇类化疗药物的耐受相关,其高表达表明对紫杉醇耐药[12]。本研究结果显示,104例结肠癌患者连续随访3年后,累积存活率为60.58%。结肠癌患者预后与肿瘤所在部位、分化程度、TNM分期、浸润深度、淋巴结转移情况、β-Tubulin蛋白表达水平有关(P<0.05)。这提示,结肠癌患者预后受多种因素的影响,β-Tubulin蛋白表达水平为其中的相关因素,临床评估结肠癌患者预后时可综合患者病理特征信息及β-Tubulin蛋白表达水平得出结论。本研究中多因素Cox回归分析显示,右半结肠癌、低分化、TNM分期Ⅲ~Ⅳ期、β-Tubulin蛋白阳性表达均为结肠癌患者预后的危险因素(P<0.05)。这提示,明确结肠癌所在部位、分化程度、分期及检测β-Tubulin水平可预测结肠癌患者预后情况。左半结肠癌患者的生存状况优于右半结肠癌患者,其中原因可能是右半结肠癌症患者发现得较晚,对此类患者预后造成相对严重的不良影响。β-tubulinⅢ可促进胰腺癌增生、存活,抑制其表达可延长患者生存期。有研究报道,β-tubulinⅢ蛋白沉默表达可抑制肿瘤细胞形成,促进瘤细胞凋亡[13-14]。
综上所述,结肠癌患者中β-Tubulin蛋白均可作为结肠癌化疗药物选择及预后评估的重要生物学指标。
——水芹主要害虫识别与为害症状

