基于腺苷酸活化蛋白激酶/哺乳动物雷帕霉素靶蛋白通路探讨柚皮素对视网膜微血管内皮细胞的损伤机制研究
王海潼, 刘建亮
(1. 潍坊医学院 临床医学院, 山东 潍坊, 262500; 2. 潍坊医学院附属医院, 山东 潍坊, 261041)
糖尿病是一种慢性疾病,其特征是由胰岛素不敏感或胰岛素缺乏引起的高血糖和神经血管损害[1]。糖尿病视网膜病变(DR)是糖尿病常见的微血管并发症,可引发不可逆的视网膜损伤。随着糖尿病患病率的增加,预计到2045年, DR患者的人数将增加到6.28亿,将造成巨大的公共卫生负担[2]。自噬是一种广泛存在于真核细胞中,通过溶酶体途径清除聚合的大分子、错误折叠的蛋白质和受损的细胞器,实现物质循环和合成新蛋白质的功能,可维持细胞生存和稳态以应对各种环境[3]。研究[4]表明, DR病理改变如炎性反应、神经变性等与异常自噬相关。腺苷酸活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)是调控自噬的重要通路之一, AMPK、mTOR是自噬过程中重要的分子靶点,参与调节原代视网膜细胞的自噬,缓解DR发展[5]。柚皮素(NAR)是一种天然黄酮类化合物,大量存在于柑橘类水果中,其特征为生物利用度高、低细胞毒性以及显著的抗炎和抗氧化作用,因此具有广阔的临床应用前景[6]。XUE B等[7]研究发现NAR可改善高糖(HG)诱导的视网膜内皮细胞凋亡和氧化应激,改善细胞受损,具有抗多种类型内皮细胞损伤的治疗潜力,但其能否通过调节AMPK/mTOR通路介导的自噬发挥对HG诱导的人视网膜微血管内皮细胞(HRMECs)治疗的报道较少。本研究探讨NAR对HG诱导的HRMECs损伤的影响及作用机制,现报告如下。
1 材料与方法
1.1 细胞来源
人视网膜微血管内皮细胞(HRMECs)(武汉普诺赛生命科技有限公司)在含有10%胎牛血清、100 U/mL青霉素和100 g/mL链霉素中培养,并将培养基置于37 ℃、5% CO2和95%的室内空气中孵育。
1.2 主要材料及仪器
Sigma公司提供NAR、结晶紫溶液; 索莱宝有限公司提供CCK-8试剂; MedChemExpress公司提供AMPK激活剂AICAR; Corning提供Transwell小室; 酶联免疫有限公司提供白细胞介素(IL)-1β、IL-6和肿瘤坏死因子-α(TNF-α); 上海生工生物技术有限公司提供引物序列; Abcam公司提供p-AMPK、p-mTOR、AMPK、mTOR、LC3Ⅱ、LC3Ⅰ及p62一抗。Thermo Fisher Scientific公司提供Multiskan MK3酶标仪; 尼康提供C2激光共聚焦荧光显微镜。
1.3 细胞分组及处理
将HRMECs随机分成5个处理组,即对照组(培养基中加入5 mmol/L D-葡萄糖)、HG组(向培养基中加入30 mmol/L的D-葡萄糖[8])、HG+NAR组(向培养基中加入30 mmol/L D-葡萄糖和3 mg/L NAR[9])、HG+AICAR组(向培养基中加入30 mmol/L D-葡萄糖和1 mmol/L AICAR[10])、HG+NAR+AICAR组(向培养基中加入30 mmol/L D-葡萄糖、3 mg/L NAR和1 mmol/L AICAR)。将所有组的平板孵育48 h并进行指标检测。
1.4 CCK-8法检测细胞增殖
将处理过的HRMECs以每孔5×103细胞的密度接种在96孔板中,并根据CCK-8试剂说明书进行检测: 向每个孔中加入10 μL CCK-8试剂,然后将细胞在37 ℃下孵育4 h。利用酶标仪检测450 nm处的吸光度,分析细胞活力。
1.5 Transwell实验检测细胞迁移
将采用不含基质胶的Transwell上室进行Transwell迁移试验: 将100 μL的浓度为1×104的细胞悬液的无血清培养基中加入Transwell的上室,将600 μL 10%含血清培养基加入下室。48 h后,弃去培养基,采用4.0%多聚甲醛在室温下固定细胞10 min, 并采用0.1%结晶紫染色20 min。在AM6000显微镜下进行拍照,并对每个样品的5个随机视野进行迁移细胞计数。
1.6 酶联免疫吸附试验(ELISA)检测上清液中炎症因子水平
收集细胞上清液,取100 μL上清液测定IL-1β、IL-6和TNF-α的浓度。取上清液,加入捕获抗体,孵育1 h后洗涤,去除未结合的物质,加入生物素标记的检测抗体,然后加入链霉亲和素-HRP化学发光检测试剂,温育30 min后,用洗涤缓冲液洗涤平板3次,使用酶标仪检测吸光度值,并基于标准品的线性回归曲线测量每种细胞因子的浓度。
1.7 实时荧光定量聚合酶链反应(qRT-PCR)检测LC3 mRNA和p62 mRNA表达水平
使用Trizol试剂从培养的HRECs中提取总RNA。采用TransScript Green miRNA RT SuperMix进行逆转录,并在7900HT快速实时系统上采用SYBR-Green PCR Master Mix试剂盒对产物进行定量,以GAPDH为内参进行归一化处理,结果采用2-△△Ct值比较目的基因相对表达差异。引物序列见表1。
1.8 蛋白质免疫印迹(Western blot)检测AMPK/mTOR通路及自噬相关蛋白表达水平
使用含有1%蛋白酶和磷酸酶抑制剂的放射免疫沉淀分析缓冲液从HRMECs中提取总蛋白。在使用比辛可宁酸测定法对蛋白质浓度进行定量后,将30 μg蛋白质行12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,随后转移到聚偏二氟乙烯膜上。将膜在室温下封闭2 h, 然后在4 ℃下用第一抗体孵育过夜,在室温下用相应的第二抗体孵育2 h。使用增强化学发光试剂观察印迹并分析蛋白表达水平。
1.9 统计学分析
2 结 果
2.1 NAR通过AMPK/mTOR通路对各组细胞增殖变化的影响
与对照组相比, HG组细胞活力增加; 与HG组相比, HG+NAR组细胞活力下降, HG+AICAR组细胞活力增加; 与HG+NAR组相比, HG+NAR+AICAR组细胞活力增加; 与HG+AICAR组相比, HG+NAR+AICAR组细胞活力下降; 上述组间差异均有统计学意义(P<0.05)。见表2。
表2 各组细胞增殖变化
2.2 NAR通过AMPK/mTOR通路对各组细胞迁移变化的影响
与对照组相比, HG组细胞迁移数增加; 与HG组相比, HG+NAR组细胞迁移数下降, HG+AICAR组细胞迁移数增加; 与HG+NAR组相比, HG+NAR+AICAR组细胞迁移数增加; 与HG+AICAR组相比, HG+NAR+AICAR组细胞迁移数下降; 上述组间差异均有统计学意义(P<0.05)。见表3、图1。
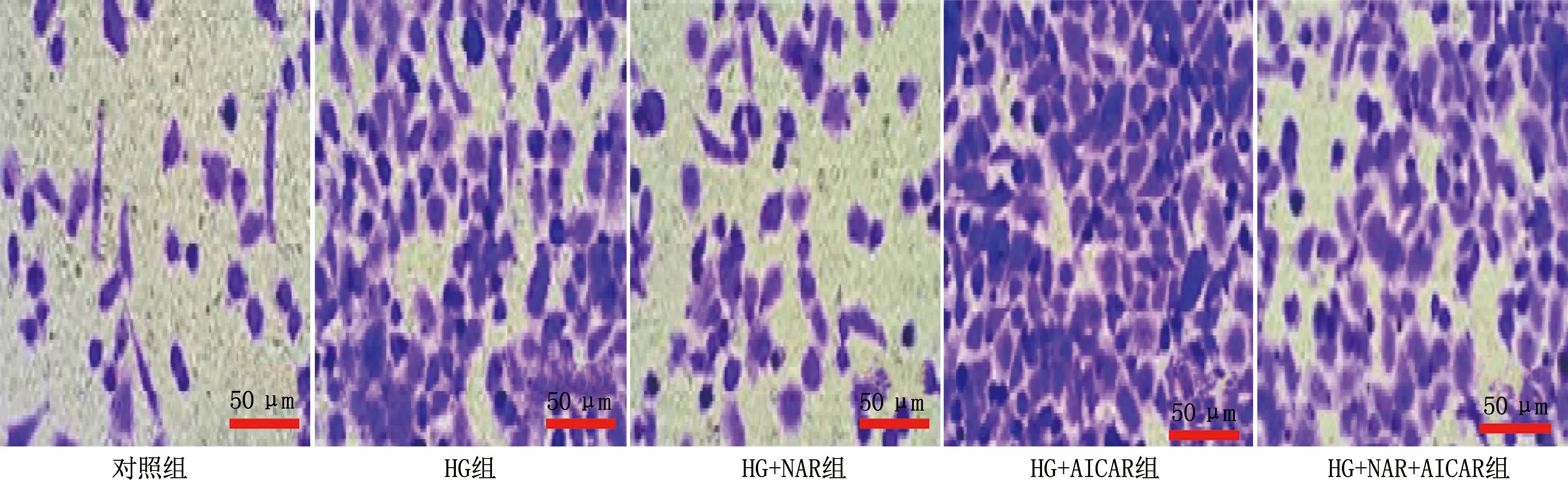
图1 各组细胞迁移变化图(放大100倍)
表3 各组细胞迁移数变化
2.3 NAR通过AMPK/mTOR通路对各组细胞炎症因子水平的影响
与对照组相比, HG组IL-1β、IL-6和TNF-α水平增加; 与HG组相比, HG+NAR组IL-1β、IL-6和TNF-α水平下降, HG+AICAR组IL-1β、IL-6和TNF-α水平增加; 与HG+NAR组相比, HG+NAR+AICAR组IL-1β、IL-6和TNF-α水平增加; 与HG+AICAR组相比, HG+NAR+AICAR组IL-1β、IL-6和TNF-α水平下降; 上述组间差异均有统计学意义(P<0.05)。见表4。
表4 各组细胞IL-1β、IL-6和TNF-α水平变化 pg/mL
2.4 NAR通过AMPK/mTOR通路对各组细胞LC3 mRNA及p62 mRNA表达水平的影响
与对照组相比, HG组LC3mRNA表达增加,p62mRNA表达下降; 与HG组相比, HG+NAR组LC3mRNA表达下降,p62mRNA表达增加,但HG+AICAR组LC3mRNA表达增加,p62mRNA表达下降; 与HG+NAR组相比, HG+NAR+AICAR组LC3mRNA表达增加,p62mRNA表达下降; 与HG+AICAR组相比, HG+NAR+AICAR组LC3mRNA表达下降,p62mRNA表达增加; 上述组间差异均有统计学意义(P<0.05)。见表5。
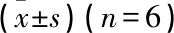
表5 各组细胞LC3 mRNA及p62 mRNA表达水平变化
2.5 NAR对各组细胞通路及自噬相关蛋白的表达水平的影响
与对照组相比, HG组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ表达增加, p-mTOR/mTOR、p62表达下降;与HG组相比, HG+NAR组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ表达下降, p-mTOR/mTOR、p62表达增加,但HG+AICAR组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ表达增加, p-mTOR/mTOR、p62表达下降; 与HG+NAR组相比, HG+NAR+AICAR组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ表达增加, p-mTOR/mTOR、p62表达下降; 与HG+AICAR组相比, HG+NAR+AICAR组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ表达下降, p-mTOR/mTOR、p62表达增加; 上述组间差异均有统计学意义(P<0.05)。见图2、表6。

A: 对照组; B: HG组; C: HG+NAR组;D: HG+AICAR组; E: HG+NAR+AICAR组。
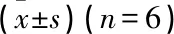
表6 各组p-AMPK/AMPK、p-mTOR/mTOR、LC3Ⅱ/LC3Ⅰ及p62蛋白表达比较
3 讨 论
近年来,糖尿病发病率逐年快速上升,已成为继心脑血管疾病和肿瘤之后的危害人类健康的第三大慢性非传染性疾病[11]。DR是糖尿病引起的严重并发症之一,也是糖尿病患者致盲的主要原因[12]。目前的临床实践中,对DR的治疗主要集中在预防上,包括系统管理和控制患者的高脂血症、高血糖以及高血压,并通过减少血管渗漏保护视力,然而其治疗效果并不令人满意,并且受副作用的限制[13]。
NAR是一种天然存在于柑橘类水果中的生物类黄酮,具有广泛的药理作用,并对代谢综合征、骨再生、神经疾病、心血管疾病等发挥重要作用[14]。早期研究[15]表明, NAR可通过抑制视网膜细胞的凋亡预防大鼠视网膜缺血/再灌注损伤,提示NAR具有保护眼缺血性疾病的治疗潜力。在链脲佐菌素诱导的糖尿病大鼠视网膜病变中[16], NAR通过抗糖尿病、抗细胞凋亡及抗氧化,防止DR中的视网膜损伤,从而限制神经变性。在糖尿病大血管和微血管病变的研究中,大量炎症因子参与了DR的发展[17]。本研究以30 mmol/L葡萄糖诱导HRMECs损伤,结果发现细胞活力、迁移数、IL-1β、IL-6和TNF-α水平显著增加,与既往研究结果[18]一致; 经NAR处理后,细胞活力、迁移数、IL-1β、IL-6和TNF-α水平被显著抑制,提示NAR可缓解HG诱导HRMECs损伤,但其作用机制尚不明确。
自噬是指吞噬自身的细胞质蛋白或细胞器并将其封装成囊泡,与溶酶体融合形成自噬溶酶体,进而降解自噬内含物的过程,在进化中其高度保守,并对细胞物质的降解和循环至关重要[19-21]。自噬障碍可能对细胞具有致命的后果,并导致一些眼部疾病,如青光眼、年龄相关性黄斑变性等眼病,且研究[22]表明自噬参与了DR的发展。AMPK/mTOR/ULK是一条经典自噬通路, p62、LC3是自噬过程中重要的标志物[23-24]。本研究发现, HG组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ、LC3mRNA表达显著增加, p-mTOR/mTOR、p62蛋白及mRNA表达显著下降,表明AMPK/mTOR通路被激活,自噬水平增加,细胞发生炎症损伤。经NAR处理后, p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ、LC3mRNA表达显著下降, p-mTOR/mTOR、p62蛋白及mRNA表达显著增加,炎症水平降低,推测NAR可通过抑制AMPK/mTOR通路来降低炎症反应,抑制细胞自噬,减轻细胞受损。本研究以通路激活剂AICAR进行验证,结果表明NAR可减轻HG诱导的HRMECs损伤,其机制可能与抑制AMPK/mTOR通路介导的自噬有关。
综上所述, NAR通过抑制AMPK/mTOR通路介导的自噬而减轻HG诱导的HRMECs损伤,为NAR用于临床治疗DR提供依据。

