脾脏血管平滑肌瘤一例
杨佩涛,张安红,张瑞昕,张丽,徐钧
1.山西医科大学 第一临床医学院,山西 太原 030001;2.山西医科大学第一医院 肝胆胰外科及肝脏移植中心,山西 太原 030001
血管平滑肌瘤(angioleiomyoma,ALM)是一种少见的良性周细胞(血管周围)肿瘤,主要由分化良好的平滑肌和血管成分构成,临床以及影像学表现均缺乏特异性,诊断较困难,容易误诊。本文对我院诊治1 例的脾脏ALM患者的临床资料进行总结,并结合文献复习,现报道如下。
病例
患者女性,28岁,主诉“体检发现脾大2年余,上腹胀2月余”于2021年11月入山西医科大学第一医院,查体发现脾大,脾肋下可触及,呈Ⅱ°肿大。入院后查血常规示术前Hb为83 g/L,肝功能、肾功能、凝血功能、传染病系列及肿瘤标志物等指标均无异常。既往曾于1996年接受“右纵膈淋巴管瘤切除术”,术后恢复良好。2018年11月于山西医科大学第二医院接受剖宫产术时行B超检查发现脾大,未予重视。后于山西省人民医院复查腹部彩超示:脾脏体积增大,最大径约19.9 cm,脾实质内可见多发局灶性改变,未见明显血流信号(图1)。2021年10月于北京大学人民医院查CT示脾脏体积增大,大小约15.6 cm×6.6 cm,内可见多发大小不等的不规则低密度灶,部分病灶边缘可见钙化,较大者约4.5 cm×3.3 cm,动脉期可见有中度强化分隔,余部分未见明显强化,静脉期仍可见明显不规则低密度区(图2)。诊断建议:脾大并发脾内多发局灶性病变,需鉴别淋巴管瘤及其他。2021年11月25日于我院行PETCT检查结果(图3)示:脾脏体积增大,内可见多发囊状低密度影,其内可见多处点状钙化影,代谢未见明显异常,考虑脾脏淋巴管瘤(部分结节内不规则钙化灶,多系陈旧性出血后改变)。结合术前影像学资料,术前诊断为:(1)脾淋巴管瘤;(2)中度贫血。于2021年12月1日在行全麻下行腹腔镜下全脾切除术(图4),术中可见脾周轻度粘连,脾脏质韧,大小约19 cm×15 cm×10 cm,可见大小不一突出表面囊实性结节,部分为灰白色,分离粘连后完整切除脾脏。手术顺利,术后病理结果提示(图5):肿瘤组织由许多密切交通的腔隙构成,腔隙被覆扁平内皮细胞,部分管腔内可见红细胞及粉染液,其间可见少量平滑肌组织。免疫组化结果:CD34(血管+)、D2-40(-)、EGR(+)、P53(-)、Ki67(+1%)、CK(-)、SMA(+)、HMB45(-)。病理临床诊断为:血管平滑肌瘤。术后予补液、抗感染、抑酸、止疼等对症治疗。病情稳定后出院,1个月后来院复查,行腹部彩超未提示明显异常。随访至术后12个月,患者一般情况良好,未见复发。
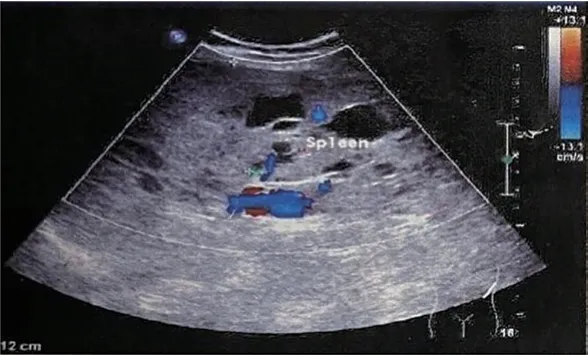
图1 脾脏ALM术前彩超:脾实质内可见多发较高回声结节,边界清,形态规则,未见明显血流信号
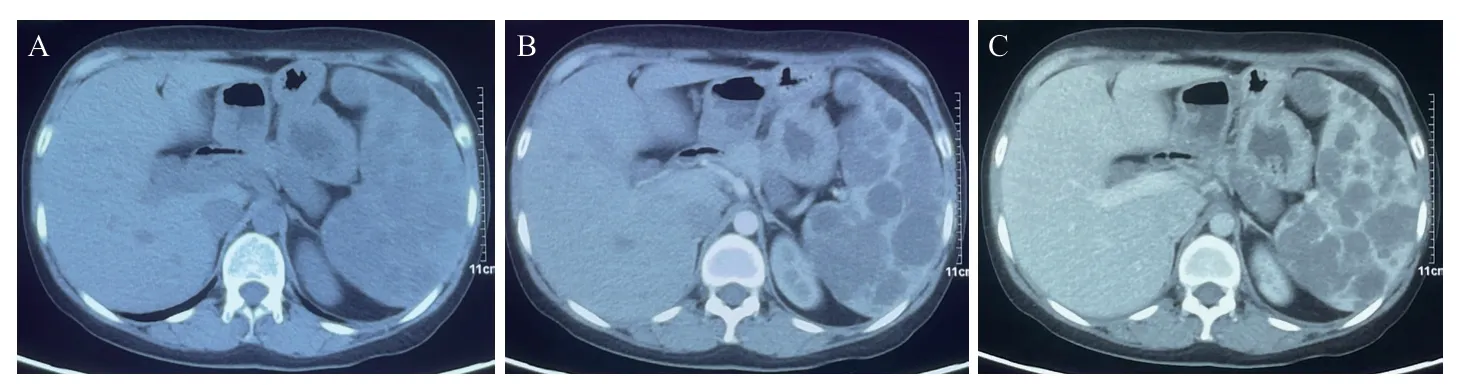
图2 脾脏ALM术前CT

图3 脾脏ALM术前PET-CT:脾脏体积增大,内可见多发囊状低密度影,其内可见多处点状钙化灶,代谢未见明显异常

图4 腹腔镜下全脾切除术术中探查:术中见脾周轻度粘连,脾脏质韧,表面可见大小不一囊实性结节。
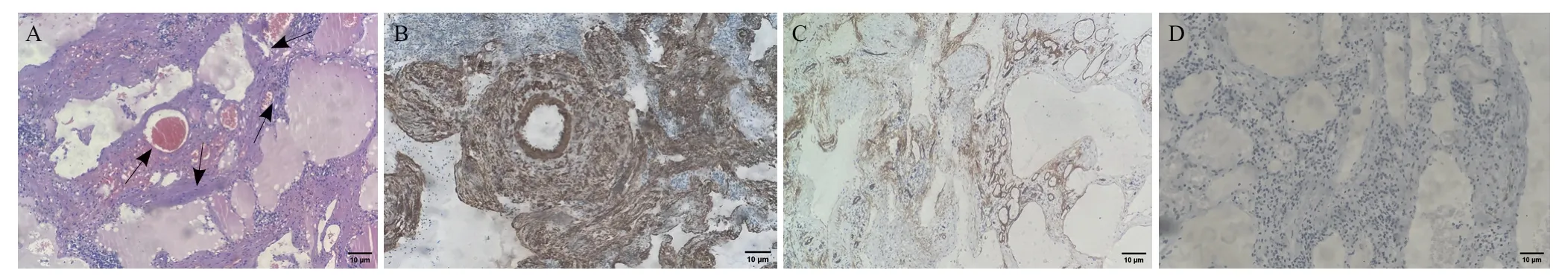
图5 脾脏ALM术后病理图片
讨论
起初ALM被认为是一种平滑肌肿瘤,世界卫生组织(WHO)在2013 年将其归类为周细胞(血管周围)肿瘤。ALM的发病年龄高峰在40~60岁。临床上,该疾病通常表现为下肢孤立、生长缓慢、坚硬、偶有疼痛的皮肤肿块。ALM主要发生于女性[1],有文献报道,其大小和疼痛程度与月经周期、妊娠相关,考虑该肿瘤具有激素依赖性[2]。该病可以发生在人体的各个部位,最常见于下肢[3],其次是头颈区[4-5],其中颅内、口腔内均有文献报道,发生于腹腔内器官如肝脏、小肠及直肠等部位[6-8]的ALM则更为罕见。而发生在脾脏的ALM,在PubMed、ScienceDirect、中国知网和万方数据库平台检索到的相关中英文文献仅有2 例文献报道,其中一例发生于45岁女性,肿瘤大小8 cm×8 cm×7 cm,行脾脏切除术,免疫组化SMA(+)、CD34(+)、CD21(-)、S100(+)[9],另一例发生于一只猫头鹰猴[10]。
在组织发生方面,目前大多数学者认为ALM起源于静脉血管壁的中膜,也有部分学者认为ALM是一种血管畸形[11],或者是从血管瘤到实质平滑肌瘤的中间过程[5]。发病机制方面,最新研究表明,ALM的发病通常伴随着两种基因突变模式:第一种的特点是存在易位t(4;5)(p12;q32),产生CARMN::TXK嵌合体;第二种是Xq22的反复重排,导致IRS4过度表达[12]。在动物实验中,提示N-亚硝基乙基脲类化合物可能会诱导脾脏ALM的发生[13]。
临床诊断方面,常表现为寒冷导致的突发性疼痛,猜测可能与寒冷导致的平滑肌主动收缩缺血有关[14]。但并非特异性表现,如本病例即表现为腹胀,猜测由肿大的脾脏组织压迫周围内脏器官引起。该病的确诊主要是依靠术后的组织检查及免疫组化。ALM的典型镜下观察为大量扩张的血管,夹杂梭形细胞和无弹性蛋白的胶原带。血管腔周围的平滑肌纤维排列成规则的环状图案。无序分布的平滑肌细胞核呈雪茄状,胞浆嗜酸性,很少观察到有丝分裂、细胞学异型性、坏死或多形性。有学者为了加深临床以及病理医师对于ALM的认识,将ALM按病理学形态分为3种类型[15]:(1)实性/毛细血管型,这是最常见的类型,平滑肌紧实,有许多小的、裂隙状的血管通道,这类肿瘤在女性中的发病率是男性的3倍;(2)静脉型,该类型肌壁较厚,平滑肌束排列不紧密,常见于男性;(3)海绵型,该类型最不常见,由扩张的血管通道和少量平滑肌束组成,也多见于男性。本研究报道的病例属于静脉型。
免疫组化结果中,上皮膜抗原(epithelial membrane antigen,EMA)、血清酸性结合蛋白蛋白S100、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和结蛋白desmin的表达通常呈阴性,平滑肌肌动蛋白(smooth muscle actin,SMA)及CD34或CD31分别是肌肉细胞和血管内皮细胞的标志物,这些特异性的免疫组化结果对于该病诊断及鉴别诊断是必须的[16]。既往有报道CD34 阴性的ALM,推测免疫组化结果错误或者未明确指出可能存在的CD31(+)[17]。
影像学检查方面,磁共振检查(MRI)对于诊断ALM有一定价值,ALM病灶在T1 加权成像上呈与骨骼肌等强度的均匀低信号,实体型和静脉型ALM的T2 加权图像信号不均一,呈等信号或稍高信号,而海绵状ALM表现为高信号,含钆对比剂注射后呈非均匀增强[17]。有学者建议,在T2加权MR图像上,若肿块呈高信号和等信号的混合信号并且肿块边缘呈低信号,应考虑诊断为血管性平滑肌瘤[18]。B超图像下,ALM通常表现为椭圆形、边界清楚、均匀的低回声肿块。其中在灰阶图像上,静脉型明显呈低回声,实体型则呈等回声。彩色多普勒超声成像上,静脉型血流信号丰富,实体型血流信号就相对匮乏,与该亚型的镜下表现也相符。因此,B超检查在鉴别该疾病亚型时有一定价值[19]。ALM的CT术前诊断极为困难,表现为密度不均匀,结节强化不均匀的不规则型肿块[20],尽管表现不典型,但随着三维重建技术的发展,CT成像技术仍然不可或缺,它可以提供更为详细、逼真、立体的图像,使择期手术切除更为准确,减少手术创伤及手术并发症的发生。
治疗手段及预后方面,单纯切除是ALM的首选治疗方案。手术切除可以缓解患者的临床症状,并且鉴于该疾病的高误诊率,手术切除可以进行精确的病理学检查以明确诊断。此外,曾有案例报道血管平滑肌瘤进展为血管平滑肌肉瘤,因此延误或者不当治疗会增加ALM恶变的风险[21],需要及时积极治疗。该病术后预后良好,复发率极低,既往文献未见人类ALM复发案例。建议切除后对患者进行一年随访[22]。目前有研究表明,抑制PI3K/MYOCD(磷脂酰肌醇3激酶/心肌素)信号通路可能通过调控AKT、Bcl-2 蛋白降低ALM细胞的增殖和侵袭能力[23],该研究为ALM的治疗提供了新思路。
鉴别诊断方面,应该根据ALM发生的部位进行鉴别,发生于皮下者,应与其他皮肤或皮下软组织肿瘤如错构瘤、脂肪瘤、表皮囊肿、异物肉芽肿等进行鉴别;发生于颅内者,应与脑膜瘤、神经鞘瘤等进行鉴别;发生于腹腔内,应与血管平滑肌脂肪瘤、黏液样肉瘤、淋巴管瘤等疾病鉴别。曾经有学者认为ALM是一种错构瘤性病变[24-25],但是目前的观点认为错构瘤即血管平滑肌脂肪瘤,是由发育畸形的厚壁血管、成熟的脂肪及平滑肌组织构成,本例患者术后病理并未报道发现脂肪组织,且免疫组化HMB-45阴性,因此诊断排除错构瘤可能。此外,我们认为ALM发生于脾脏时应与脾脏淋巴管瘤鉴别,但两者临床表现及影像学表现均无特异性,实际在临床工作中鉴别难度较大,主要依靠术后免疫组化结果相鉴别。D2-40(+)是囊性淋巴管瘤的特征性表达[26],是诊断淋巴管瘤不可或缺的免疫组化结果,本例患者术后免疫组化D2-40为阴性(见图5D)。作为黏液样肉瘤的标志性组化结果,本病例S-100表达阴性,故排除黏液样肉瘤[27]。
总之,ALM是一种罕见的良性肿瘤,发生于脾脏的更是非常罕见,该病不同的分型在治疗上均首选完整切除病灶,手术效果良好。虽然该病的术前诊断较困难,但临床医师仍然需要对病灶进行充分的术前评估,积极完成术前检查,避免误诊的情况出现,以最小的代价恢复患者的身体健康。

