固定化菌剂对邻苯二甲酸酯的降解效能及途径
陆雯逸,王泽铭,左翔之,刘奕翔,武海涛,高彦征(南京农业大学,土壤有机污染控制与修复研究所,江苏 南京 210095)
邻苯二甲酸酯(PAEs),俗称酞酸酯,是一类人工合成有机物,主要作为增塑剂被广泛应用于塑料、包装、化妆品、润滑剂和香料等商品的生产当中[1].目前,全球PAEs 的年产量约3 亿t,预计2050 年将达到5亿t[2],而中国已成为世界上最大的增塑剂消费国,仅2017 年消费额就占世界消费总量的42%[3].PAEs 与塑料制品间没有稳定的化学键结合,因此其会不断的从塑料制品中渗透、蒸发而出,进入土壤、水、大气等环境介质中[4].残留在土壤或水体等环境介质中PAEs 可通过食物链、呼吸、皮肤接触等途径进入人体[5].研究表明,人体直接接触大剂量的PAEs 或长期累积低剂量的PAEs 会对生殖系统、肝脏和肾脏等器官产生不良影响,遗传物质也可能受到损伤[6-8].
自然环境中的PAEs 难以被非生物降解,因此微生物降解被认为是降解PAEs 最经济有效的方法[9].为获取高效降解PAEs 的微生物,很多研究者针对PAEs 污染环境中的微生物开展了筛选与分离工作.如Wu 等[10]从河床沉积物中分离出的一株苍白杆菌(Ochrobactrum sp.),可在48h内能将邻苯二甲酸二丁酯(DBP)完全矿化,且对其他种类的PAEs 同样具有高效的降解能力.Wang 等[11]寻找到一株红球菌(Rhodococcus sp.),其可以在7d 内降解96.4%的邻苯二甲酸二(2-乙基)己酯(200 mg/L).从污染环境中提取PAEs 降解菌显然是一种行之有效的方法.但是,目前已筛选出的降解菌株,大部分只能把PAEs 转化为邻苯二甲酸单酯(PMEs)或邻苯二甲酸(PA),甚至有的菌株仅参与共代谢过程[12].研究发现很多细菌仅对单一组分的PAEs 具有较强的降解能力,面对实际环境中多种PAEs 共存的局面,使用单一菌株难以达到良好的修复效果.复合菌群作为一种多菌体共存的生物群体,菌株之间可以通过协同代谢作用有效降解环境中的多种有机污染物.马永见等[13]从某污染场地中筛选分离出3株具有PAEs降解能力的菌株,将其按照一定的比例构建成新的复合菌群,与单菌株相比,复合菌群能在更短的时间内降解PAEs.此外,在协同代谢过程中,一些细菌对复杂有机物的生物降解产物可能会为群落中的其他细菌提供生物降解所需的简单分子[14].Vega 等[15]从污染土中筛选出两株降解菌,利用它们的特性构建新的菌群,实现了对邻苯二甲酸二甲酯(DMP)的完全矿化.Wu 等[16]从活性污泥中分离纯化出戈登氏菌(Gordonia sp.strain JDC-2)和节杆菌(Arthrobacter sp. strain JDC-32)两株降解菌,发现JDC-2 能迅速将DOP 转化为PA,而菌株JDC-32 能将PA 进一步分解.由此可见,与单一功能菌株相比,菌群中不同细菌之间的协同代谢可提高环境中PAEs 的消减.但目前,仍缺少一组能同时降解多种PAEs 的复合菌群,以应对实际环境中的多污染场景.
此外,为了提高微生物的环境适应能力,增强对污染物的去除效果,微生物的固定化技术得到了越来越多的关注[17-18].在国内,固定化微生物技术已被应用于修复农药、石油及多环芳烃等有机污染物污染土壤,在实际的污染修复工程应用中表现出极大的优势[13,19].而载体材料始终是研究的重点之一.元妙新[20]、段淑伟等[21]研发的微生物包埋固定技术都能成功去除土壤中的有机污染物,且修复效果优于游离菌.载体材料对环境的友好性有待进一步提高.生物炭既解决了农林废弃生物质的处理工作,又可提高土壤的保水功能,提高土壤有机质含量,有望成为更加理想的微生物固定化载体.
本研究尝试将具有不同PAEs 降解能力的多个菌株进行复配,构建具有PAEs 降解广谱性的功能菌群.以生物炭为载体,采用吸附法研制固定化菌剂,研究固定化菌剂降解环境中PAEs 的效能及途径.旨在为PAEs 污染环境的微生物修复提供参考.
1 材料与方法
1.1 材料
1.1.1 主要试剂 邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸正辛酯(DnOP)纯度为99.0%,购于上海阿拉丁生化科技股份有限公司.6 种PAEs 的基本理化性状见表1.甲醇为色谱纯级别.
1.1.2 供试菌株 菌株为课题组已有的PAEs 高效降解菌:谷氨酸杆菌(Glutamicibacter sp. A4),保藏编号为 CCTCC M20221850;芽孢杆菌(Bacillus sp.W34)[22];红球杆菌(Rhodococcus sp. 2G)[23],保藏编号为CCTCC M2015056.供试菌株的形貌见图1,A4 的系统发育树见图2.
图1 菌株的透射电镜图Fig.1 Transmission electron micrograph of the strain
图2 A4 的系统发育树Fig.2 Phylogenetic tree of A4
1.1.3 培养基 所用的培养基为LB 培养基和无机盐培养基,具体配方如下:LB 培养基:NaCl 10.0g/L,进口蛋白胨10.0g/L,进口酵母粉5.0g/L.无机盐培养基(MSM):(NH4)2SO41.50g/L, KH2PO40.50g/L,K2HPO4·3H2O 1.91g/L,NaCl 0.5g/L, MgSO4•7H2O 0.20g/L.所有培养基在使用前均在高压灭菌锅中121℃灭菌20min.
1.2 复合菌群的构建
分别将菌株A4、2G、W34 接种到LB 液体培养基中,置于30℃,150r/min 摇床中振荡培养24h.将菌液8000r/min、4℃离心5min,弃去上清液;用已灭菌的MSM 对菌体反复冲洗2~3 次,再次离心收集菌体.用MSM 将菌体制备成菌悬液,OD600调整到1.0.拮抗实验结果发现A4、2G、W34 不存在拮抗反应,因此按照1:1:1 的比例进行复配,4℃冰箱备用.
1.3 固定化菌剂的制备
1.3.1 固定化载体生物炭的制备 前体材料清洗后置于烘箱内,105℃杀青30 min,然后在55℃条件下烘烤24h,干燥后用粉碎机打碎.在氮气气氛条件下,以5 ℃/min的升温速率,达到600℃后恒温2h 烧制为生物炭,冷却后研磨过60 目筛.将获得的炭材料先用0.1%的HCl 溶液进行清洗,除去热解过程中产生的焦油和灰分,接着用超纯水冲洗多次后烘干.
1.3.2 固定化菌剂的制备 称取1.5g 生物炭于50mL 锥形瓶,灭菌后冷却至常温,加入15mL 复合菌群的菌悬液,置于30℃、150r/min 的恒温震荡培养箱内固定24h,随后5000r/min 离心5min,弃上清液.用灭菌的MSM 液体洗涤2~3 次,离心收集下层固体.置于25℃下干燥,即为本文所用固定化菌剂.
1.3.3 游离菌和固定化菌剂降解能力的验证 向灭菌的锥形瓶中加入PAEs 混标,使得6 种PAEs 终浓度均为20mg/L,待甲醇挥发完全后,加入19mL 的MSM 液体培养基,加入1mL 复合菌群的菌悬液,并设置未投加菌液的空白对照,每个处理设置3 个重复.在150r/min、30℃条件下避光培养,分别于培养第1,3,5,7d 测定PAEs 残留浓度.
固定化菌剂降解能力验证实验的处理组为20 mL 的MSM 液体培养基,加入0.1g 的固定化菌剂,其余与游离菌降解实验过程相同.
1.4 固定化菌剂制备条件的优化
1.4.1 固定化时间对固定化菌剂降解PAEs 的影响 在制备固定化菌剂的过程中,将样品置于恒温振荡培养箱内培养不同的天数:1,2,3d,将制备完成后的固定化菌剂投加于20mL无机盐培养基中,加入PAEs,使6 种PAEs 终浓度均达到20mg/L,30°C、150r/min 条件下培养7d 后取出,用HPLC 测定培养基中PAEs 残留量,确定最佳固定化时间.
1.4.2 菌料比对固定化菌剂降解PAEs 的影响 在确定最佳固定化天数的基础上,在制备固定化菌剂的过程中向1g 生物炭中加入不同的菌液量:10,20,30mL,以制备固定化菌剂.剩余步骤同1.4.1 中所述,通过测定培养基中PAEs 残留量确定最佳菌料比.
1.4.3 固定化温度对固定化菌剂降解PAEs 的影响 在最佳固定化时间和菌液用量的制备条件下,分别在25,30,35℃条件下培养以制备固定化菌剂.剩余步骤同1.4.1 中所述方法,通过测定培养基中PAEs残留量确定最佳固定化温度.
1.5 PAEs 降解途径分析
反应体系设置:将PAEs混标加入到100mL灭菌的锥形瓶中,使总PAEs 浓度达到120mg/L,待有机溶剂挥发后加入47.5mL MSM 培养基和2.5mL 菌群菌悬液,置于30℃、150r/min 的恒温震荡培养箱中培养24h,于3,6,12,24h 取样.
HPLC-HRMS 分析样品前处理:使用Cleanert polar-enhanced polymer(PEP)固相萃取柱(500 mg/6 mL,Bonna-Agela Technologies,中国天津)对降解产物进行净化和浓缩.使用前,先用10mL 甲醇活化PEP 小柱,再用5mL 超纯水清洗柱体.然后,将50mL 的降解液以1 mL/min的流速流经PEP小柱,用5mL超纯水清洗.用2mL 甲醇以2mL/min 的流速淋洗PEP 小柱,收集洗脱液,过0.22µm 有机相滤膜,−20℃静置备用.使用HPLC-HRMS 联用方法检测降解产物分子量.
1.6 PAEs 的检测方法
采用LC-20AT 高效液相色谱仪(配有SPD-2A紫外检测器).检测时间为40min,进样系统的进样量为20μL;分离系统以乙腈-水为流动相、初始流速为1.0mL/min,采用梯度洗脱的方式分离PAEs,色谱柱为Φ4.6×250mm Inertsil ODS-P 液相色谱柱,柱温为40℃;检测系统采用紫外检测器检测、开启双波长检测模式,分别为205 和225nm.20mg/L 的6 种PAEs加标回收率范围为80.03%~102.05%,相对标准偏差范围为0.52%~4.36%,实验方法符合要求.
1.7 数据处理
采用Excel 2016 进行数据处理,使用Origin 2018 进行图表绘制.
计算方法为:
式中:CK为无菌对照处理PAEs 的残留浓度;CB为含降解菌培养液或固定化菌剂中PAEs 的残留浓度.
2 结果与讨论
2.1 功能菌群对塑化剂的降解效能
构建的复合菌群对6 种PAEs 具有较好的降解能力.如图3(a)所示,复合菌群对6 种PAEs 总的降解率在第1d 时为60.35%,在第7d 时能达到80.04%.但该复合菌群对不同PAEs 的降解能力有所不同.复合菌群对短链PAEs 降解率在7d 时能高达98.19%,对长链PAEs 在第7d 时降解率仅61.93%.
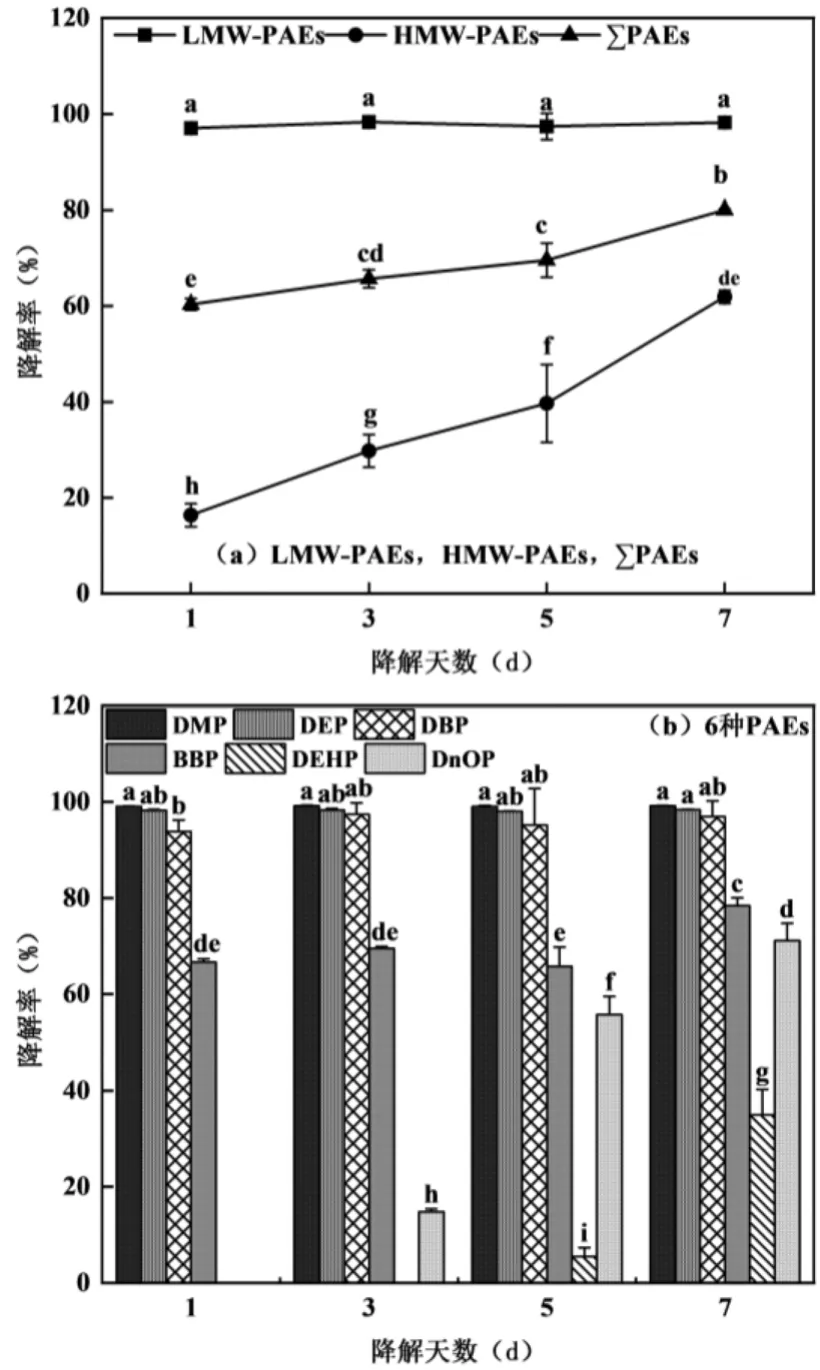
图3 复合菌群对PAEs 的降解率Fig.3 Degradation rate of PAEs by complex flora
如图3(b)所示,复合菌群对DMP、DEP 和DBP的降解能力相对较高,在第1d 时降解率就能达到93.87%以上,对BBP 的降解能达到66.65%,但DEHP和DnOP 的降解率相对较低,在第1d 时几乎不降解;到第7d 时,对DnOP 的降解能达到71.16%, DEHP的降解率为34.99%.6 种污染物中,DMP、DEP 和DBP 作为短链的PAEs 化合物,具有较好的亲水性,更容易与功能微生物发生接触,并且分子结构更加简单,所以更容易被微生物降解;而DEHP 和DnOP分子量较大,水溶性相对较差,则不易被微生物降解[24].但该复合菌群在广谱性方面仍具有一定优势,目前已有的报道几乎未见对6 种PAEs 均具有降解的菌群.例如Zhang 等[25]将Arthrobacter sp. SLG-4和Rhodococcus sp. SLG-6 复配构建了一个新的菌群,其仅对DMP、DEP、DBP 和DnOP 具有较好的降解能力.Lu 等[26]用Microbacterium sp. PAE-1 和Pandoraea sp. PAE-2 组建的菌群仅能降解DBP.相较于前人研究,本文所构建的PAEs 降解菌群具有更好的广谱性.
2.2 固定化菌剂对塑化剂的降解效能
如图4(a)所示,固定化菌剂对6 种PAEs 总的降解率在第1d 时就能达到70.58%,在第7d 时能达到90.21%,比游离菌群降解率提高了10.17%.固定化菌剂对短链PAEs 降解率在7d 时能高达98.39%,对长链PAEs 在第7d 时降解率能达到80.10%,比游离菌群降解率提高了18.17%.固定化提高了微生物的细胞密度和耐受性,因而提高了降解效率.根据赵暹等[27]的研究,将复合菌群DP3 通过包埋法制备而成的固体菌剂,降解同等浓度的污染物所需时间仅为游离菌的一半.SEM 扫描发现菌群被复合材料包埋吸附在凝胶球内部,为微生物提供了生存空间,因而增强了物质交换效率.本研究以生物炭作为载体,不仅能扩充微生物的生存空间,其中的有机质,以及氮、磷和钾等元素还可为菌群的生长提供营养物质,进而提高微生物的密度[28].可见固定化可有效提高复合菌群的生存质量,进而提高对污染物的降解效能.

图4 固定化菌剂对PAEs 的降解率Fig.4 Degradation rate of PAEs by immobilized bacterial agent
如图4(b)所示,固定化菌剂对6 种PAEs 的降解效率均有升高,其对DMP、DEP、DBP 的降解在第1d 时均能达到96.31%以上,对BBP 的降解率在第1d 时能达到74.61%,较游离菌提高了7.96%;对DEHP 和DnOP 在第1d 时就有降解能力.特别是对于游离菌无法利用的DEHP,固定化菌剂在7d 内对DEHP 的降解率高达76.17%,比游离菌高了1.18 倍.这可能是由于生物炭自身的多孔结构和丰富的官能团,使其能够吸附污染物,增加了亲水性差的污染物与微生物的接触几率,进而提高了功能菌群对DEHP 的降解[28].以上结果显示,制备的生物炭固定化菌剂对PAEs 的降解具有广谱性和高效性.
2.3 固定化菌剂制备条件优化
固定时间的优化结果如图5 所示.固定温度为30℃ ,菌料比为1:10,固定1~3d 后,固定化菌剂对总PAEs 的降解率在80.66%~84.99%,当固定时间为2d时,该固定化菌剂对总PAEs的降解效果最优.当固定时间为2d时,固定化菌剂对长链PAEs的降解率最高,达到70.44%,而固定时间为1,3d 时,其对长链PAEs的降解率仅63.98%、61.42%.这是因为,如果固定化时间短,载体对微生物的吸附效果不佳,吸附的微生物数量较少;固定化时间过长,微生物的生长可能处于衰亡期,活性好的微生物数量减少[29].因此选择适宜的固定时间能够综合微生物的吸附效果与健康生长.固定化菌剂制备的最优固定时间为2d.
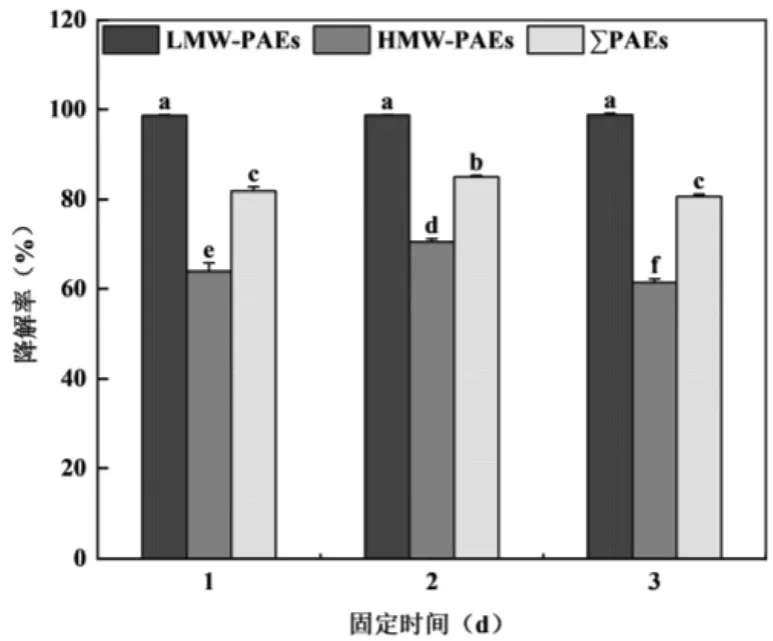
图5 固定时间对固定化菌剂降解PAEs 的影响Fig.5 Influence of fixed time on the degradation of PAEs by immobilized bacterial agent
在最佳固定化时间的基础上,探究不同的菌料比对PAEs 降解效果的影响,结果如图6 所示.向1g生物炭中加入30mL 菌液时,固定化菌剂对PAEs 的降解效果略高于菌液用量为10和20mL时的降解效果,对总PAEs 的降解率可达到94.18%.如图6 所示,当菌料比为1:10、1:20(V/M)时,固定化菌剂对长链PAEs 的降解率仅76.76%、80.26%,而当菌料比为1:30(V/M)时,固定化菌剂对长链PAEs 的降解效果有所提升,降解率高达89.47%.与马伶俐[30]研究结果一致.由于在降解过程中,数量过少的微生物难以应对高浓度的污染物,但当微生物数量较多时会引发种群间对氧气和营养物质的竞争,阻碍负载在生物炭中微生物的生长,从而影响固定化菌剂的降解效能[31].固定化菌剂制备最优菌料比为1:30(V/M).

图6 菌料比固定化菌剂降解PAEs 的影响Fig.6 Influence of bacteria-material ratio on the degradation of PAEs by immobilized bacterial agent
当固定化时间为2d,菌料比为1:30 时,探究该固定化菌剂的最佳固定温度,结果如图7 所示.当温度为30℃时,固定化菌剂对总PAEs 的降解率最高,可达到96.60%,当温度过高或过低时,固定化菌剂对PAEs的降解能力有所下降.当温度为30℃时,固定化菌剂对长链PAEs 的降解效果最好,降解率可达93.86%.根据张小红等[32]的报道,这是因为微生物降解污染物是一种酶促反应,当温度过高时,酶的蛋白质结构受到了破坏,温度过低时酶的活性不足,对PAEs 的降解率也会有所下降.固定化菌剂最优固定温度为30℃.

图7 固定温度对固定化菌剂降解PAEs 的影响Fig.7 Influence of temperature on the degradation of PAEs by immobilized bacterial agent
固定化菌剂的最优制备条件为:固定化时间2d,固定温度30℃,菌料比1:30(V/M).在该条件下,固定化菌剂对6 种PAEs 总的降解率能达到96.60%,对短链PAEs 的降解率能达到99%以上,对长链PAEs 的降解率也能达到93%以上,具有显著的高效性和广谱性.
2.4 PAEs 的降解途径
DBP 和BBP 作为短链PAEs 和长链PAEs 的代表,解析了功能菌群代谢PAEs 的途径.借助HPLCHRMS 分析检测DBP 的降解产物.如图8(a)所示,功能菌群降解DBP 过程中检测到了5 种代谢产物-邻苯二甲酸二乙酯(DEP)、邻苯二甲酸单乙酯(MEP)、邻苯二甲酸单甲酯(MMP)、邻苯二甲酸(PA)和1,3-异苯并呋喃二酮(IBF).赵真真[33]在研究微生物降解DBP 时发现,微生物可先将DBP 转化成了DEP 继而进一步将其转化为PA,酯的水解是DBP 主要的生物降解过程.最终推测DBP 的降解路径如下:首先经微生物β-氧化作用形成DEP,然后去酯化形成MEP,再通过脱甲基反应形成MMP,在酯酶作用下水解形成PA,然后芳香环开环后进入三羧酸循环,最后矿化成CO2和H2O.
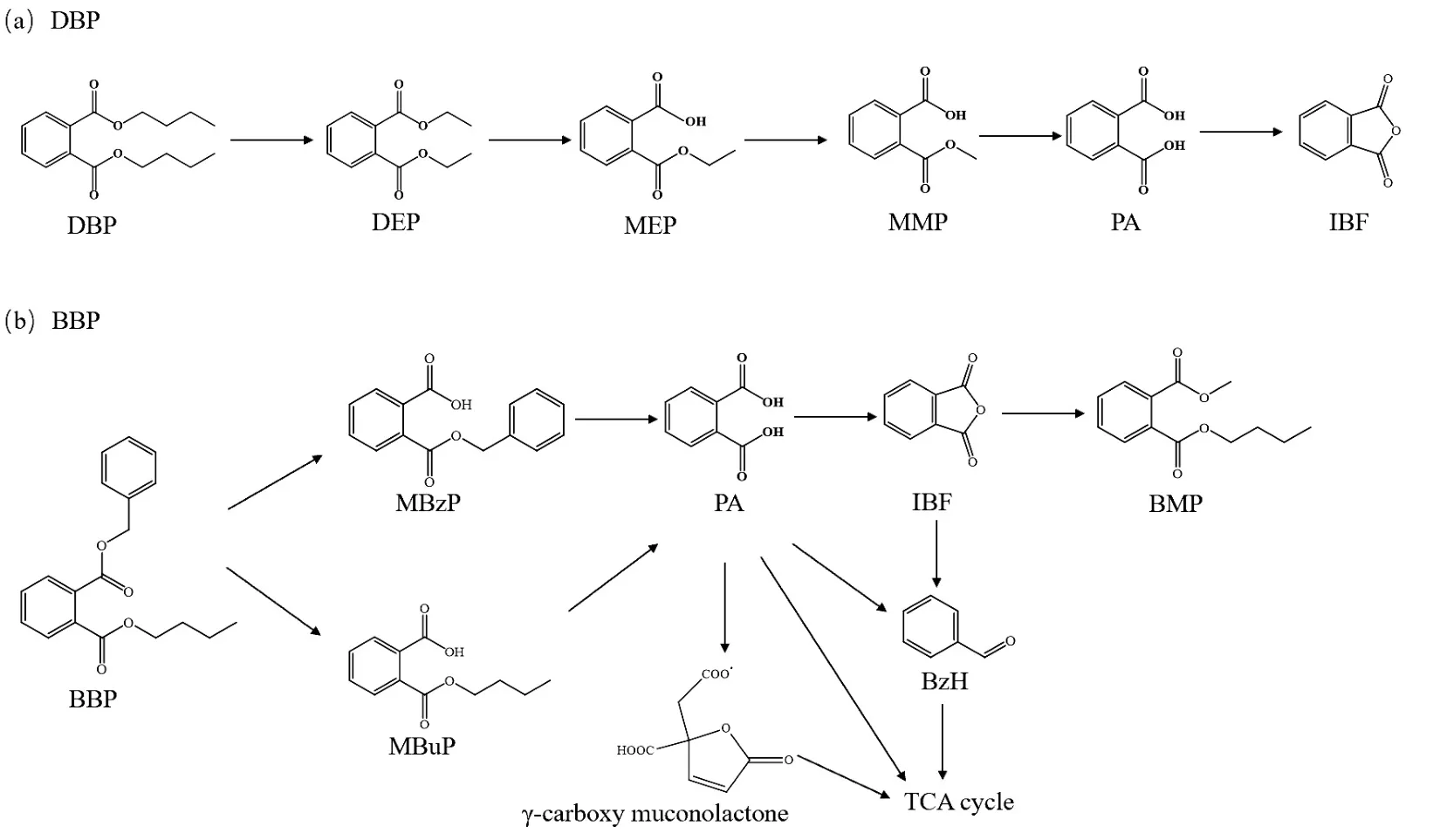
图8 推测生物降解的途径Fig.8 The proposed biodegradation pathways
如图8(b)所示,功能菌群降解BBP 的过程中主要检测出7 种代谢产物包括:邻苯二甲酸单苄酯(MBzP)、邻苯二甲酸单丁酯(MBuP)、邻苯二甲酸(PA)、1,3-异苯并呋喃二酮(IBF)、邻苯二甲酸二甲氧基乙酯(BMP)、苯甲醛(BzH)和γ-羧基粘康酸内酯(γ-carboxy muconolactone).大部分产物在此前就有所报道.Chatterjee 等[34]分离获得一株具有BBP 降解功能的革兰氏阳性细菌MTCC 4818,该菌株降解BBP过程中产生中间产物主要为MBuP和MBzP.Xu等[35]在红树林沉积物中分离出一株荧光假单胞菌B-1,其在降解BBP 过程中主要降解产物为MbuP、MBzP、PA 和BzA.最终推测BBP 降解路径为:在微生物的作用下, BBP 通过去酯化形成了MBzP 和MBuP,这两种物质经过去酯化形成了PA.推测PA的分解共有4 条途径,第1 条途径是经过脱水缩合反应形成IBF, IBF 在微生物酯酶的作用下会与体系中的甲醇发生酯化反应形成BMP,也可能转化成BzH 进入三羧酸循环;第2 条途径是PA 直接转化成BzH 进入三羧酸循环;第3 条途径是PA 直接进入三羧酸循环;第4 条途径是PA 转化成γ-carboxy muconolactone 进入三羧酸循环.
3 结论
3.1 通过单菌复配获得一组具有PAEs 降解高效性和广谱性的功能菌群,该菌群7d 内对总浓度为120mg/L 的6 种PAEs 降解率为80.04%;以生物炭为载体,采用固定化技术制备了固定化菌剂,菌剂最优制备条件为:温度30℃、固定化时间2d、菌料比1:30(V/M),固定化菌剂对总PAEs 的降解率可达到96.60%,比游离菌提高了16.56%.
3.2 功能菌群通过β-氧化、去酯化和脱甲基反应等过程将DBP 最终矿化成CO2和H2O;而BBP 在功能菌群的作用下先经过去酯化形成MBzP 和MBuP两种中间产物,然后再进一步通过酯化形成PA,最后进入三羧酸循环.酯的水解作用是PAEs 重要的生物降解过程.

