农田土壤中邻苯二甲酸酯降解功能细菌及其应用
李鹏飞,周 贤,王 建,高彦征(南京农业大学土壤有机污染控制与修复研究所,江苏 南京 210095)
邻苯二甲酸酯(PAEs)是一类具有内分泌干扰特性的环境雌激素,即便在极低的浓度下也会干扰人和动物的内分泌系统,从而影响有机体的繁殖、新陈代谢、成长等生物过程,并产生致突变、致畸和致癌等效应[1].为了有效保护生态环境和人类健康,美国环保署和欧盟已将 DMP、DEP、DnOP、DBP、DEHP、BBP 列入优先控制污染物.2018 年,我国生态环境部颁布的《土壤环境质量建设用地土壤污染风险管控标准(试行)》已经将DnBP、DEHP、DnOP 作为优先污染物列入控制名单.我国农田土壤中PAEs 主要来源于农用地膜、肥料、污泥农用、污水灌溉等,由于PAEs 具有较高的辛醇-水分配系数,进入土壤后容易吸附于土壤颗粒物上,从而导致农田土壤污染[2].更为严重的是,土壤中的PAEs 可以通过土壤-作物系统进入食物链,从而威胁人类健康和生态系统安全[3].因此,了解全国范围内农田土壤PAEs 污染现状,对于制定农田土壤PAEs 污染标准、研发污染控制技术等具有重要意义.
在长期受PAEs 污染的农田土壤中存在大量具有PAEs 降解能力的功能细菌[4].目前,科研工作者已从污染农田土壤中分离获得大量具有PAEs高效降解能力的功能细菌,在其降解广谱性、代谢途径及关键功能基因等方面开展了深入研究.研究表明,将分离获得功能细菌直接应用施入土壤中可有效降低土壤中PAEs 的含量.本文综述了我国农田土壤PAEs 污染现状,主要总结细菌降解PAEs 的途径、机制及应用等,以期为我国PAEs 污染农田土壤功能细菌修复及农业生产安全提供理论和技术参考.
1 PAEs 的基本性质及污染现状
环境中的PAEs 可通大气干湿沉降、污水灌溉等途径进入农田土壤.此外,污泥农用、化肥、农膜等使得农田土壤成为环境中PAEs 主要的汇.其中,农膜的使用是造成我国农田土壤大面积PAEs 污染的主要原因[5].表1 列举了目前已报道的常见PAEs 化学信息和物化性质参数.当前,我国农田土壤中PAEs 的浓度一般在几个μg/kg到几十个mg/kg 之间.农田土壤PAEs污染已对我国农田土壤环境及农产品质量安全产生了一定威胁[7].我国农田土壤中PAEs 含量普遍高于其他国家.调查显示,丹麦农田土壤中PAEs 的浓度范围为14~2500μg/kg[8].研究人员发现英国农田土壤中Σ6PAEs 含量最高仅为99μg/kg[9].

表1 PAEs 及代表性物质的化学信息和物化性质参数[6]Table 1 Chemical information and physicochemical property parameters of PAEs and representative substances[6]
由表2 可以看出,我国各地农田土壤都不同程度的受到了PAEs 污染,而不同的区域、省份农业土壤中PAEs 浓度存在着较大的差异,如天津市菜地土壤中∑6PAEs 总含量为0.050~10.40mg/kg,而广州市菜地土壤中Σ6PAEs 总含量最高仅为1.140mg/kg;其中,宁夏菜地土壤、贵州烟草地土壤和新疆棉田土壤中Σ6PAEs 的总含量远超于其他地区.由此可见,我国大部分地区农田土壤中均能检测出PAEs,含量水平不一,对人体存在健康隐患.李玉双等[10]选取了沈阳市蔬菜基地的农田土壤为研究对象,分析了采集土壤样品中PAEs 含量和类型,结果发现约30%的样品中PAEs 的总含量超过1mg/kg, DBP和DEHP 在所有的样品中均被检测出,是当地农田土壤中主要的污染物. Kong 等[12]选取了天津市郊区不同农用类型的土壤为研究对象,分析了6 种PAEs 分布情况.结果表明:菜地土壤中PAEs 含量最高,可达到10mg/kg.DBP 和DEHP 是我国农田土壤中检出率和浓度最高的两种PAEs 单体化合物.不同农田用地类型中PAEs 含量存在一定差异,菜地土壤中的PAEs 含量通常高于稻田和果园地,其差异性可能源于城市化水平、农膜的使用和污水灌溉等[29].Feng 等[15]分析了江苏省蔬菜样品中PAEs 的含量,结果发现,蔬菜样品中PAEs 单体以DEHP 和DnOP 为主,这可能与农田土壤中PAEs 的含量有关.另外,DEHP 和DnOP 的分子结构相对复杂,在水中的溶解度较低,且不易挥发,较难被微生物降解,同时其在作物体内难以被代谢分解,呈现出明显的富集特征.当前,我国大多数农田土壤中PAEs 的人群健康致癌风险和非致癌风险均低于健康风险规定的可接受上限,整体而言处于相对安全状态[30-31].但也有研究表明,我国某些地区部分农田土壤DEHP 残留浓度较高(最高可达25.05mg/kg),存在较高的致癌风险[32-33].由于我国尚未制定农田土壤PAEs 控制标准,参照美国土壤PAEs 化合物控制标准,我国农田土壤DBP 含量的平均值全部超标.因此我国亟需制定农田土壤PAEs 污染控制标准,以保障农业生产安全和人类健 康.

表2 国内部分地区农田土壤中PAEs 污染现状(mg/kg)Table 2 Concentration PAEs in the agriculture soil of different regions in China(mg/kg)
2 PAEs 的降解
2.1 PAEs 降解细菌
PAEs 在自然界中难以水解和光解,微生物是其自然消减的主要途径.研究表明,PAEs 污染农田土壤中存在大量经自然驯化具有PAEs 降解能力的微生物[34],其中细菌被认为是PAEs 自然降解的主要微生物.当前国内科研工作者关于PAEs 降解细菌主要开展了PAEs 高效降解菌株富集、筛选与鉴定;PAEs降解功能菌群构建;细菌降解PAEs 的途径及机制等方面的研究.
自1975 年Engelhardt 等[35]首次报道PAEs 降解功能微生物以来,科研工作者已从不同环境介质中分离纯化获得大量具有PAEs 降解功能的菌株(表3).目前,研究纯化获得的菌株主要来源于以下菌属,如鞘氨醇单胞菌(Sphingobium) 、 假单胞菌(Pseudomonas)、节杆菌(Arthrobacter)、根瘤菌(Rhizobium)、甲基杆菌属(Methylobacillus)、红球菌(Rhodococcus)、戈登氏菌(Gordonia)、伯克氏菌(Burkholderia)等.从表3 可以看出,不同降解菌属对 PAEs 表现出不同的降解效果和降解谱.Tao等[43]从土壤中分离到一株具有PAEs 高效降解能力的假单胞菌属菌株DNE-S1,该菌株能在碱性条件下降解DEP,并发现Fe3+可以通过表达邻苯二甲酸二氢二醇脱氢酶(ophB)和邻苯二甲酸二氧合酶-铁氧还蛋白还原酶(ophA4)基因来促进DNE-S1对DEP 的降解.Fe3+的存在使DEP(500mg/L,12h)的降解率提高了14.5%. Zhao 等[50]从农田土壤中分离出一株能够以多种PAEs 为底物的降解细菌农霉菌MT-O,该菌株在pH 值为7.2,温度为29.6℃和接种量为OD600=0.2 的条件下,7d 内可将初始浓度200mg/L 的DEHP 几乎完全降解.目前关于PAEs 降解细菌的研究多在高底物浓度下开展,而实际污染农田土壤中PAEs 含量较低,因此,将来应重点关注低浓度PAEs 条件下细菌降解能力的研究,进而利用纯化获得PAEs 降解菌株用于污染农田土壤修复.

表3 PAEs 降解细菌及其降解效果Table 3 PAEs-degrading bacteria strains and their effects
2.2 PAEs 降解菌群
当前,分离筛选的功能细菌主要是对一种或少数几种PAEs 具有降解能力,而在实际污染环境中往往是多种PAEs 共存,且实际污染环境条件较为苛刻、土著群菌竞争力较强,单一菌株降解土壤中PAEs 仍存在很大的局限性.降解细菌在自然环境中往往以菌群形式存在,利用不同细菌之间的协同作用来完全降解环境中的有机污染物,为自身生长繁殖提供能量.于是,科研工作者尝试利用功能菌群中不同菌株的协同互作实现PAEs 的广谱和高效降解.
如表4 所示,目前已报道的PAEs 降解菌群主要分为两种:一种是直接从受污染的环境中富集培养得到的.例如,Kou 等[53]从长期覆盖地膜的农田土壤中分离出一组由Comamonadaceae sp.、Achromobacter sp.和Pseudomonas sp.组成的细菌菌群K1.在最优条件下,K1 对DEHP 的降解率可达99%以上,并发现K1可以快速矿化DEHP、DMP、DEP 及其代谢中间体,从而实现环境中常见PAEs的无害化处理.此外,K1具有广泛的环境适应力,在PAEs 污染的复杂环境中具有巨大的潜力和优势.而另一种是由两种或者两种以上的PAEs降解菌株人工构建而成.Wu等[57]从活性污泥中分离的Gordonia sp.菌株JDC-2 和Arthrobacter sp.菌株JDC-32 可以通过微生物的生化协同作用完全降解DOP,其中菌株JDC-2 可以将DOP 快速的降解为PA,但却无法进一步利用PA;而菌株JDC-32 可以降解PA,但不能降解DOP.而通过将JDC-2 和JDC-32 共培养,有效克服了各自单独降解DOP 的限制,实现了DOP 的降解.Lu 等[58]采用富集法分离了获得一组由Microbacterium sp. PAE-1 和Pandoraea sp.PAE-2 组成的菌群,该菌群可以通过生化合作完全降解DBP.并从PAE-1 菌株中克隆出两个酯酶基因DpeH 和MpeH,其中DpeH 只能将二烷基PAEs 水解为相应的单烷基PAEs,单烷基PAEs 再被MpeH 水解为PA;而PAE-2 菌株主要负责PA 的降解.显然,与单一菌降解相比,复合菌群可以在一定程度上克服单一菌降解不彻底和降解谱窄等问题.因此,构建更多有效的复合菌群,有望实现污染农业土壤中PAEs 的经济高效去除,具有较为广阔的应用前景.

表4 PAEs 降解复合菌群Table 4 Bacterical consortia for PAEs biodegradation
2.3 PAEs 降解途径
目前,单一菌降解PAEs 的降解途径已经比较完善.如图1 和图2 所示,细菌降解PAEs 主要分为两个阶段:第一阶段是PAEs 的水解,将PAEs 转化为中间产物PA;第二阶段是PA 的开环裂解,最终降解成小分子物质[62].在PAEs 降解的第一阶段中,主要方式有去酯化和 β-氧化,其中去酯化为主要途径.PAEs 先经过多次去酯化反应转化为邻苯二甲酸单酯(MAPs),再进一步生成PA.而β-氧化途径是先经过多次氧化,将PAEs 氧化为邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二甲酯(DMP),随后又经过去酯化途径,将其水解为PA.

图1 邻苯二甲酸酯的水解途径[62]Fig.1 Hydrolysis pathway of phthalates[62]
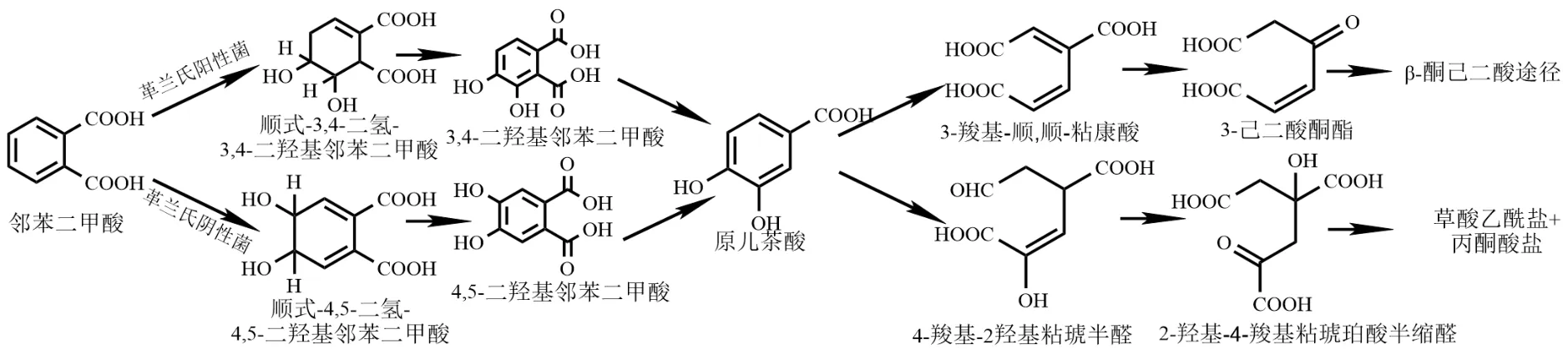
图2 邻苯二甲酸的好氧降解途径[62]Fig.2 Aerobic degradation pathway of phthalic acid[62]
PA 是PAEs 降解过程中的重要代谢产物之一.由于G+菌(革兰氏阳性菌)和G-菌(革兰氏阴性菌)的降解酶基因不同,所以PA 降解途径也存在着差异[63].对于G+菌而言,首先,邻苯二甲酸经过邻苯二甲酸3,4 双加氧酶的氧化,生成了顺式-3,4-二羟基-3,4-二氢邻苯二甲酸,随后经过脱氢作用,进一步得到4,5-二羟基邻苯二甲酸,接着再通过脱羧生成PCA.而G-菌则是在邻苯二甲酸的4、5 号位碳上发生氧化反应和脱氢反应生成4,5-二羟基邻苯二甲酸,最后再通过脱羧形成PCA.而PCA 又存在两种不同的开环途径,分别为正位开环途径和偏位开环途径.经正位开环途径,PCA依次被转化为3-羧基-顺,顺粘康酸和3-己二酸酮酯,又经过β-酮己二酸途径转化为琥珀酸和乙酰辅酶A,从而进入三羧酸循环.在偏位开环途径中,PCA 却在4,5 双加氧酶的作用下,依次被降解成4-羧基-2-羟基粘琥珀酸半醛和2-羟基-4-羧基粘琥珀酸半缩醛,随后经过多次酶促反应,最终生成草酰乙酸和丙酮酸,分别进入三羧酸循环和糖酵解途径.
2.4 PAEs 降解基因和酶
与此同时,众多学者对PAEs 降解的遗传机制也开始进一步研究,这些研究主要集中在对参与PAEs 水解酶的研究和从PA 到PCA 降解的酶基因进行克隆和鉴定.Xu 等[64]分离了一株枯草芽孢杆菌BJQ0005,对其进行基因组测序,发现共表达了 18 种水解酶.其中酶 GTW28-09400 和酶GTW28-13725 实现了PAEs 单酯键的水解,而酶GTW28-17760 能够破坏DBP 和DEHP 的二酯键,说明它是一种二酯键水解酶.从Rhodococcus sp.LW-XY12 中克隆获得的水解酶KXC42-04905,该酶可以有效降解DEHP 和MEHP(邻苯二甲酸单(2-乙基己基)酯);水解酶KXC42-04905 可以通过氢键和疏水相互作用与DEHP 和MEHP 结合,酶中的一个催化三联体(Ser195-Glu319-His412)可能作为一个活性蛋白口袋,从而催化DEHP 的水解[65].
对于邻苯二甲酸到原儿茶酚降解的途径,由于细菌的降解酶不同,所以G+菌和G-菌的PA 降解途径也存在着差异.在G+菌中编码的是3,4-二羟基邻苯二甲酸的脱氢酶和脱酸酶,而在G-菌中编码的是4,5-羟基邻苯二甲酸的脱氢酶和脱酸酶.目前已经报道的 G+菌中负责降解 PA 的降解基因见表5.Eaton 等[66]率先报道了PA 降解基因簇是来源于G+菌 Arthrobacter keyseri 12B 的 pht 操纵子(phtBAaAbAcAdCR),并在A. keyseri 12B 中,克隆出了一个130kb 的质粒编码邻苯二甲酸的完全代谢,确定了pht 操纵子负责编码PA 到PCA 转化,pcm 操纵子编码从PCA 到丙酮酸和草酰乙酸的代谢,pehA基因编码PAEs 水解酶,tnpR 基因编码转座子解离酶,ptr 操纵子可能编码PA 或PCA 或PAEs 的转运蛋 白.

表5 已报道的革兰氏阳性菌中PA 的降解基因Table 5 Reported degradation genes for PA in gram-positive bacteria
由于降解酶不同,因此编码的基因也存在差异,表6 列出了目前已经报道的革兰氏阳性菌中负责降解PA 的降解基因.Chang 等[72]率先发现了DBO1 中参与从PA 到PCA 的基因,其中ophA1 和ophA2 可能共同编码PA双加氧酶还原酶,ophD负责编码4,5-二羟基邻苯二甲酸脱羧酶,ophB 负责编码PA 二氢二醇脱氢酶.Wang 等[44]通过基因组测序技术,在DNHP-S2 菌株的染色体上发现了一个完整的PCA分解代谢基因簇,由8 个基因(pcaBLIJCHG-fadA)和4 个调节基因(IclR-LysR-GntR-LysR)组成.并发现该菌株能以PCA 为唯一碳源时高效生长,这表明该菌株可能无法通过先前表征的邻苯二甲酸酯双加氧酶系统将PA 转化为PCA,但它却可以完全降解PCA.因此,推测可能存在其他途径利用PA,或者PA可以通过脱羧生成BA(邻苯二甲酸酐).随后又发现该菌株携带了CoA 转移酶基因,与其他已报道的CoA 转移酶同源性为49.03%~75.04%,与PA 脱羧成BA 一致.因此,该基因簇编码的MFS 转运蛋白可能负责介导BA 的转运.

表6 已报道的革兰氏阴性菌中PA 的降解基因Table 6 Reported degradation genes for PA in gram-negative bacteria
2.5 PAEs 降解菌在污染土壤修复中的应用
随着研究的不断深入,科研工作者验证了功能微生物对治理PAEs 污染土壤的效能. Wang 等[46]从长期受PAEs 污染菜地土壤中富集分离获得一株具有DEHP 高效降解功能的红球菌属细菌WJ4,将菌悬液浓度为0.8 的WJ4 加入到DEHP 污染浓度为1.0g/kg 的土壤中,置于28℃黑暗条件下培养21d,处理结束后土壤中DEHP 去除率高达55%,而对照土壤中DEHP 的去除率仅为4.2%.赵真真[62]从污水处理厂中筛选出了两株可以降解PAEs 的菌株,分别为Microbacterium panaciterrae USTB-Y和Comamonas guangdongensis USTBZA1,将其复配构建为复合菌群USTB-YA,将该菌群接种至初始浓度为50mg/kg 的DBP 污染土壤中,研究了菌群对DBP的消减效能.结果表明:在灭菌处理组中,接种复合菌群YA 的土壤样品中的DBP 在24 和48 内分别降低了49.1%和89.5%,而在未接菌处理中仅为2.5%和6.0%,其降解率分别提高了46.6%和83.5%.总体而言,当前从土壤中驯化的菌株或复配构建的菌群在实际污染土壤修复中具有较大应用潜力.然而,令人遗憾的是,当前大多数研究仅停留于实验室模拟阶段,功能细菌在实际污染农田土壤治理中的应用效能仍不明确,尚存在着较多的限制因素.例如,营养物质作为微生物生长必不可少的重要因素,在利用微生物修复污染农田土壤过程中,虽然部分污染物可被微生物利用,但仍然无法满足微生物的生长繁殖所需的所有能量,从而影响菌株的繁殖和存活.此外,在纯培养条件下复合菌群的菌株之间可以相互协作,但实际污染农田土壤中土著微生物竞争力较强,对添加的外源菌群稳定性影响较大,甚至因与土著微生物竞争处于劣势而被淘汰.因此,如何将有效提高功能微生物与土著菌群的竞争力,促进外源菌群与土著菌群之间的相互协作,进而提高功能微生物原位修复效能,是科研工作者将来亟需的瓶颈问题.
3 总结与展望
总结了农田土壤中PAEs 污染现状、降解功能细菌及其应用.从PAEs 污染农田土壤中富集筛选的降解细菌具有不同的降解特征,细菌降解PAEs 首先进行水解产生中间产物PA,然后将PA 开环裂解,最终降解成小分子物质.与单一功能菌株相比,自然驯化或人工构建的功能菌群具有PAEs 降解高效性、广谱性和竞争能力,在实际污染农田土壤修复中具有广阔的应用前景.将来需要在以下几个方面开展相关研究.
(1)现阶段关于PAEs 降解细菌的研究主要集中于实验室,很少应用于实际农田土壤的降解.考虑到农田土壤环境的复杂性,PAEs 降解菌在实际农田土壤修复中应用还需要进一步验证.
(2)复合菌群是利用细菌降解PAEs 的研究热点之一.将来可借助高通量测序、稳定同位素示踪、环境宏基因组学、宏转录组学等现代分子生物学技术手段,明确菌群中不同菌株间协同互作的机制,进而筛选构建具有PAEs 降解靶向性和高效性的菌群,实现复合菌群在实际污染农田土壤修复中的应用.
(3)因此,在今后的研究中,需要微生物学家、生物地球化学家、农学家、土壤学家和建模者进行紧密的跨学科合作,从环境适应性、降解酶、降解基因和菌株协同共生等角度继续深入研究,并结合工程学、高通量测序和基因组学等方法,建立合适的定量模型,构建具有环境适应性强、降解谱广、降解能力的强的功能菌群.总之,利用功能细菌削减农田土壤PAEs 污染是一种低成本、绿色和切实可行的方法,可为我国污染农田土壤的资源化再利用、保障农产品生产安全和人类健康提供重要技术参考.

