温度影响下Anammox-DAMO 系统N2O 产消机制及调控
韩梦茹,楼菊青,徐 帆(浙江工商大学环境科学与工程学院,浙江 杭州 310018)
反硝化厌氧甲烷氧化(DAMO)过程可以在厌氧条件下同步实现脱氮和CH4减排.该过程是一种独特的反硝化反应,当硝酸盐或亚硝酸盐作为电子受体被还原为N2的同时, CH4作为唯一电子供体被氧化为CO2[1].研究表明,DAMO 过程对海洋沉积物中CH4的消耗减排占据了主导地位,且在湿地[2]、河流[3]、深水湖泊[4]等自然生境以及农业土壤和废水中均存在,该过程在全球碳氮循环的过程中起关键作用.DAMO 微生物最早在淡水沉积物培养物中富集而得,起主导作用的功能微生物可以分为两大类:NC10 门细菌的 Candidatus ‘Methylomirabilis oxyfera’(M. oxyfera)[5]和隶属于 ANME(anaerobic methanotrophic archaea,厌氧甲烷氧化古菌)中的一个簇ANME-2d 的Candidatus ‘Methanoperedens nitroreducens’(M. nitroreducens)[6].其中,DAMO 古菌通常被认为只能将硝酸盐(NO3-)还原为亚硝酸盐(NO2-),因此需要与其他微生物协同作用以达到理想的脱氮效果.目前的研究表明,DAMO 古菌可以与DAMO 细菌协同进一步将NO2-还原为N2[7];同时,也已有研究发现在污水处理厂中DAMO 微生物与厌氧氨氧化(Anammox)细菌共存现象[8],因此可以共培养DAMO古菌与Anammox 细菌形成耦合系统,通过Anammox细菌进一步利用DAMO 古菌产生的NO2-作为电子受体、污水中的NH4+作为电子供体产生N2,从而实现总氮的高效去除和温室气体的减量排放[9].
将硝酸盐型-DAMO与厌氧氨氧化联合应用,能够在两类优势菌种的协同作用下将各种形式的氮转化为N2,同时实现总氮去除和CH4减排[10].然而,在对Anammox-DAMO 耦合系统的研究过程中检测到了N2O,这说明并不是所有的氮都能转化为N2被去除,而是在脱氮过程中生成了N2O 这一中间产物.迄今为止的研究结果没有证据表明厌氧氨氧化细菌在正常代谢过程中会产生N2O[11-13].N2O 作为反硝化过程的中间产物,一般认为在DAMO 过程不会出现,这是因为DAMO 微生物的代谢途径特殊,DAMO 细菌利用NO 歧化酶将NO 转化为N2和O2,产生的O2再对CH4进行氧化,略过了中间体N2O的生成[14].虽然DAMO 微生物中存在编码N2O 生成及降解的基因,但相关研究的实验结果表明DAMO系统中有少量N2O 的产生,然而降解N2O 的基因却未能表达[15].目前关于废水处理过程中N2O 产生的研究大多集中在传统反硝化工艺,鲜少有人将研究聚焦于DAMO、Anammox 等新型脱氮技术.
温度变化会影响与N2O 产消相关的微生物及酶的活性,从而引起N2O 积累量的波动.有研究者利用A/O SBR 反应器探究N2O 随温度变化的产消情况,发现在15℃的低温条件下N2O 排放量比25℃时增加了1.9 倍[16].Anammox 与DAMO 耦合脱氮过程中N 代谢途径较为复杂,不同温度影响下该系统N2O 的产消规律如何变化还有待探究.目前关于污水脱氮工艺中N2O 排放的研究多集中在中低温条件,然而在某些特定的气候条件下高温也会显著影响废水处理效果.本文以Anammox-DAMO 系统为研究对象,探究中、高温影响下该系统的性能与N2O产消变化规律,通过分子生物学手段及动力学机制探明N2O 产消的代谢途径,并提出N2O 减排策略.
1 材料与方法
1.1 试验装置
批次试验使用内径7.0cm、高14.0cm,有效容积为250mL 的厌氧子反应器(图1);连续试验使用内径16cm、高30cm、容积为3.5L 的厌氧母反应器[17].反应器所有取样口均设有阀门,阀门关闭时,反应器呈全封闭状态,维持反应器内厌氧状态,整个反应过程中使用磁力搅拌器进行连续搅拌,保证反应器内泥水混合均匀.
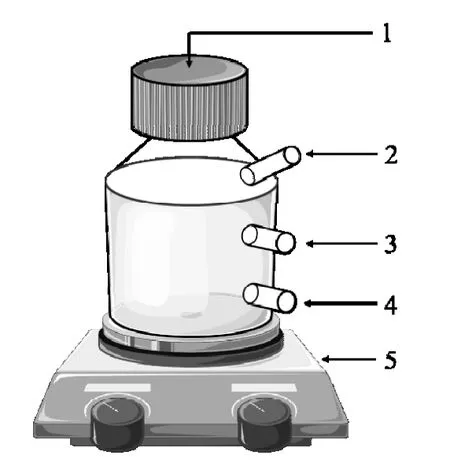
图1 试验装置Fig.1 Test device diagram
1.2 接种污泥与营养液
试验系统为以Anammox 菌和DAMO 古菌为优势菌种的Anammox-DAMO 系统,以西湖底泥、杭州西溪河底泥与农田水稻土壤的混合污泥为接种物,在厌氧条件下供给CH4、NO3-和 NH4+,试验期间系统运行稳定.
营养液新鲜配制,使用前氮吹30min 以排除O2,组成如下:KH2PO40.05g/L;CaCl2·2H2O 0.3g/L;MgSO4·7H2O 0.2g/L;NaHCO31.05g/L;微量元素含量为1.25mL/L.微量元素包括(g/L):15 EDTA,0.43 ZnSO4·7H2O,0.24 CoCl2·6H2O,0.99 MnCl2·4H2O,0.25 CuSO4,0.22(NH4)6MoO24·4H2O,0.19 NiCl2·6H2O,0.067 SeO4,0.014 H3BO3, 0.05 Na2WO4·2H2O[18].营养液以去离子水为溶剂配制.
1.3 试验方法
1.3.1 批次试验 为了研究温度对系统的短期影响,并建立温度影响下N2O 产消动力学模型,进行为期10d 的批次试验.从母反应器中各取 200mL 泥水混合液注入厌氧子反应器中,各子反应器的 NO3-和NH4+起始浓度为 20mg/L,CH4浓度为 80mg/L,pH=7.0,试验温度分别设置为20, 25, 30, 35, 40℃,每组设 3 个平行.试验期间,每 24h 取气样3.0mL,水样3.0mL,经 0.22µm 微孔滤膜过滤后测定NO3--N、NO2--N 及NH4+-N 浓度,同时监测系统中CH4含量以及N2O 浓度变化.
1.3.2 连续试验 基于批次试验结果,筛选出反应效率最优以及N2O 积累量最多的两组具有代表性的温度条件进行连续试验,以揭示温度对Anammox-DAMO 系统的长期影响.以DAMO 微生物倍增周期25d 为一个实验周期进行3 个周期实验,保持各系统pH 值为7.0~7.2.每48h 取各反应器水样5.0mL,气样4.0mL,利用紫外分光光度计和气相色谱仪分别测定NO3--N、NO2--N、NH4+-N、CH4、N2O的含量.以7d 为一个加药周期,每7d 补充一次NO3-、NO2-、CH4.在试验前中后期分别取泥水混合物30mL,热提法提取EPS 提取液后测量含蛋白质(PNs)和多糖(PSs)的胞外聚合物(EPSs)的组成以及浓度变化.在连续试验前、中、后期分别取5mL 污泥样品进行高通量测序分析.
1.4 分析方法
NO3--N、NO2--N 和NH4+-N 浓度使用双束紫外-可见分光光度计(TU1901)按照标准方法测量.使用气相色谱仪(GC2030,岛津)测量顶空N2O 含量以及CH4含量[19].采用pH 计(梅特勒FG2)监测反应器内pH 值的变化.采用热提法分离EPS[20].PNs 和PSs的测定方法分别为福林酚试剂法和蒽酮法[21].通过Usearch 软件和Gold 数据库将剩余序列聚集到操作分类单元(OTU)中.利用E.Z.N.A. ®土壤DNA 试剂盒(Omega Bio-tek,美国)进行样品DNA 抽提进行后续宏基因组测序.Illumina NovaSeq 测序平台用于宏基因组测序[22].
1.5 动力学模型
采用酶动力学方程[23]模拟NO3-、NH4+的还原以及N2O 的产生和还原,如式(1)所示.
式中: RER为酶活性函数; Vmax,R为相应还原酶反应的最大比合成/活化速率,d-1; KE,i为酶诱导的半饱和常数,mg/L; KI,R为相应还原酶抑制系数,mg/L; Ci为底物的水相浓度,mg/L; R 为还原酶(即Nar、Nir、Nos); i 为相应底物(即NO3-、NH4+、N2O); CT为温度变化因素.
2 结果与讨论
2.1 温度对Anammox-DAMO 系统性能及N2O 产消的影响
2.1.1 温度对Anammox-DAMO 系统性能的影响根据厌氧氨氧化微生物和DAMO 微生物的最适生长温度条件[24-25],选择20~40℃进行短期试验,对试验结果进行单因素方差分析.从图2 可见,NO3-、NH4+、CH4的降解速率均随温度的升高先增大后减小,而N2O 的浓度峰值整体呈现先下降后上升的趋势.系统在温度为40℃时,N2O 的浓度峰值达到最大.对温度影响下的批次实验结果进行单因素方差分析,发现40℃温度条件对N2O 排放量的影响最大,另外对各环境因素进行正交实验,结果显示30℃为该系统脱氮性能最优的温度条件,因此将30℃作为对照组,40℃作为实验组进行长期试验研究,以探明不同温度条件下Anammox-DAMO 系统性能及N2O 产消规律.

图2 短期试验温度对Anammox-DAMO 系统污染物降解及N2O 峰值影响Fig.2 Effect of temperature on contaminant degradation and peak concentration of N2O in the Anammox-DAMO system in a short-term test
图3(a)和图3(b)表明, Anammox-DAMO系统在40℃高温条件下的脱氮性能要低于30℃,但随着时间的推移,R2 系统的脱氮性能较前期有提升,这说明该体系可以逐渐适应高温的胁迫,这主要归因于微生物会在极端环境下产生特殊的蛋白质和酶来帮助细胞抵御胁迫.有研究表明[26],瞬时高温冲击会对Anammox 菌的活性产生抑制作用,但长期运行下系统的性能逐渐恢复,这说明Anammox 菌具有缓解高温抑制的内部机制.R2 系统受到高温的影响,在反应过程中出现了亚硝酸盐的积累,平均积累浓度为(1.43±0.47) mg/L.从图3(c)可知,R2 系统中的硝酸盐、氨氮、CH4降解速率均低于R1 系统,说明高温对系统中微生物活性产生了抑制作用,影响了其正常代谢.有研究表明,Anammox 活性(SAA)会随着温度的升高呈现先升高再降低的趋势,温度对Anammox 菌群蛋白质变化情况的影响也说明了Anammox 菌的活性在高温下受到抑制[27].有研究探究了温度对Anammox-DAMO 共培养系统的影响,结果表明温度对耦合系统的影响同样呈先上升后下降的趋势,在高温下微生物活性降低[28-30].

图3 长期试验温度对Anammox-DAMO 系统中污染物降解影响Fig.3 Effect of temperature on contaminant degradation in the Anammox-DAMO system in a long-term test
在两个系统的长期运行过程中均检测到了硝酸盐异化还原为铵(DNRA)反应,DNRA 是一个特殊的生物反应过程,使用亚硝酸盐作为中间物将硝酸盐还原成铵[31-32].在R1 系统中,硝酸盐降解速率为0.08mmol/(L·d),氨氮降解速率为 0.05mmol/(L·d),CH4降解速率为0.04mmol/(L·d),CH4降解速率与硝酸盐降解速率实际比值(1:2.00)与DNRA 反应的理论比值(1:2.10)[33]相符,说明在R1 系统中同时存在DAMO、Anammmox、DNRA 反应.R2 系统中硝酸盐降解速率为 0.06mmol/(L·d),氨氮降解速率为0.04mmol/(L·d),CH4降解速率为0.03mmol/(L·d),也观察到了相同的结果,证明了DAMO、Anammmox、DNRA 反应的共存.
2.1.2 温度对Anammox-DAMO 系统N2O 产消的影响 由图4 可知,2 个系统均观察到了明显的N2O产消,且R2 系统中N2O 的总体累积量大于R1 系统,其中R1 系统 N2O 平均峰值浓度为(4.86±0.30)mg/L,R2 系统为(6.85±0.59) mg/L.
相比于R1 系统,R2 系统产生了更多的N2O,研究表明,在N-DAMO系统中,nrfA的转录水平随亚硝酸盐浓度的增加而显著上调[34],推测在R2 系统中DAMO 古菌为了应对亚硝酸盐的胁迫加剧了DNRA 反应的发生.在高浓度亚硝酸盐影响下DNRA 过程会生成NO,出于对NO 的解毒作用,DNRA将NO转化为N2O[34].Pereira[35]在研究操作条件对厌氧氨氧化系统N2O 产生的影响过程中发现亚硝酸盐是N2O 生成和积累的关键,这主要归因于AOB 中由细胞色素P460(CytL)催化的厌氧羟胺(NH2OH)解毒途径[36].Ding 等[37]也发现N2O 释放率与亚硝酸盐浓度呈正相关,这是因为亚硝酸盐和N2O 会竞争电子,当用于亚硝酸盐还原的电子通量高于用于N2O 还原的电子通量时,N2O 就会积累.同时,在亚硝酸盐和硝酸盐共存的情况下,亚硝酸盐和硝酸盐还原酶之间对电子供体的竞争也可能导致N2O 的不完全还原[38].另外,由于受到高温影响,Anammmox 细菌活性受到抑制,易造成中间产物NO 的积累,为了防止NO 对微生物造成毒害作用,Anammox 细菌将NO 转化为N2O[39],因此在R2 系统中产生更多的N2O.
2.2 温度对Anammox-DAMO 系统N2O 产消过程中EPS 的影响
2.2.1 温度对Anammox-DAMO 系统EPS 变化的影响 EPS 是一种高分子量聚合物,主要由多糖(PS)和蛋白质(PN)组成,可用作保护层,以减弱恶劣环境对微生物的胁迫[40].此外,EPS 在微生物的生物膜形成、粒化和稳定性中起重要作用[41].由图5 可知,两个系统中PN 含量的变化占主导地位,PS 含量整体变化幅度并不明显,PN 含量随着时间的推移先升高后降低,这是由于该体系在试验前期需要通过增加PN含量来维持稳定性.与R1系统不同,在R2系统中,PN含量在中、后期都较初期有更大的增加幅度.

图5 Anammox-DAMO 系统中EPS 含量变化Fig.5 Changes in EPS content in the Anammox-DAMO system
总体而言,R2 系统在中后期PN 和PS 的含量都高于R1系统,随着温度的增加,蛋白质和多糖溶解并从污泥中释放出来.R2 系统中PN 的量要比R1 系统显著高很多(P<0.05),这是由于高温胁迫下导致R2系统产生更多的PN 以适应环境条件.在整个过程中,各组PN 均高于PS,这与其他研究相似[40,42].结果表明,R2系统中期的EPS与初期对比起来有所增加,PS含量稳定在4.9mg/L, PN 含量由6.6 增加到11.3mg/L,可见,相较于PS,高温冲击对PN 的影响程度更大,这主要归因于微生物对恶劣环境的自我保护机制.作为影响细胞表面电荷和疏水性的一个因素,较高的PN 提高了Anammox-DAMO 系统中微生物的粘附性,并减轻了温度冲击对Anammox-DAMO 系统微生物的损伤[43].
R2 系统在高温胁迫下产生更多的EPS,导致N2O 扩散进入细胞内部的传质阻力增加,N2O 还原酶的作用时间缩短使得N2O 排放量升高,这与Sabba等[44]的研究结果一致.
2.2.2 温度对Anammox-DAMO 系统可溶性蛋白影响 图6(a)和6(b)为初期(0d)的三维荧光图,发现发射峰位于300~350nm 处,激发峰位于250~300nm处,通过与其他研究中荧光组分的激发和发射最大值位置进行比较,该范围内显示荧光激发峰的物质为蛋白质[45-47],其中激发峰在250~340nm,发射峰在280~380nm 处主要包含物为酪氨酸和色氨酸[52].激发峰在220~340nm,发射峰在380~520nm 处主要包含物为腐殖酸[47-50].根据实验结果可知初期实验测得的主要物质是酪氨酸/色氨酸.

图6 温度对Anammox-DAMO 系统可溶性蛋白影响Fig.6 Effect of temperature on soluble proteins in the Anammox-DAMO system
从图6(c)中可知,R1 系统三维荧光发射峰位于300~400nm 处,激发峰位于250~350nm 处,主要物质为酪氨酸/色氨酸、微生物代谢物以及多糖.图6(d)显示R2 系统三维荧光发射峰位于300~450nm 处,激发峰位于200~350nm 处,主要物质为酪氨酸/色氨酸、微生物代谢物、多糖以及富里酸.由图中可得出EPS 中蛋白质的荧光强度明显大于多糖、腐殖酸,说明系统中微生物更多的产生蛋白质来适应温度变化对其影响.且R2 系统中期的荧光信号要明显强于初期,并且强于同时期的R1 系统的荧光信号,表明高温会对反应器中的微生物活动产生影响,从而干扰有机物的分泌,产生更多的酪氨酸/色氨酸.有研究表明色氨酸类和酪氨酸类蛋白质物质与N2O 的排放量呈显著正相关关系[51-52],因此R2 系统中更高的N2O 产生量可归因于更多酪氨酸/色氨酸的生成.
从图6(e)可知R1 系统三维荧光发射峰位于300~400nm 处,激发峰位于200~350nm 处,主要物质为酪氨酸/色氨酸、微生物代谢物以及多糖.图6(f)显示R2 系统三维荧光发射峰位于300~400nm 处,激发峰位于250~350nm 处,主要物质为酪氨酸/色氨酸、微生物代谢物、多糖.R2 系统末期的荧光信号与中期相比逐渐减弱,逐渐恢复到初期水平,并与R1 系统的荧光信号无显著性差异,表明R2 中的微生物逐渐适应高温环境,这与系统性能的恶化与恢复趋势一致.
2.3 温度影响下Anammox-DAMO 系统N2O 产消的生物学机制
2.3.1 温度对Anammox-DAMO 系统微生物群落变化的影响 如图7(a)所示,R1 和R2 的优势菌门均为Proteobacteria,且分别占比33%和40%,它是厌氧氨氧化系统常见的一大门类,且有研究表明Proteobacteria 大多数是反硝化细菌, 并且Proteobacteria 中的大部分菌可以参与甲烷氧化过程,普遍存在于污水处理厂脱氮除磷工艺中[53].第二优势菌门是Chloroflexi,分别占比14%和17%,它的作用是在细胞生长过程中降解有机分子或分泌可溶性化合物.在温度的影响下,R2 系统中的Firmicutes、Chloroflexi、Bacteroidetes 和Euryarchaeota 等嗜热微生物丰度上升.相反在高温胁迫下Actinobacteria和Ignavibacteriae 的丰度相比R1 有所下降,说明高温环境不利于其生存.

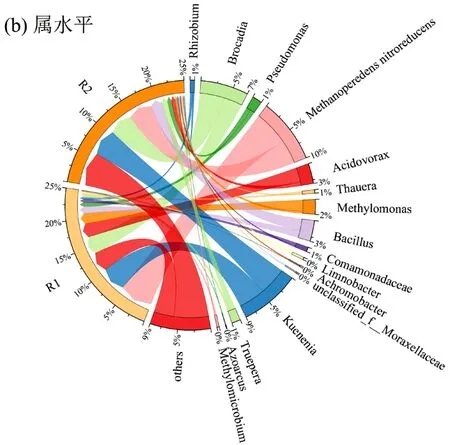
图7 微生物相对丰度分布Fig.7 Relative abundance distribution of microorganisms
图7(b)显示2 个系统中均发现了芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonad)、食酸菌属(Acidovorax)、陶厄氏菌属(Thauera)、甲基单胞菌属(Methylomonas)、Methanoperedens nitroreducens、丛毛单胞菌属(Comamonadaceae)、特吕珀菌属(Truepera) 、 Kuenenia 、 甲 烷 微 菌 属(Methylomicrobium).Acidovorax 是常见的反硝化菌,Thauera 是自养型反硝化细菌[54-56],相比于R1 系统,这两种菌属丰度在R2 系统中均有所下降,表明高温环境会抑制其生长.Tanikawa 等[57]认为Acidovorax和Thauera 是反硝化过程中主要的N2O 还原剂,Zhao等[58]在Thauera 中检测到了大部分N2O 还原酶编码基因,证明了Thauera 在N2O 还原过程中的巨大贡献,R2系统中Thauera丰度的下降是N2O积累量更多的原因.另外,有研究证明Bacillus 可能在N2O 排放方面发挥巨大作用[34],本文在R2 系统中检测到了该属更高的丰度,这也是导致N2O 排放量更高的重要原因.Methylomonas 中存在亚硝酸盐还原酶,其在R2 系统中的丰度明显低于R1 系统,导致R2 系统亚硝酸盐大量积累.Methanoperedens nitroreducens 已知为进行硝酸盐驱动的厌氧甲烷氧化的n-DAMO 古菌,在R1系统中的占比为23.22%,在R2 系统中的占比为16.40%,由此可见高温抑制了DAMO 古菌的生长,造成脱氮速率下降.Ca.Kuenenia 和Ca. Brocadia 与脱氮直接相关,是常见的Anammox 细菌,在R1 系统中两者的占比分别为17.64%和12.47%,在R2 系统中两者的占比分别为19.01%和16.65%,可以看出Anammox两个菌属在R2 中占比升高.这可能是因为DNRA 反应产生的铵促进了Anammox 微生物的生长.在两个系统中均未检测到能够进行DNRA 反应的典型微生物,因此推测DAMO 古菌利用甲烷厌氧氧化产生的电子发生了DNRA 反应.
2.3.2 温度对Anammox-DAMO 系统微生物功能基因丰度变化影响 反硝化过程主要由4 种酶催化,即硝酸盐还原酶(narGHI/napAB)、亚硝酸盐还原酶(nirK/nirS)、NO 还原酶(norBC)和 N2O 还原酶(nosZ).nrfA 是DNRA 的分子标志物[59],由图8 可见,其在R2 系统中相对丰度较高,对高温条件表现出明显的偏好性,Lai 等[60]将温度从10℃提升到40℃时,nrfA 基因丰度增加,DNRA 反应过程增强,说明DNRA 反应与nrfA 基因丰度呈显著正相关.对于硝酸还原酶基因,相较于R1 系统,R2 系统中的napAB转录明显上调,显示了对DNRA 的主要贡献(硝酸盐被还原为亚硝酸盐),然而narGHI 的表达水平与R1系统几乎一致,表明对部分DNRA 的贡献较小.对于亚硝酸还原酶基因,nirSK 在R2 系统中的相对丰度低于R1 系统,减弱了R2 系统对亚硝酸盐还原能力进而导致亚硝酸盐积累,这主要归因于高温会显著降低nirK 基因的丰度[61].另外,在R2 系统中,NO 还原酶基因(norB)相对丰度更高,而N2O 还原酶基因(nosZ)相对丰度较低,说明高温条件抑制了nosZ 酶的生成,进而阻碍了N2O 被还原.hdh 和hzs 是参与Anammox 反应的酶,其中hzs 在R2 中的相对丰度高于R1 系统,且与nrfA 的变化呈正相关关系,表明DNRA 反应产生的铵为Anammox 提供了底物,从而促进Anammox 过程的发生.
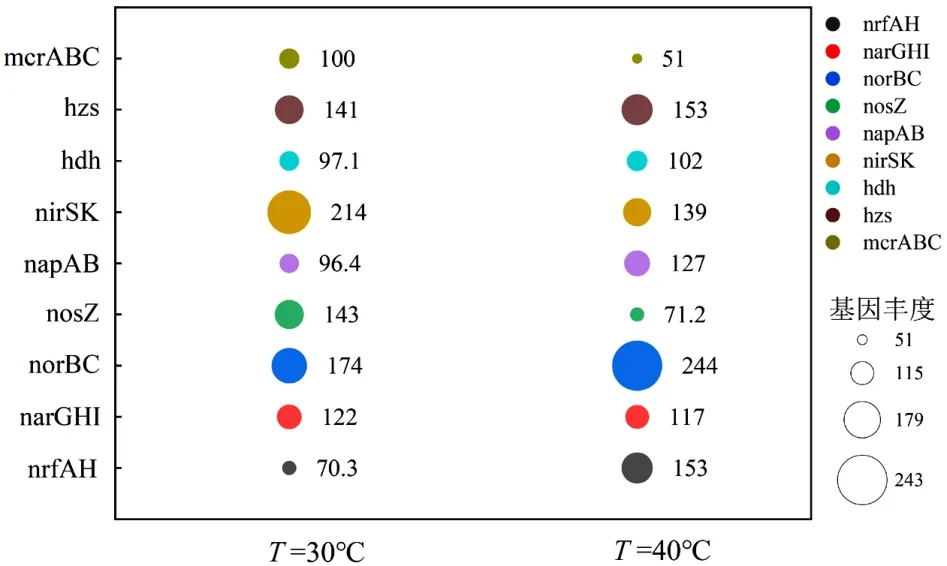
图8 不同温度下氮代谢和碳代谢功能基因丰度Fig.8 Nitrogen and carbon metabolism functional gene abundance at different temperatures
在R2 系统中,Anammox 基因丰度高,但脱氮性能却比R1 差.这种现象可以通过不利的温度和FNA对转录、翻译和酶活性的抑制来解释[62].以亚硝酸盐还原酶与N2O 还原酶的比值(Σnir/nos)作为N2O 产生潜力的指标,其中Σnir/nos是由nir基因(nirS+ nirK)之和除以nos 基因测定的[63].结果表明R2 系统中Σnir/nosZ(1.95)高于R1 系统(1.49),说明Anammox-DAMO 系统在高温胁迫下更易积累N2O.
2.4 温度影响下Anammox-DAMO 系统动力学机制及N2O 减排调控策略
2.4.1 温度影响下Anammox-DAMO 系统动力学机制 如图9 及表1、2、3 所示, NO3-、NH4+和N2O 酶动力学方程中Vmax均随着温度的升高先增大后减小,在35℃时最大,40℃时最小,意味着硝酸盐还原酶、亚硝酸盐还原酶、N2O 还原酶均在 35℃时拥有最大比合成/活化速率,酶活性最强.KI,R为对应还原酶的抑制系数,3 种酶动力学方程的 KI,R随温度的升高先降低后升高,同样在35 ℃时最大, 40℃时最小,表明35℃的温度条件对3 种酶的抑制作用最小. 3 种酶动力学方程的半饱和常数KE,i随着温度的升高先减少后增加,在35℃时最小, 40℃时最大.
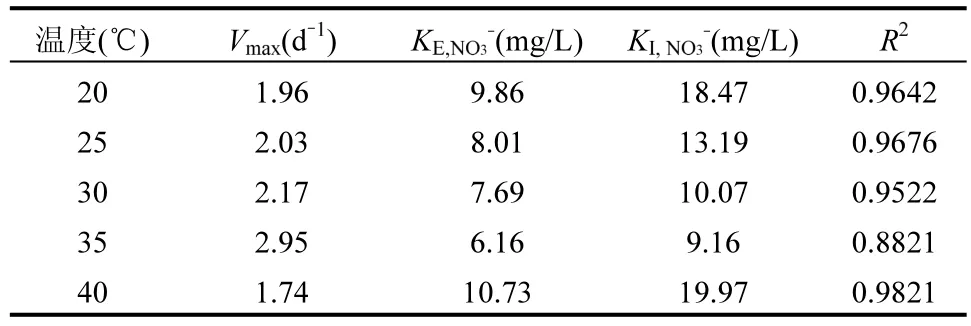
表1 不同温度下NO3-降解酶动力学参数Table 1 Kinetic parameters of NO3- degrading enzymes at different temperatures

表2 不同温度下NH4+降解酶动力学参数Table 2 Kinetic parameters of NH4+ degrading enzymes at different temperatures
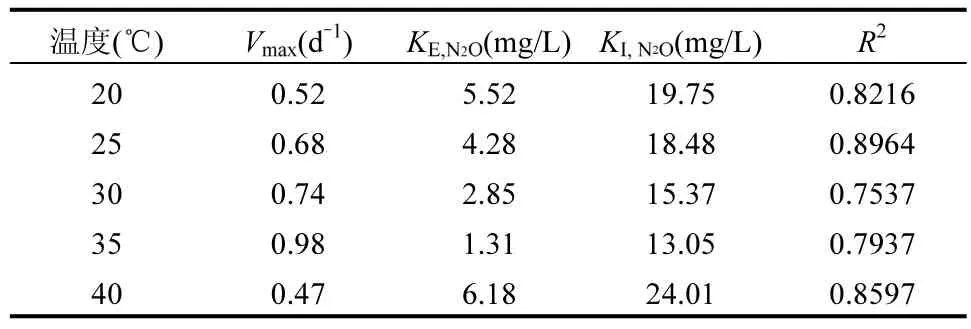
表3 不同温度下N2O 消耗酶动力学参数Table 3 Kinetic parameters of N2O consuming enzymes at different temperatures
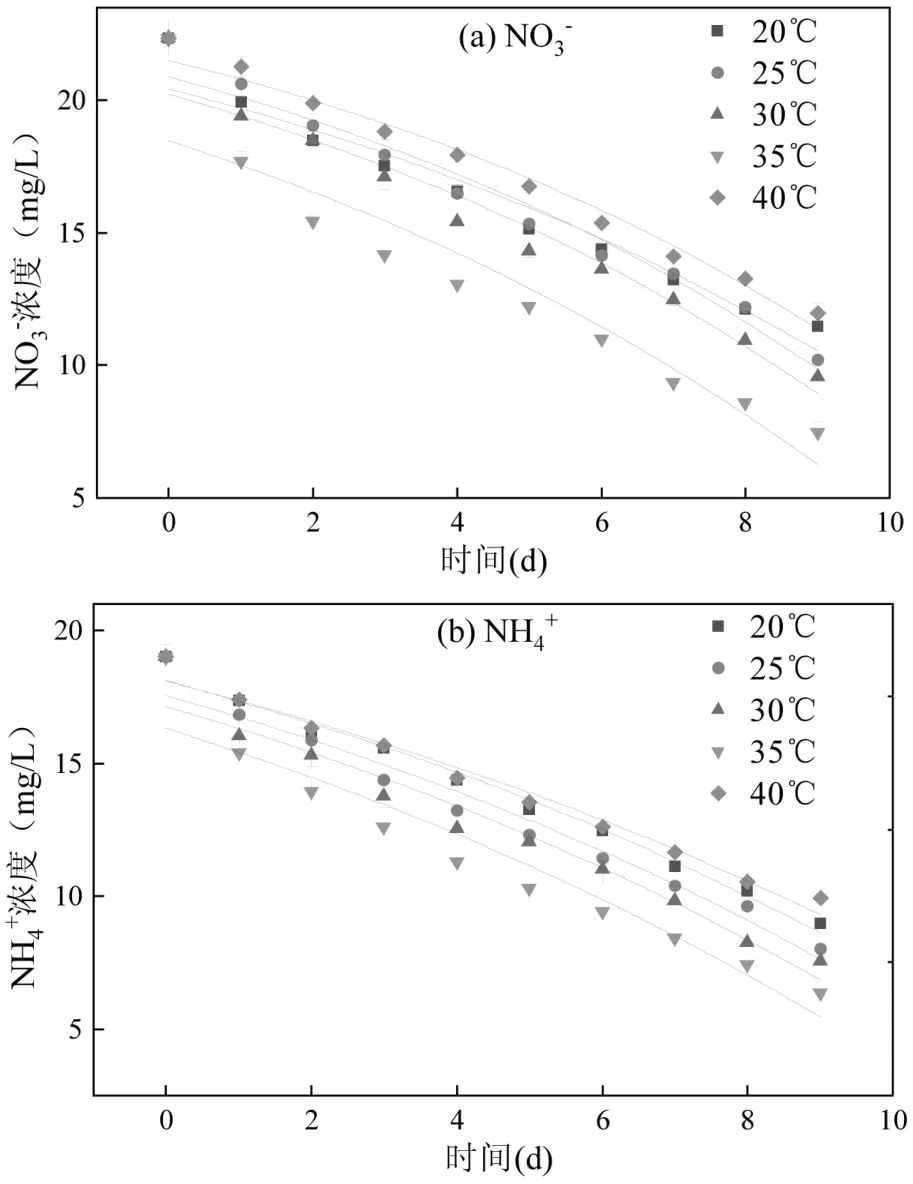
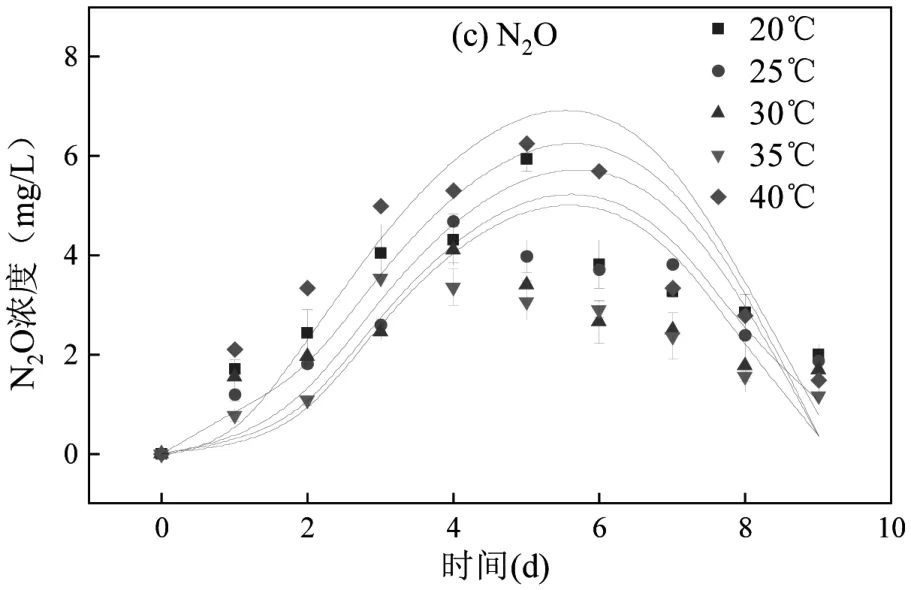
图9 酶动力学拟合曲线Fig.9 Enzyme kinetics fitting curve
硝酸盐还原酶、亚硝酸盐还原酶、N2O 还原酶的活性均随着温度的升高呈现先增强后减弱的趋势,且在35℃时活性达到最大,意味着在此温度下Anammox-DAMO 系统的脱氮性能最好,N2O 还原效果最好,能够实现最大程度减少N2O 排放量.低于或高于35℃的温度条件都会对酶的活性产生不利影响,造成系统性能的恶化以及N2O 的积累,拟合结果印证了短期试验结果.Hu 等[16]利用实验室规模的缺氧/好氧间歇式反应器探究了温度对N2O 排放的影响,结果表明在10~35℃的温度条件下,N2O 排放量随温度的升高而降低,该系统主要是通过温度变化影响硝化和反硝化的总体过程速率来影响N2O 的排放,本研究在该温度范围的基础上继续扩大温度范围,发现在20~40℃的范围内,系统在35℃时出现N2O 排放低谷.此外,Qian 等[64]在TDD-Anammox 耦合工艺中发现35 ℃时系统 N2O 排放量最少,这主要归因于Anammox 微生物(其特征是不产生N2O)在此温度下发挥最大作用,而本研究酶动力学拟合结果证明了参与Anammox 过程的亚硝酸盐还原酶在35℃下活性最大,与其实验结果相符.
综上所述,动力学模型可以很好地预测系统在不同温度下N2O 排放情况,根据酶动力学拟合结果推测出N2O 排放量最少的温度条件为35℃,在此温度下该系统可以最大程度地实现N2O 减排.
2.4.2 Anammox-DAMO 系统代谢途径及N2O 调控策略 根据检测到的功能菌和基因,通过比对KEGG 数据库的注释对温度影响下 Anammox-DAMO 系统特殊氮代谢途径进行分析(图10).
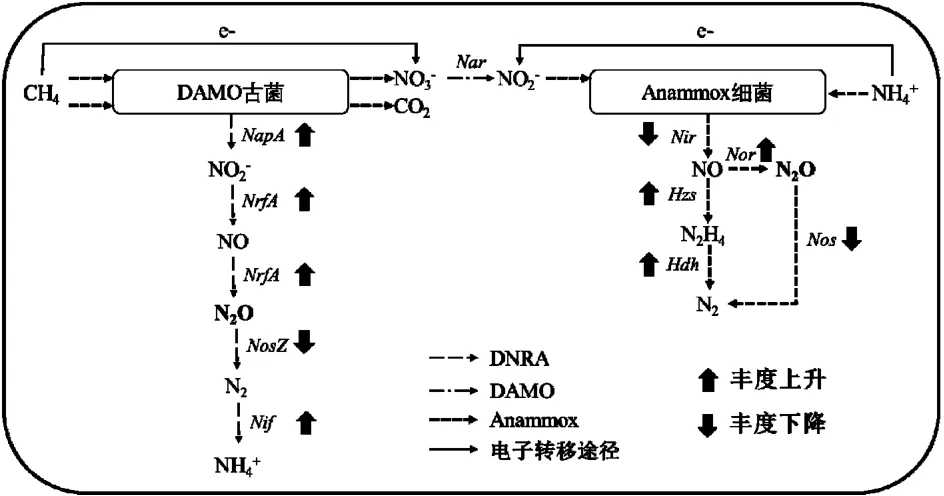
图10 Anammox-DAMO 系统特殊氮代谢途径Fig.10 Special nitrogen metabolism pathways in the Anammox-DAMO system
在Anammox-DAMO 系统中,除已被证实的Anammox-DAMO 氮代谢基因,还检测到了与DNRA 反应相关的nrfA 基因,且在高温胁迫下其丰度显著增加.研究表明DAMO 古菌有编码nrfA 的基因,因此具有发生DNRA 反应的潜力.高温抑制了Anammox-DAMO 系统中nir 酶的活性,造成亚硝酸盐积累,基于nrfA 的解毒机制,此时nrfA 会将NO2-还原为NO,nrfA 与活性位点血红素c 基团A 结合的晶体结构将NO 转化为N2O[65].在本研究中还检测到了与N2O 产消相关的norB、norC 和nosZ 基因.有研究表明,Anammox 细菌会生成中间产物NO,norB 和norC 基因可能会对外部亚硝化应激做出快速反应,为了将NO 维持在毒性水平以下会把NO 转化为N2O[39].高温影响下,Anammox 细菌产生的NO 促进了norBC 基因丰度增加,进而将更多的NO 转化为N2O.与此同时,Anammox-DAMO 系统中的nosZ 基因丰度降低,说明高温抑制了N2O 还原酶的生成,导致无法及时将产生的N2O 还原,造成N2O 净排放量升高.综上所述,N2O 产生和消耗途径可作如下解释: Anammox-DAMO 系统中检测到的N2O 由DNRA 反应及Anammox 细菌对NO 解毒作用产生,而N2O 的消耗大部分由编码nosZ 基因的微生物完成.
基于Anammox-DAMO 系统中N2O 特殊的产消代谢途径,本研究发现高浓度亚硝酸盐胁迫是导致Anammox-DAMO 系统N2O 积累的主要原因.高温通过影响系统氮代谢过程中的关键功能基因酶的活性,导致亚硝酸盐浓度升高,进而触发DNRA 反应及Anammox 细菌的解毒作用.反硝化过程中4 个还原步骤之间的电子竞争以及不同还原酶的活性决定了N2O 的积累程度,本研究中,对系统性能不利的高温条件会显著降低N2O 还原酶的活性,导致N2O 的净排放量升高.因此,尽可能控制系统在运行过程中维持在中温条件,丰富具有较强N2O 还原能力的微生物群,可以促进N2O 的还原.在后续研究中,还需要优化pH 值、C/N、DO、FNA 等其他操作条件,避免运行过程中亚硝酸盐的积累,并研究不同操作条件下N2O 还原酶的活性,以最大限度地减少废水处理中N2O 的产生.
3 结论
3.1 高温显著降低了Anammox-DAMO 系统的脱氮性能,且在高温胁迫下系统中亚硝酸盐积累进而导致N2O 的净排放量升高,根据甲烷与硝酸盐降解速率比值可知该系统在长期运行过程中还存在DNRA 反应.
3.2 Anammox-DAMO 系统中微生物在高温胁迫下产生更多的蛋白质以缓解恶劣环境造成的损伤,三维荧光光谱结果显示其主要为色氨酸类和酪氨酸类蛋白质物质,该类物质的分泌与N2O 的排放量呈显著正相关.
3.3 高通量测序结果表明,在高温影响下系统中与N2O 还原相关的Acidovorax 和Thauera 属丰度降低,而与N2O 产生相关的Bacillus 属丰度则上升.宏基因测序结果表明高温降低了nirSK 丰度,造成亚硝酸盐积累,此外在高温条件下norB 丰度增加而nosZ 丰度减少,加速了N2O 生成的同时抑制了其还原,导致N2O 积累.
3.4 在不同温度下对Anammox-DAMO 系统进行酶动力学拟合,发现低温和高温均会增加N2O 的净排放量,而在35℃时可以最大程度地实现N2O 减排.

