赤琥珀螺线粒体全基因组测定与系统发育关系的研究
马蕊 张卫红 郭阳阳
摘 要 旨在通过高通量测序技术获得赤琥珀螺(Succinea erythrophana)线粒体基因组全序列,对其结构及组成特征进行分析,并结合NCBI数据库已公布的琥珀螺科及柄眼目物种序列,以最大似然法和贝叶斯法分别进行系统发育分析。结果显示:①赤琥珀螺线粒体基因组全长 14 023 bp(GenBank No.ON533899),由37个基因和一段富含AT的非编码控制区组成,有20处基因间隔,13处基因重叠。A+T平均含量为77.3%,表现出明显的AT偏向性。基因的排列顺序、结构与组成、密码子使用情况与琥珀螺科已报道种类相似。 ②除tRNA-Phe、tRNA-His、tRNA-Ser1、tRNA-Ser2外,其余 tRNAs呈典型三叶草结构。③Ka/Ks选择压力分析显示其受到纯化选择作用。④系统发育研究揭示赤琥珀螺与同属的腐败琥珀螺(Succinea putris)亲缘关系最近,然后与同科其他物种形成姐妹群关系。
关键词 赤琥珀螺;琥珀螺科;线粒体基因组;系统发育
线粒体基因组是动物系统发育研究中广泛使用的分子标记[1]。这主要得益于其分子结构相对简单、具有较高的进化速率、母系遗传、重组率低和拷贝数高等优点[2-3]。近年来,随着基因组测序技术的发展和测序成本的下降,对线粒体基因组的研究报道大量增加,但不同动物类群的研究存在一定差异,对无脊椎动物的关注明显少于脊椎动物。
琥珀螺科(Succineidae)是软体动物门(Mollusca)、腹足纲(Gastropoda)、柄眼目(Stylommatophora)的主要类群[4]。该科物种形态多样,大多数种类水陆两栖,其中一些种类危害棉、麻、粮、蔬菜等农作物和园艺花卉,有些是家畜、家禽及野生动物寄生吸虫、线虫的中间宿主,而另有一些种类其软体和贝壳均可入药,因而琥珀螺科与人类关系十分密切[5]。但对琥珀螺科的研究多集中在形态方面,线粒体基因组研究十分有限,目前仅有腐败琥珀螺(Succinea putris)[6]、五家渠尖缘螺(Oxyloma wujiaquensis)[7]和Omalonyx unguis[8]共3个物种的线粒体基因组被报道。
赤琥珀螺(Succinea erythrophana Ancey,1883)是琥珀螺科中的小型种类,为中国特有种,在吉林、北京、河北、山西、陕西、新疆和长江中下游及其以南的两广地区广泛分布[9]。赤琥珀螺也是传统中药,中药名为缘桑螺,主治小儿惊风,痔疮,脱肛等症(中药大辞典,中华本草)。目前对赤琥珀螺的研究仅见贝壳形态和分布地的简单记述[10],本试验将对其进行线粒体全基因组测定以及系统发育关系研究,以期为该物种的系统进化及保护利用提供分子依据。
1 材料与方法
1.1 样品采集
赤琥珀螺标本于2013年8月11日采自新疆伊犁察布查尔县乌孙山公路边及山坡松林地 (43°28′N,81°06′E),海拔2 106 m,采集人张卫红等。标本鉴定由李成有和张卫红依据其形态解剖特征完成[11],现保存于新疆大学生命科学与技术学院(标本号:XJU S13029)。
1.2 DNA提取
选取一只成体赤琥珀螺,剪取腹足肌肉约 30 mg,使用天根公司DNA组织提取试剂盒提取总DNA。提取结果经检测合格后(DNA质量浓度超过100 ng/μL)送上海天昊生物有限公司进行高通量测序。
1.3 线粒体基因组测序及组装
利用二代高通量测序技术(Illumina Hiseq平台)对赤琥珀螺线粒体全基因组测序。对下机后的数据进行质控,低质量读段、N率较高序列及测序接头序列等被过滤。质控后的contigs以同属物种腐败琥珀螺(GenBank No. JN627206)作为参考基因组进行序列比对,将双端数据输入MetaSPAdes中进行组装。使用ORF finder在线分析确定蛋白质编码基因的边界,使用 tRNAscan预测tRNA的位置及其二级结构。通过MITOS在线服务[12]进行结构功能注释,并在Geneious R11软件[13]中对注释结果手动校正。拼接组装后的序列使用OGDRAW在线平台[14]绘制基因结构图。最后,将赤琥珀螺线粒体全基因组数据提交至NCBI数据库,获得GenBank登录号为ON533899。
1.4 基因组序列分析
使用Geneious R11软件统计碱基组成情况;在CodonW v1.4.2软件中统计密码子偏向性及使用情况;通过DnaSP v.5.10软件[15]计算每个蛋白质编码基因同义替换(Ks)和非同义替换(Ka)概率,Ka/Ks大于1、等于1和小于1分别表示受到正选择、中性进化和纯化选择作用[16]。对线粒体基因组链的非对称性(strand asymmetry),即两条链的组成偏差利用公式AT shew=(A-T)/(A+T)和GC shew=(G-C)/(G+C)分别进行计算。
1.5 系统发育分析
基于柄眼目不同类群具代表性的14个物种(表1)的线粒体蛋白质编码基因,以新腹足目塔螺科物种Lophiotoma cerithiformis作为外群,使用贝叶斯法(Bayesian analysis,BI)和最大似然法(Maximum likelihood methods,ML)进行系统发育分析(表1)。其中,蛋白质编码基因使用PhyloSuite v1.2.2软件[17]提取串聯。BI树使用MrBayes v3.2.6软件[18]生成,马尔可夫链蒙特卡洛分析运行100万代,每1 000代抽样保存1个样本,前25% burnin;ML树使用IQ-TREE v.1.6.8软件构建,建树模型选用GTR+F+G,自举检验次数设定为1 000次。使用iTOL在线程序[19]对系统发育树进行美化。
2 结果与分析
2.1 线粒体基因组结构及组成
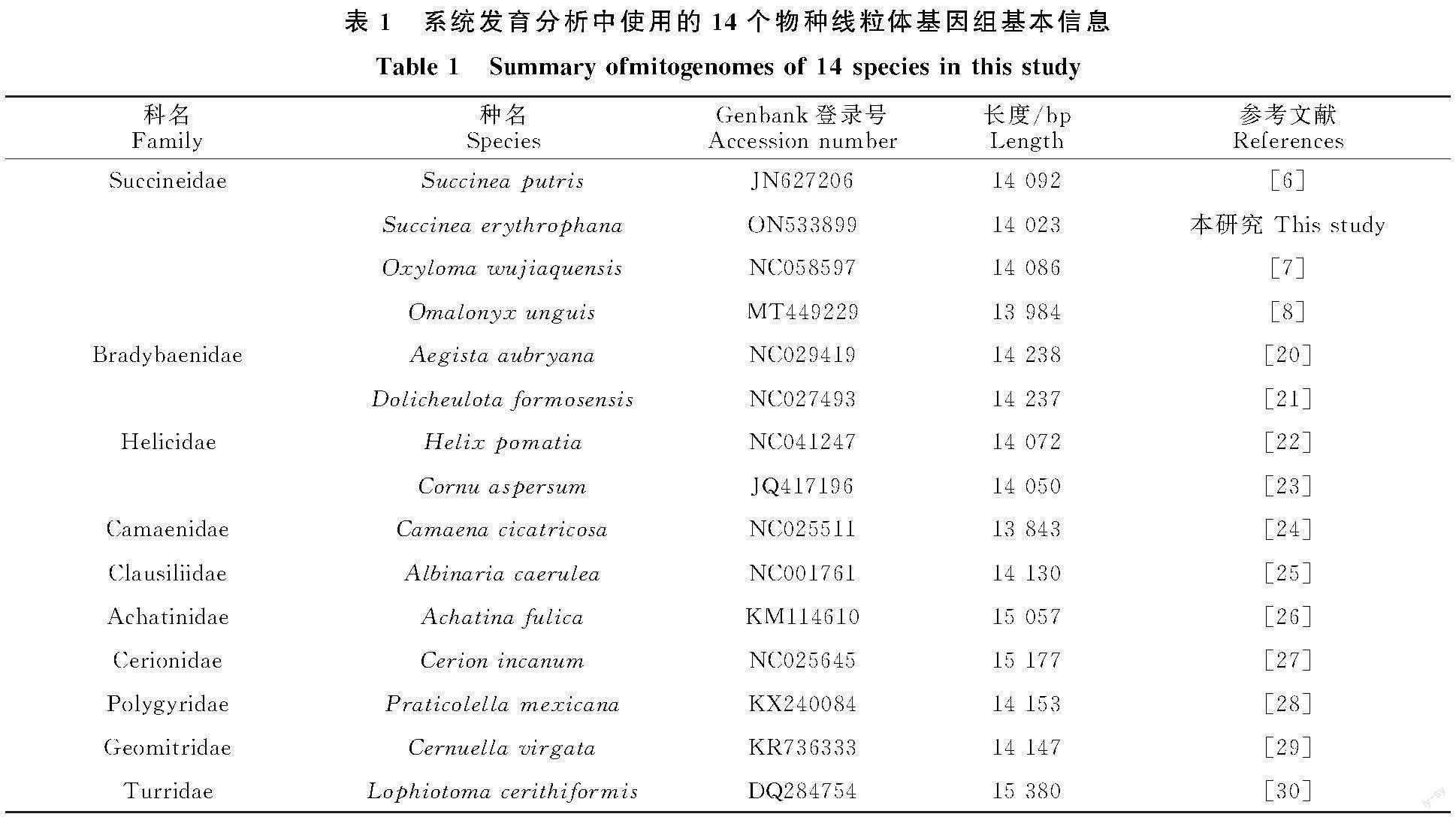
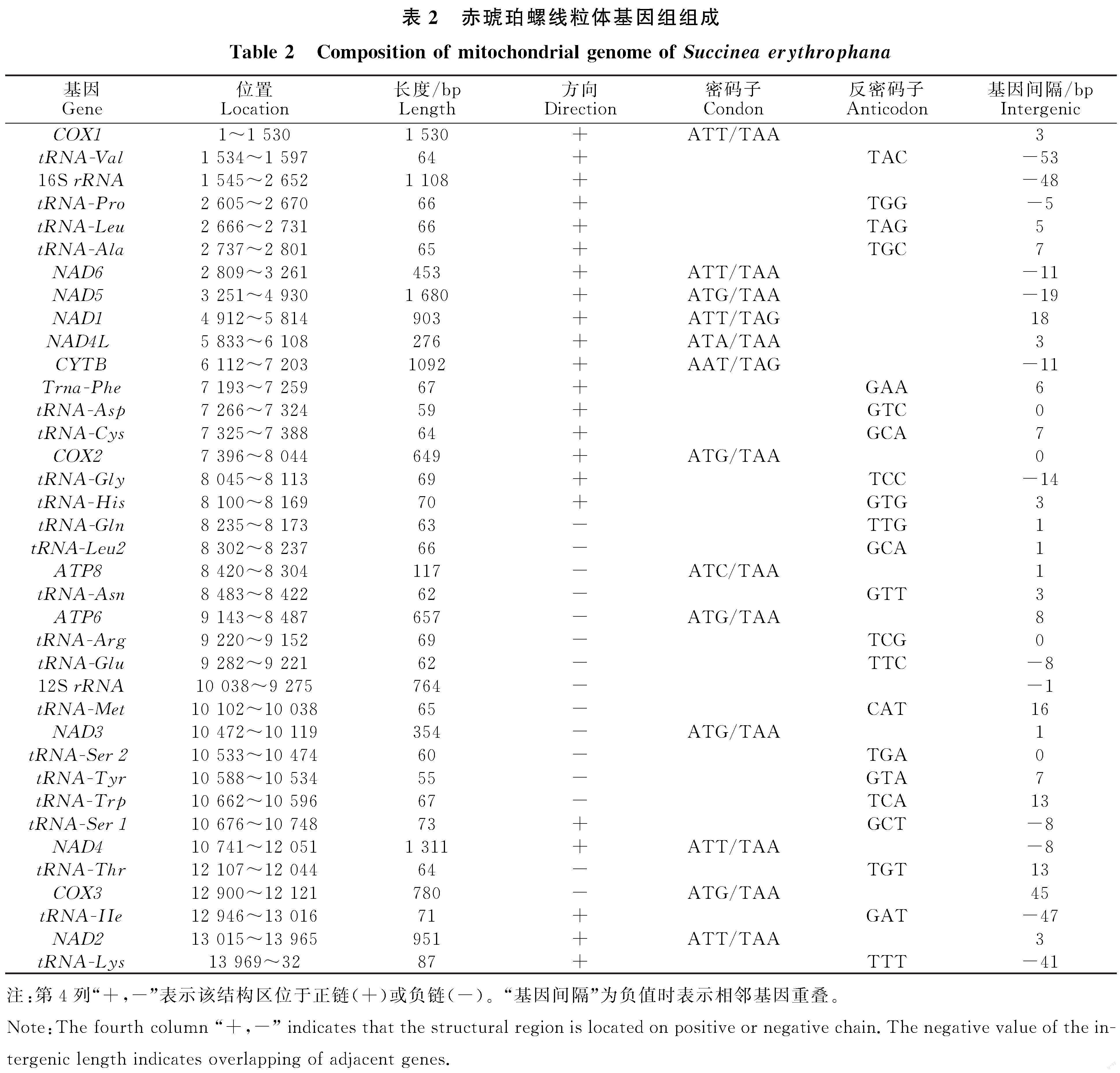
赤琥珀螺线粒体基因组为典型环状闭合双链结构(图1),全长14 023 bp,由37个基因组成,包括13个蛋白质编码(Protein coding genes,PCGs)基因、22个tRNA基因、2个rRNA基因以及1个富含AT的非编码区。A、T、C、G平均含量为33.5%、43.8%、10.6%和12.0%,其中 A+T含量为77.3%,存在明显的AT偏向性。37个基因中22个位于正链,包括9个PCGs,12个tRNAs和1个rRNA基因;15个位于负链,包括4个PCGs,10个tRNAs和1个rRNA基因。存在基因间隔20处,基因重叠13处(表2)。
2.2 蛋白质编码基因
赤琥珀螺13个蛋白质编码基因长度在117 bp( ATP8)到1 680 bp( NAD5),总长 10 753 bp,AT含量为76.7%,AT偏斜(AT shew)为 -0.16,GC偏斜(CG shew)为0.07。13个PCGs中,12个基因以ATN作为起始密码子,只有CYTB 基因以TTG起始;11个基因以TAA为终止密码子,只有 NAD1和CYTB基因以TAG终止。
13个PCGs共编码3 666个氨基酸,使用频率较高的密码子为UUU(Phe)、UUA(Leu)和AUU(Ile),总体偏向于使用第3位为A或T(U)的密码子(图2)。
2.3 选择压力分析
赤琥珀螺线粒体基因组中所有PCGs的Ka/Ks值均小于1(图3),即非同义突变的频率少于同义突变,表明整体受到纯化选择作用。在13个PCGs中,ATP8、NAD2基因的Ka/Ks值相对较高(分别为0.392 8和0.387 9),表明它们受到较小的选择压力,而COX1的Ka/Ks值最小 (0.053 4),表明其受到的选择压力最大。
2.4 tRNA和rRNA基因
赤琥珀螺tRNAs基因总长为1 422 bp。除tRNA-Phe、tRNA-His、tRNA-Ser1、tRNA-Ser2外,其他18个tRNAs的二级结构均为典型三叶草结构(图4)。其中,tRNA-Phe和tRNA-His均缺少TΨC臂,额外环较长,氨基酸臂中出现了错配;tRNA-Ser1和tRNA-Ser2均缺少DHU臂,其中,tRNA-Ser1基因在原本的DHU臂处出现了1个8 bp的小茎环结构,额外环较长,氨基酸臂中出现两对错配。
对于rRNA基因,16S rRNA位于tRNA-Val和tRNA-Pro之间,长度为931 bp;12S rRNA位于tRNA-Glu和tRNA-Met之间,长度为764 bp。
2.5 控制区
赤琥珀螺线粒体基因组控制区与腐败琥珀螺及Omalonyx unguis位置一样,均位于COX3与tRNA-Ile基因之间,其中,前者控制区长度为 45 bp,后两者均为50 bp,但与同在新疆分布的五家渠尖缘螺有所不同,五家渠尖缘螺的控制区位于COX1和tRNA-Val基因之间,长度为42 bp。
2.6 系统发育分析
基于线粒体基因组13个蛋白质编码基因构建的ML和BI系统发育树拓扑结构一致,故此处选取其中一种作为展示(图5)。结果显示柄眼目呈单系,“non-achatinoid”类群与“achatinoid”类群被分开,其中“achatinoid”类群仅由Achatina fulica作为代表。琥珀螺科(Succineidae)也为单系,与旋蜗牛总科(Helicoidea)和尾刺螺总科(Urocoptoidea)聚成的支系互为姐妹群关系。琥珀螺科中赤琥珀螺与同属的腐败琥珀螺亲缘关系最近。
3 讨论与结论
本研究测定了采集自新疆的陆生贝类物种赤琥珀螺的线粒体基因组序列,全长为14 023 bp,该长度处于琥珀螺科已发表物种的线粒体基因组大小范围内(13 984~14 092 bp,见表1)。呈共价闭合环状双链结构,包含37个典型编码基因和1个控制区。其线粒体全基因组展现明显的AT偏向性,符合柄眼目动物类群相关特征[21]。链的非对称性研究揭示赤琥珀螺在整个正链上有链的不对称性逆转,即T的含量高于A,G的含量高于C(AT skew为-0.16,GC skew为0.07),与腹足纲大部分种类相似[31]。
赤琥珀螺PCGs结构及排列与同科已报道物种一致[6-8]。其中,最长的基因为 NAD5(1 680 bp),最短的为 ATP8(117 bp),亦与腹足纲物种情況一致[32]。密码子使用情况显示偏向于使用第3位为A或T(U)的密码子,与Guzmán等对Omalonyx unguis的研究结果一致[8]。对选择压力的研究发现,13个PCGs的Ka/Ks比值均小于1,表明受到纯化选择作用,但不同基因受选择强度并不相同: ATP8和 NAD2基因受选择压力较小,因而有利于它们进化速率加快;相比较而言,COX1基因受选择压力较大,因而相对于其他基因可能更为保守,这与通常认为的COX1可作为DNA条形码进行物种鉴定的观点相一致[33]。
赤琥珀螺rRNAs的基因位置及长度与琥珀螺科已报道物种相似,但tRNAs基因的二级结构则有所不同。这与通常认为的线粒体基因组中基因排列顺序和结构是可变的[34],且tRNA的位置变动要比rRNA以及蛋白质编码基因更为常见的观点相一致[35]。本研究中,赤琥珀螺的tRNA-Ser1基因在原本DHU臂处出现了1个8 bp的小茎环结构,而同科已报道的3个物种均缺乏这一结构。除此之外,赤琥珀螺tRNA-Phe和tRNA-His基因的二级结构缺失TΨC臂,亦与琥珀螺科已报道种不同[6-8]。尽管如此,由于陆生贝类许多重要类群的线粒体基因组当前未知,对于它们基因重排的机制、进化模式和变异程度至今尚不清楚。因此,对当前观察到的基因结构差异在系统发育和进化研究中的意义有待更广泛的 探究。
腹足纲物种的系统发育分析一直备受关注,本研究中对高阶层柄眼目的系统分类显示其呈现单系,与Wade等的研究结果相一致[36]。柄眼目中对于琥珀螺科的分类问题亦备受重视,本研究对该科的研究结果与Guzmán等[8]的结果相一致,揭示琥珀螺科是Helicoidea + Urocoptoidea的姐妹群。对于赤琥珀螺的分类,本研究揭示其与同属的腐败琥珀螺关系最近,而与同在新疆分布的尖缘螺属物种五家渠尖缘螺关系较远,这与形态学研究进行的物种划分结果一致。未来,期待有更多种类的线粒体基因组被测定研究,以便进行更为全面、深入的系统发育探讨。
参考文献 Reference:
[1] 薛 清,杜虹锐,薛会英,等.苜蓿滑刃线虫线粒体基因组及其系統发育研究[J].生物技术通报,2021,37(7):98-106.
XUE Q,DU H R,XUE H Y,et al.Mitochondrial genome and phylogeny of Aphelenchoides medicagus[J].Biotechnology Bulletin,2021,37(7):98-106.
[2] 杨 婧,黄 原.线粒体基因组的高通量测序策略[J].生命科学,2016,28(1):112-117.
YANG J,HUANG Y.Strategy of high-throughput sequencing technology in the mitochondrial genome sequencing[J].Chinese Bulletin of Life Sciences,2016,28(1):112-117.
[3] 周 彤,周 娟,梁 爽,等.福建黄兔线粒体基因组全序列测定与分析[J].西北农业学报,2020,30(9):1295-1303.
ZHOU T,ZHOU J,LIANG SH,et al.Complete mitochondrial genome sequence and analysis of Fujian yellow rabbit[J].Acta Agriculturae Boreali-occidentalis Sinica,2020,30(9):1295-1303.
[4] PATTERSONC M.Taxonomic studies of the land snail family Succineidae[J].Malacological Review,1971,4:131-202.
[5] 郭阳阳.新疆天山不同采集点琥珀螺属形态和分子性状的比较研究[D].乌鲁木齐:新疆大学,2017.
GUO Y Y.Comparative research on morphological and molecular characteristics of Succinea (Gastropoda,Succineidae) from different locations in Tianshan Mountains,Xinjiang[D].Urumqi:Xinjiang University,2017.
[6] WHITE T R,CONRAD M M,TSENG R,et al.Ten new complete mitochondrial genomes of pulmonates (Mollusca,Gastropoda) and their impact on phylogenetic relationships[J].BMC Evolutionary Biology,2011,11(1):1-15.
[7] 阿尔祖古丽·买买提吐尔逊,张子俊,张卫红.五家渠尖缘螺线粒体基因组测序分析[J].华北农学报,2021,36(3):230-238.
AERZUGULI·M,ZHANG Z J,ZHANG W H.Complete mitochondrial genome sequence of Oxyloma wujiaquensis (Gastropoda,Succineidae) [J].Acta Agriculturae Boreali-Sinica,2021,36(3):230-238.
[8] GUZMN L B,VOGLER R E,BELTRAMINO A A.The mitochondrial genome of the semi-slug Omalonyx unguis (Gastropoda,Succineidae) and the phylogenetic relationships within Stylommatophora[J].PloS One,2021,16(6):e0253724.
[9] 钱周兴,周卫川.中国常见陆生贝类图鉴[M].杭州:浙江人民美术出版社,2014:36.
QIAN ZH X,ZHOU W CH.Illustrated Handbook of Common Terrestrial Mollusks in China[M].Hangzhou:Zhejiang Peoples Art Press,2014:36.
[10] 陈德牛,高家祥.中国琥珀螺属Succinea的研究[J].四川动物,1985(1):34-37.
CHEN D N,GAO J X.Research of Succinea in China[J].Sichuan Journal of Zoology,1985(1):34-37.
[11] 李成有.新疆湿生环境琥珀螺比较形态解剖学研究[D].乌鲁木齐:新疆大学,2018.
LI CH Y.Comparative morphology and anatomy on Succineidae in wetland from Xinjiang[D].Urumqi:Xinjiang University,2018.
[12] BERNT M,DONATH A,JVHLING F,et al.MITOS:improved de novo metazoan mitochondrial genome annotation[J].Molecular Phylogenetics and Evolution,2013,69(2):313-319.
[13] KEARSE M,MOIR R,WILSON A,et al.Geneious basic:An integrated and extendable desktop software platform for the organization and analysis of sequence data[J]. Bioinformatics,2012,28(12):1647-1649.
[14] MARC L,OLIVER D,RALPH B.OrganellarGenomeDRAW (OGDRAW):a tool for the easy generation of high-quality custom graphical maps of plastid and mitochondrial genomes[J].Current Genetics,2007,52(5/6):267-274.
[15] LIBRAD P,ROZAS J.DnaSP v5:A software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25(11):1451-1452.
[16] YANG Z.Computational Molecular Evolution[M].New York:Oxford University Press,2006.
[17] ZHANG D F,GAO I,JAKOVLIC, et al.PhyloSuite:An integrated and scalable desktop platform for streamlined molecular sequence data management and evolutionary phylogenetics studies[J]. Molecular Ecology Resources,2020,20(1):348-355.
[18] HUELSENBECK J P,RONQUIST F.MRBAYES:Bayesian inference of phylogenetic trees[J]. Bioinformatics Applications Note,2001,17(8):754-755.
[19] LETUNIC I,BORK P.Interactive tree of life (iTOL) v3:An online tool for the display and annotation of phylogenetic and other trees[J].Nucleic Acids Research,2016,44(1):242-245.
[20] YANG X,XIE G L,WU X P,et al. The complete mitochondrial genome of Chinese land snail Aegista aubryana (Gastropoda:Pulmonata:Bradybaenidae)[J].Mitochondrial DNA Part A,2016,27(5):3538-3539.
[21] HUANG CH W,LIN S M,WU W L.Mitochondrial genome sequences of landsnails Aegista diversifamilia and Dolicheulota formosensis (Gastropoda,Pulmonata,Stylommatophora) [J].Mitochondrial DNA Part A,2016,27(4):2793-2795.
[22] KORBEK O,PETRUSEK A,ROVATSOS M.The complete mitogenome of Helix pomatia and the basal phylogeny of Helicinae (Gastropoda,Stylommatophora,Helicidae)[J].ZooKeys,2019,827:19-30.
[23] GAITN-ESPITIA J D,NESPOLO R F,OPAZO J C.The complete mitochondrial genome of the land snail Cornu aspersum (Helicidae:Mollusca):intraspecific divergence of protein-coding genes and phylogenetic considerations within Euthyneura[J].PloS One, 2013,8(6):e67299.
[24] WANG P,YANG H F,ZHOU W CH,et al.The mitochondrial genome of the land snail Camaena cicatricose(Muller,1774)(Stylommatophora,Cerionidae):the first complete sequence in the family Camaenidae[J]. ZooKeys,2014,451:33-48.
[25] HATZOGLOU E,RODAKIS G C,LECANIDOU R.Complete sequence and gene organization of the mitochondrial genome of the land snail Albinaria coerulea[J].Genetics,1995,140(4):1353-1366.
[26] HE ZH P,DAI X B,ZHANG SH,et al.Complete mitochondrial genome of the giant African snail,Achatina fulica (Mollusca,Achatinidae):a novel location of putative control regions (CR) in the mitogenome within Pulmonate species[J]. Mitochondrial DNA Part A,2016,27(2):1084-1085.
[27] GONZLEZ V L,KAYAL E,HALLORAN M,et al.The complete mitochondrial genome of the land snail Cerion incanum (Gastropoda,Stylommatophora) and the phylogenetic relationships of Cerionidae within Panpulmonata[J].Journal of Molluscan Studies,2016,82(4):525-533.
[28] MINTON R L,MARTINEZ C M,FARMAN M L,et al.Two complete mitochondrial genomes from Praticolella mexicana Perez,2011 (Polygyridae) and gene order evolution in Helicoidea (Mollusca,Gastropoda)[J]. ZooKeys,2016,626:137-154.
[29] LIN J H,ZHOU W C,DING H L,et al.The mitochondrial genome of the land snail Cernuella virgata (Da Costa,1778):the first complete sequence in the family Hygromiidae (Pulmonata,Stylommatophora)[J]. ZooKeys,2016,589:55-69.
[30] BANDYOPADHYAY P K,STEVENSON B J,CADY M T,et al.Complete mitochondrial DNA sequence of a Conoidean gastropod,Lophiotoma (Xenuroturris) cerithiformis:Gene order and gastropod phylogeny[J]. Toxicon,2006,48(1):29-43.
[31] SUN S H,LI Q,KONG L F,et al.Multiple reversals of strand asymmetry in molluscs mitochondrial genomes,and consequences for phylogenetic inferences[J].Molecular Phylogenetics and Evolution,2018,118:222-231.
[32] PETRUSEK A,ROVATSOS M.The complete mitogenome of Helix pomatia and the basal phylogeny of Helicinae (Gastropoda,Stylommatophora,Helicidae) [J].ZooKeys,2019,827:19-30.
[33] 李曉叶,钱 路,陈茂华.DNA条形码技术在几种苹果园鳞翅目害虫鉴定中的应用[J].西北农业学报,2015,24(5):141-147.
LI X Y,QIAN L,CHEN M H.Application of DNA barcoding technology to identification of some Lepidoptera pests in apple orchards[J].Acta Agriculturae Boreali-occidentalis Sinica,2015,24(5):141-147.
[34] MINDELL D P,SORENSON M D,DIMCHEFF D E.Multiple independent origins of mitochondrial gene order in birds[J].Proceedings of the National Academy of Sciences,1998,95(18):10693-10697.
[35] XU X F,LI A ZH,CHENG SH M,et al.Reappraisal of phylogenetic status and genetic diversity analysis of Asian population of Lentinula edodes[J].Progress in Natural Science,2006,16(3):274-280.
[36] WADE C M,MORDAN P B,NAGGS F.Evolutionary relationships among the Pulmonate land snails and slugs (Pulmonata,Stylommatophora) [J].Biological Journal of the Linnean Society,2006,87(4):593-610.
Complete Mitochondrial Genome Sequencing and Phylogeny
Analysis of Succinea erythrophana
Abstract In this study,we obtained the complete mitochondrial genome sequence of Succinea erythrophana by high-throughput sequencing,and analyzed its structural and compositional features,and performed phylogenetic analyses using maximum likelihood (ML) and Bayesian inference (BI) methods (mtDNA sequences of three species of Succineidae and some species of Stylommatophora used in this paper downloading from NCBI).The results showed that:①The complete mitochondrial genome of Succinea erythrophana was 14 023 bp in length (GenBank No.ON533899),consisting of 37 genes and a segment of AT-rich non-coding control region,with 20 gene spacings and 13 gene overlaps.The average A+T was 77.3%,showing a significant AT bias.The order of gene arrangement,structure and composition,and codon usage were similar to those of the reported species in the Succineidae. ②The secondary structure of most tRNAs in Succinea erythrophana showed a typical cloverleaf structure except for tRNA-Phe,tRNA-His,tRNA-Ser1,and tRNA-Ser2.③Ka/Ks selection pressure analysis of Succinea erythrophana showed that it was subject to purifying selection.④Phylogenetic studies showed the closest relatives of Succinea erythrophana and Succinea putris,which then formed sister groups with other species of the same family.
Key words Succinea erythrophana;Succineidae;Mitochondrial genome;Phylogeny

