肝硬化合并肌少症的影响因素分析
敬进华,孙洁,余虹,蒋奕,窦婧,古再努尔·依力亚尔,孙微,王晓波,徐强,宁忠慧,王晓忠,郭峰
作者单位:1新疆医科大学,a第四临床医学院,b护理学院,新疆维吾尔自治区 乌鲁木齐830000;2新疆乌鲁木齐市中医医院中医内科,新疆维吾尔自治区 乌鲁木齐830000;3南方科技大学医院影像科,广东 深圳518000;4新疆维吾尔自治区中医医院肝病科,新疆维吾尔自治区 乌鲁木齐830000
肌肉减少症简称肌少症,是一种进行性的全身骨骼肌疾病,与跌倒、骨折、残疾和死亡等不良后果的可能性增加相关[1]。肝病相关的肌少症是一种继发性肌少症,在终末期肝病(ESLD)病人中常见。由于ESLD病人食欲下降、蛋白质摄入不足、门脉高压引起的消化不良、蛋白质消耗异常和高代谢状态,引起骨骼肌消耗加快从而形成肌少症。多项研究证实,肌少症是肝病相关中肝癌[2-3]、肝衰竭[4]和肝移植术[5-6]的独立危险因素。一项中国多中心的研究结果显示[7],肌少症是肝硬化的常见并发症,可用于预测肝硬化相关并发症和预后。随着研究的不断进展,肝硬化导致的肌少症也逐渐受到各国学者关注。
肝硬化病人极易出现肌肉减少症。肌少症在肝硬化病人中发病率为30%~70%[8],明显高于无肝硬化病人的5.5%~25.7%[9]。研究表明[10],肌少症作为肝硬化的常见并发症,可增加2倍以上的死亡风险,显著影响病人的长期预后。一项回顾性研究[11]发现,肝硬化合并肌少症病人1、3、5年的病死率分别为14.3%、37.1%、57.6%。既往研究[7,12-13]显示,性别、年龄、身体质量指数(BMI)、血红蛋白、白蛋白及肝性脑病等均是肝硬化合并肌少症病人的影响因素。有趣的是,不同研究所得出的结论不尽相同。目前肌少症有关的临床研究多为回顾性研究,同时该领域研究受到样本量有限、抽样偏倚,营养筛查评估等指标存在异质标准和测量误差等多种因素的影响。因此,本课题采用前瞻性研究,以第三腰椎(L3)水平骨骼肌指数为诊断标准,规范营养风险评估指标,分析肝硬化合并肌少症的影响因素,为肌少症的早筛查、早诊断提供依据。
1 资料与方法
1.1 一般资料 本研究收集2021年6月至2022年5月就诊于新疆医科大学第四附属医院住院的肝硬化病人215例;同时通过新疆医科大学第四临床医学院伦理委员会同意(批号2022XE-GS010),所有检测和评估均得到病人或其近亲属的知情同意。
1.1.1 纳入标准 ①年龄范围18~80岁;②符合肝硬化诊断标准的住院病人;③病人知情同意该项临床研究同意并签字。
1.1.2 排除标准 ①既往有肌少症病史的病人;②存在因疾病致行动障碍或身体残疾不能配合完成骨骼肌功能检测的病人;③既往存在肌肉相关性疾病:如多发性肌炎、重症肌无力、横纹肌溶解等病人;④合并脑血管意外、吉兰巴雷综合征、骨折、骨关节疾病、肌萎缩侧索硬化症等影响肌肉功能检测的病人;⑤肝性脊髓病;⑥合并结核、甲亢、恶性肿瘤、严重性肠病等慢性消耗性疾病病人;⑦合并严重心、脑、肺、肾、血液系统、结缔组织病等病人;⑧因显性肝性脑病未完成营养评估;⑨有精神疾病或语言表达及交流障碍的病人。
1.1.3 剔除标准 ①临床资料不全;②量表填写不完整;③入组后出现原发性肝癌或其他恶性肿瘤等消耗性疾病;④CT影像学因图像质量不佳无法标识。
1.2 方法
1.2.1 肌少症诊断标准 参照《2018欧洲共识:肌少症的定义和诊断(更新版)》[1],根据CT扫描第三腰椎(L3)水平骨骼肌指数(skeletal muscle index,SMI),以L3-SMI<50 cm²/m²(男性)或<39 cm²/m²(女性)为诊断标准[1]。测量工具:采用依莱达临床影像分析系统(RADinfo SYSTEMS)对病人进行CT平扫并将CT序列图导出。采用RadiAnt DICOM Viewer处理系统识别CT图片上每个像素点的密度值,而骨骼肌的密度值用亨氏单位Hu值,定义在-29~+150 Hu区间。两名专业影像学医师用手工测绘骨骼肌边缘从而框定骨骼肌面积,每例均测量3次求平均值后计算L3-SMI。计算方法:骨骼肌的CT密度阈值定位在-29~+150 Hu,采用第三腰椎横截面进行测量。L3-SMI=[腹直肌(A1+A2)+腹外斜肌+腹内斜肌+腹横肌(B1+B2)+腰大肌(C1+C2)+腰方肌(D1+D2)+竖脊肌(E1+E2)]/身高²(cm²/m²)。
L3-SMI横截面上肌肉(腰大肌、竖脊肌、腰方肌、腹直肌、腹横肌、腹外斜肌、腹内斜肌)面积之和。测量L3所在横截面的全部骨骼肌面积(见图1,2)。
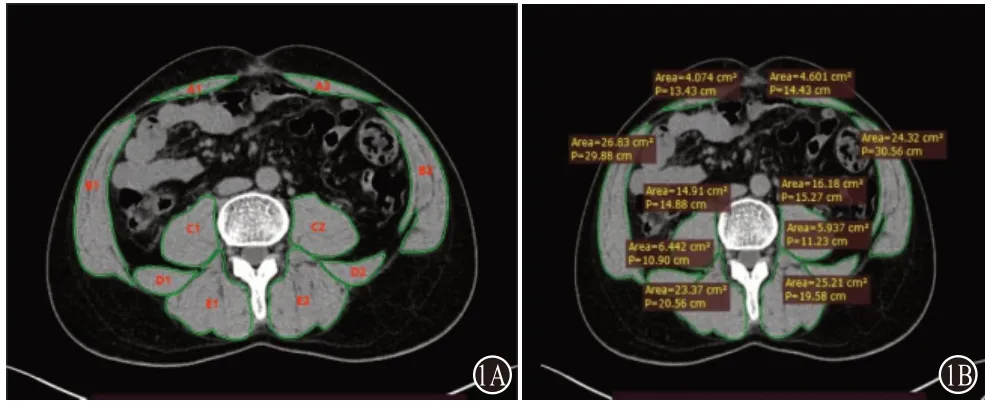
图1 L3所在横截面的全部骨骼肌面积:A为男性;B为女性
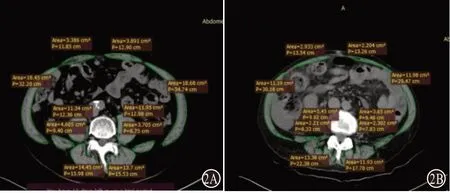
图2 肝硬化肌少症病人的L3-SMI:A为男性;B为女性
1.2.2 一般资料 包括病人年龄、性别、病因及肝硬化相关并发症(腹腔积液、胸腔积液、食管静脉曲张、食管静脉曲张出血、肝性脑病、自发性细菌性腹膜炎、其他感染、电解质紊乱)。
1.2.3 实验室血清学指标 入院第二日清晨空腹抽取病人静脉血检测;包括血常规、凝血功能及生化学指标:白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HGB)、血小板计数(PLT)、中性粒细胞绝对值;凝血酶原时间(PT)、国际标准化值(INR)、纤维蛋白原(FIB);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)、间接胆红素(IBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、胆碱酯酶(CHE)、三酰甘油(TG)、血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿素(BUN)、血清肌酐(Scr)、胱抑素-C(Cys-c)、β2-微球蛋白(β2-MG)、血清葡萄糖(Glu)。
1.2.4 肝功能评分(CTP) A级为5~6分,B级为7~9分,C级为10~15分,具体评分及分级标准见表1。
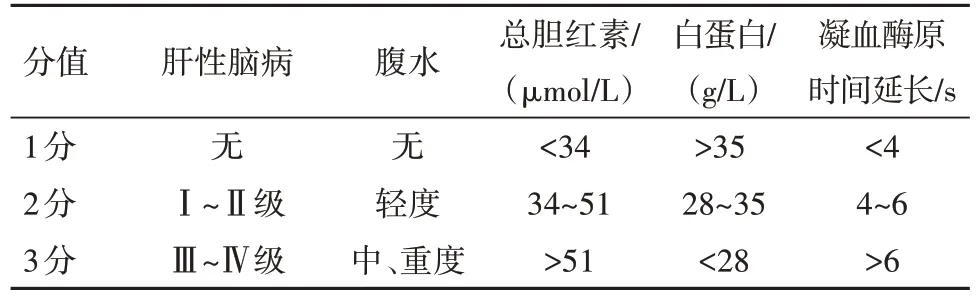
表1 肝功能评分(CTP)及分级标准
1.2.5 终末期肝病模型(model for end stage disease,MELD)评分[14]MELD评分=9.6×In[肌酐(mg/dL)]+3.8×In[胆红素(mg/dL)]+11.2×In(INR)+6.4×病因(病因:胆汁性或酒精性0,其他1)。
1.2.6 营养风险筛查表(NRS2002) 该评分包括营养状态评分、疾病严重程度评分及年龄评分3部分,总分≥3分认为有营养风险。
1.2.7 营养评估 包括优势手握力、4 m步速、小腿围、三头肌皮褶厚度(TSF)、上臂围、上臂肌围(AMC)、BMI。
1.3 统计学方法 采用SPSS 23.0统计软件对数据进行分析。计量资料符合正态分布的以表示,两组间比较采用独立样本t检验;若不符合正态分布的以中位数(第25、75百分位数)、即M(P25,P75)表示,采用Wilcoxon秩和检验;计数资料采用频数、率表示,组间比较采用χ2检验。将所有的协变量分别进行单因素分析,将单因素分析差异有统计学意义的变量进行logistic回归分析,采用Forward:Wald分析其是否为肝硬化病人合并肌少症的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 肝硬化合并肌少症组与非肌少症组病人基线资料的比较 肌少症在肝硬化病人中的发生率为68.3%。在肝硬化合并肌少症组病人中:肝硬化合并腹腔积液68例(46.3%),合并自发性细菌性腹膜炎35例(23.8%),合并食管静脉曲张出血的病人18例(12.2%)。两组病人在年龄、原发性胆汁性胆管炎、腹腔积液、食管静脉曲张出血、自发性细菌性腹膜炎、MELD低危(≤14分)及MELD高危(>18分)中均差异有统计学意义(P<0.05),在血清学指标中:红细胞计数、血红蛋白均差异有统计学意义(P<0.05),见表2,3。

表2 肝硬化合并肌少症组与非肌少症组病人基线资料的比较
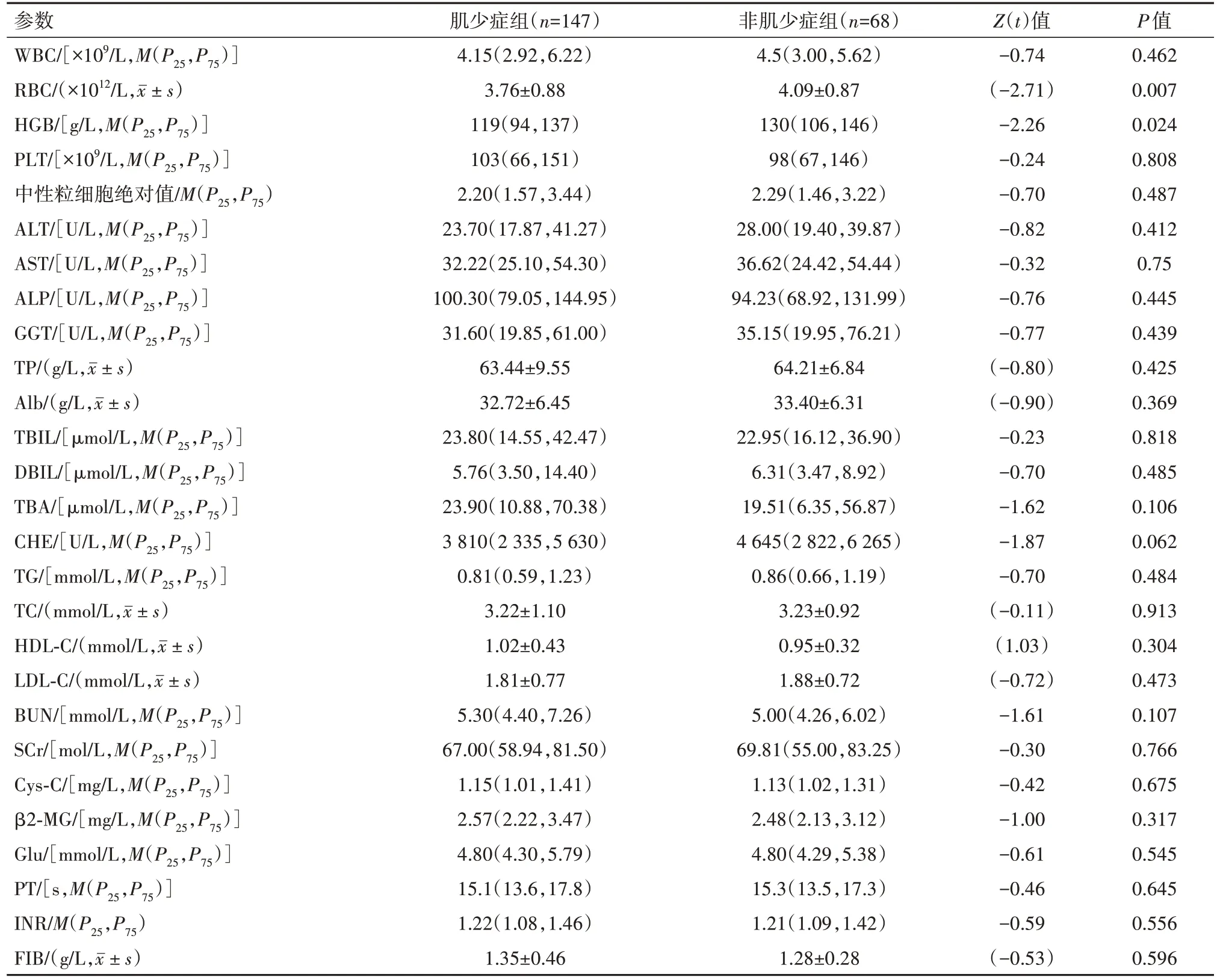
表3 肝硬化肌少症组和非肌少症病人血清学指标的比较
2.2 肝硬化合并肌少症组与非肌少症组病人营养评估和营养风险的比较 两组病人在优势手握力、小腿围、TSF、上臂围、AMC、BMI比较均差异有统计学意义(P<0.05);使用NRS2002营养风险筛查评估两组病人的营养状态,发现营养评分及营养风险比较均差异有统计学意义(P<0.001),见表4。
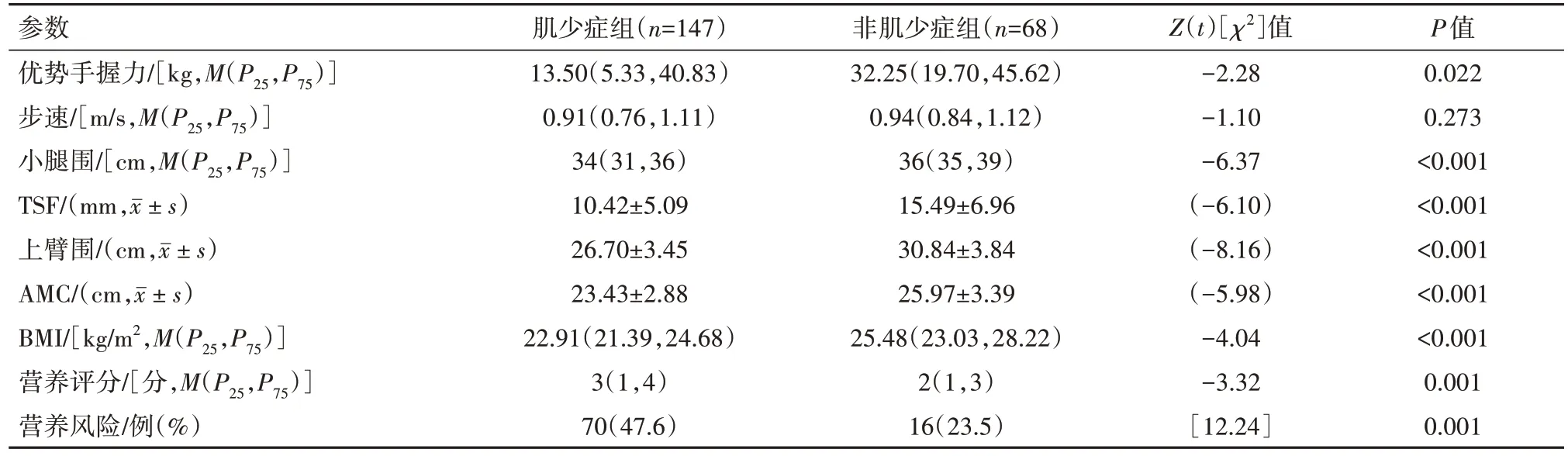
表4 肝硬化合并肌少症组与非肌少症组病人营养评估和营养风险的比较
2.3 肝硬化合并肌少症病人的单因素logistic回归分析 以是否发生肌少症为因变量,将年龄、RBC、HGB、优势手握力、小腿围、TSF、上臂围、AMC、原发性胆汁性胆管炎、腹腔积液、食管静脉曲张出血、自发性细菌性腹膜炎、营养评分、营养风险、MELD低危(≤14分)及BMI等分别纳入到自变量中,进行单因素logistic回归分析,见表5。

表5 肝硬化合并肌少症病人的单因素logistic回归分析
2.4 肝硬化合并肌少症病人的多因素logistic回归分析 以是否发生肌少症为因变量,将年龄、RBC、HGB、优势手握力、小腿围、TSF、上臂围、AMC、原发性胆汁性胆管炎、腹腔积液、食管静脉曲张出血、自发性细菌性腹膜炎、营养评分、营养风险、MELD低危及BMI纳入到自变量,进行多因素logistic回归,结果显示:营养评分[OR=1.78,95%CI:(1.28,2.48),P=0.001]和BMI[OR=0.69,95%CI:(0.61,0.77),P<0.001]是肝硬化病人发生肌少症的影响因素,见表6。

表6 肝硬化合并肌少症病人的多因素logistic回归分析
3 讨论
本研究显示住院肝硬化合并肌少症的发病率为68.3%。既往研究[8]也表明,30%~70%的肝硬化病人罹患肌少症。本研究发病率接近既往文献报道的偏高值,考虑与以下三方面原因有关:①与纳入肝硬化病人的严重程度相关,CTP分级中B/C级共121例(56.3%),而A级仅94例(43.7%)。②合并肝硬化相关并发症的病人肌少症发生率明显较高,其中出现食管静脉曲张伴出血87例(59.1%),其次是合并腹腔积液68例(46.3%),合并感染43例(29.3%),合并肝性脑病34例(23.1%)。与既往研究[15]相一致的是,肝硬化伴有并发症的病人肌少症患病率明显高于无并发症病人,肌少症的发生与肝性脑病、腹水和感染易感性有关。③研究者在进行营养风险评估时发现,多数病人对肝病营养支持治疗的知识欠缺,并且在膳食搭配中对于热量和蛋白质等营养素摄入不足。
肌少症是营养不良的重要表现形式,有时可作为营养不良的同义词[16]。肝硬化病人营养不良的病死率和并发症较高[17]。在本研究中具有营养风险的肝硬化病人肌少症发生率占47.6%,而多因素logistic回归分析也显示营养评分可作为肝硬化肌少症的影响因素。一项应用NRS2002评估营养风险研究结果显示[18],具有营养风险的肝硬化病人肌少症发生率占45.2%,与本研究结果数值相近。肝硬化病人营养不良时会增加肌少症的发生风险。肖慧娟等[12]认为,有营养风险的肌少症发生率明显高于无营养风险的病人。究其原因,肝脏是营养代谢的中心器官,肝硬化病人营养状况常常受损,当病人存在营养不良和糖代谢障碍时,作为能量补偿机制,机体加速分解脂质和蛋白质为糖异生提供底物。由于蛋白质合成和降解的功能下降,蛋白质稳态失衡从而导致骨骼肌质量减少。当蛋白质降解途径的活性超过合成途径时,会造成肌肉萎缩,从而形成肌少症[16]。长期补充支链氨基酸能够增加肌肉蛋白的合成,可改善肝硬化病人的肌肉质量[19]。目前国内外常用的营养筛查方法包括NRS2002、BMI、握力、步速、TSF、上臂围、AMC、小腿围、白蛋白、前白蛋白等,然而这些测量方法常受到外周水肿及胸/腹腔积液的影响。一项研究[18]在应用BMI、TSF、AMC、白蛋白、主观全面评估工具及L3-SMI评估营养状况时,营养不良检出率分别为9.4%,50.9%,51.9%,75.5%,36.8%,68.9%。由于营养状况的评估方式迥异,结果可能存在较大差异。郭会敏等[20]对331例肝病病人进行营养风险评估,发现经NRS2002评估为有营养风险的肝病病人,临床预后较差,需要积极进行营养干预。Kyle等[21]对995例病人进行营养筛查,发现NRS2002相比其他营养评估工具具有更高的敏感度及特异性。在临床应用中,NRS2002营养风险筛查具有普适性,且客观性好及易掌握等优势,能更准确地评估肝硬化病人的营养状况。
BMI可间接反映人体脂肪、肌肉组织及蛋白质存储水平,在营养不良和肌肉质量下降时可出现下降,是评价营养状况的常用指标。研究[22]表明,BMI联合测量大腿肌肉厚度是评估肝硬化病人肌肉减少及营养不良的重要方法。本研究发现,当BMI<22.91 kg/m2时更容易发生肌少症,提示BMI越低则肌少症的发生风险越高;因而,较高的BMI可能是肌少症的保护因素。有研究[12]也认为,低BMI是肝硬化病人发生肌少症的影响因素。另一项研究持相反观点,他们认为[23]肌少症合并肥胖(BMI≥30 kg/m2)的病人比二者单独存在的病死率更高。究其原因,脂肪堆积导致大量脂肪因子的生成异常,促炎巨噬细胞和其他免疫细胞的浸润,导致慢性低水平的炎症环境。另外,脂肪组织可能在骨骼肌外堆积,促进一些炎症因子的分泌释放,最终导致肌肉功能障碍形成肌少症。目前国内外共识仍使用BMI或体质量下降作为营养评估的诊断指标之一,而肝硬化病人常常合并全身水肿、胸/腹腔积液等水钠潴留,仅凭BMI可能会高估病人的营养状况。对此,我们可将病人水肿前的基础体质量和水肿消退后的体质量作为标准体质量,同时联合其他血清学指标或影像学检查提高其评估价值。
综上所述,我们在对住院肝硬化病人进行肌少症筛查时需重视其营养评估,通过对早期对高危人群的营养评估,以期提高肌少症的筛查和评估,规避影像学CT辐射频率;同时,给予临床营养指导,降低肌少症的发生风险,避免肝病相关不良事件的发生。本研究与其他研究结果相比可能存在不同程度的偏差,考虑与以下几方面有关:①肌少症诊断标准在国内外共识中尚未统一,在欧美与亚太的诊断标准中L3-SMI的界值仍存在差异,本研究采用国际认可度相对高的《2018 欧洲共识:肌少症的定义和诊断(更新版)》及我国《终末期肝病临床营养指南》推荐意见中诊断标准;②目前肌少症的临床研究多为回顾性研究,营养评估相关指标的客观化仍有待考证;③本研究为单中心研究,样本量较少,亦非单一病种,存在抽样偏倚的可能。基于上述因素,我们需建立多病种、多中心、大样本的前瞻性队列,积极筛查我国慢性肝病肌少症危险因素,并建立诊断标准,同时随访并开展肝病相关不良事件和临床终点结局的研究,以期填补我国在该领域的临床数据空缺,为肝硬化合并肌少症的临床防治提供依据。

