新生儿缺氧缺血性脑病静息态脑网络改变与行为神经测定的相关性
庞启明,张素丽,李帮涛,李娇扬
(海南省妇女儿童医学中心神经科学部,海南 海口 570312)
缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是脑供血及气体交换不足引起新生儿窒息的一种并发症,可严重影响患儿运动和认知功能的发育,出现新生儿脑损伤、智力低下等神经系统后遗症[1-2]。该疾病的发生不仅影响患儿正常生长发育,也增加了家庭的经济负担。因此,早期识别高危患儿并及时采取有效治疗方案对改善患儿行为神经具有重要意义。影像学检查是临床诊断HIE的常用方法,常规磁共振检查可明确HIE病变范围、程度及类型等,清晰显示患儿病灶位置及邻近结构[3-4]。但有研究指出,常规磁共振检查诊断HIE患儿脑白质病变的能力欠佳,无法准确判断患儿行为神经异常的风险[5]。静息态功能磁共振(resting-state functional magnetic resonance imaging,rs-fMRI)是临床新兴诊断HIE患儿脑功能变化的影像学技术,通过检测大脑皮质区域局部血氧水平变化及磁场的变化了解HIE患儿脑网络功能状态[6-7]。低频振幅(amplitude of low frequency fluctuation,ALFF)是rs-fMRI技术的常用参数,通过监测0.01~0.10Hz频率内血氧水平依赖(blood oxygen level-depen-dent,BOLD)信号强度来反映局部神经活动强弱[8]。目前,关于rs-fMRI技术探究HIE患儿脑网络及新生儿行为神经测定(neonatal behavioral neurological assessment,NBNA)的研究鲜有报道。基于此,本研究收集230例HIE患儿的临床资料,旨在探讨HIE患儿静息态脑网络改变与NBNA的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年5月至2022年10月海南省妇女儿童医学中心收治的HIE新生儿230例为研究对象,其中男113例,女117例,平均胎龄(39.42±1.58)周。纳入标准:①病例诊断依据中华医学会儿科学分会新生儿学组2005年制定的《新生儿缺氧缺血性脑病诊断标准》;②接受rs-fMRI检查;③临床资料完整;④家属签署研究知情同意书。排除标准:①心脏病、神经系统畸形者;②脑梗死、遗传等其他因素导致的脑损伤;③rs-fMRI检查禁忌者;④合并代谢疾病者。
1.2 研究方法
1.2.1 rs-fMRI检查方法
采用PhilipsAchieva 3.OT磁共振机,头部矩阵线圈。扫描序列包括T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)和rs-fMRI。序列扫描参数设置如下:T1WI重复时间(repetition time,TR)为400ms,回波时间(echo time,TE)为8.1ms;轴位T1WI自旋回波(spin echo,SE)序列TR为2 000ms,TE为9ms;轴位T2WI快速自旋回波(fast spin echo,FSE)序列TR为5 000ms,TE为101ms;rs-fMRI TR为1 500ms,TE为27ms,层厚为4mm,层间隔1mm。
全局网络属性参数包括网络强度(Sp)、全局效率(global efficiency,Eglob)、局部效率(local efficiency,Eloc)、最短路径长度(shortestpath length,Lp)、聚散系数(clustering coefficient,Cp)、标准化聚类系数(normalized clustering coefficient,γ)、标准化最短路径长度(normalized shortest path length,λ)等。
1.2.2 NBNA评分
所有纳入研究患儿均于出生后第7d由同一名医师进行NBNA评分。NBNA评分分为5个部分,共20个项目,每项评分(0、1、2),满分40分。总分<35分则判定为神经行为异常(neurobehavioral disorder,ND)。根据NBNA评分结果将230例HIE患儿分为ND组(n=68)和非ND组(n=162)。
1.2.3 观察指标
收集患儿临床资料,包括性别、胎龄、产前检查、分娩方式、产程、孕期贫血、出生1min及5min Apgar评分、HIE分度、宫内窘迫、出生体重及全局网络属性参数等。
1.3 统计学方法
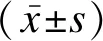
2 结果
2.1 两组患儿不同脑区ALFF值比较
两组患儿不同脑区ALFF值比较发现,ND组患儿前颞叶、中间颞叶、前扣带回、中扣带回、后扣带回、内侧前额叶皮层、额下回、眶额皮层、旁海马皮质、壳核、苍白球脑区的ALFF值均低于非ND组,而楔前叶、距状裂皮质脑区ALFF值高于非ND,差异均有统计学意义(t值介于2.065~4.897之间,P<0.05),见表1、图1。
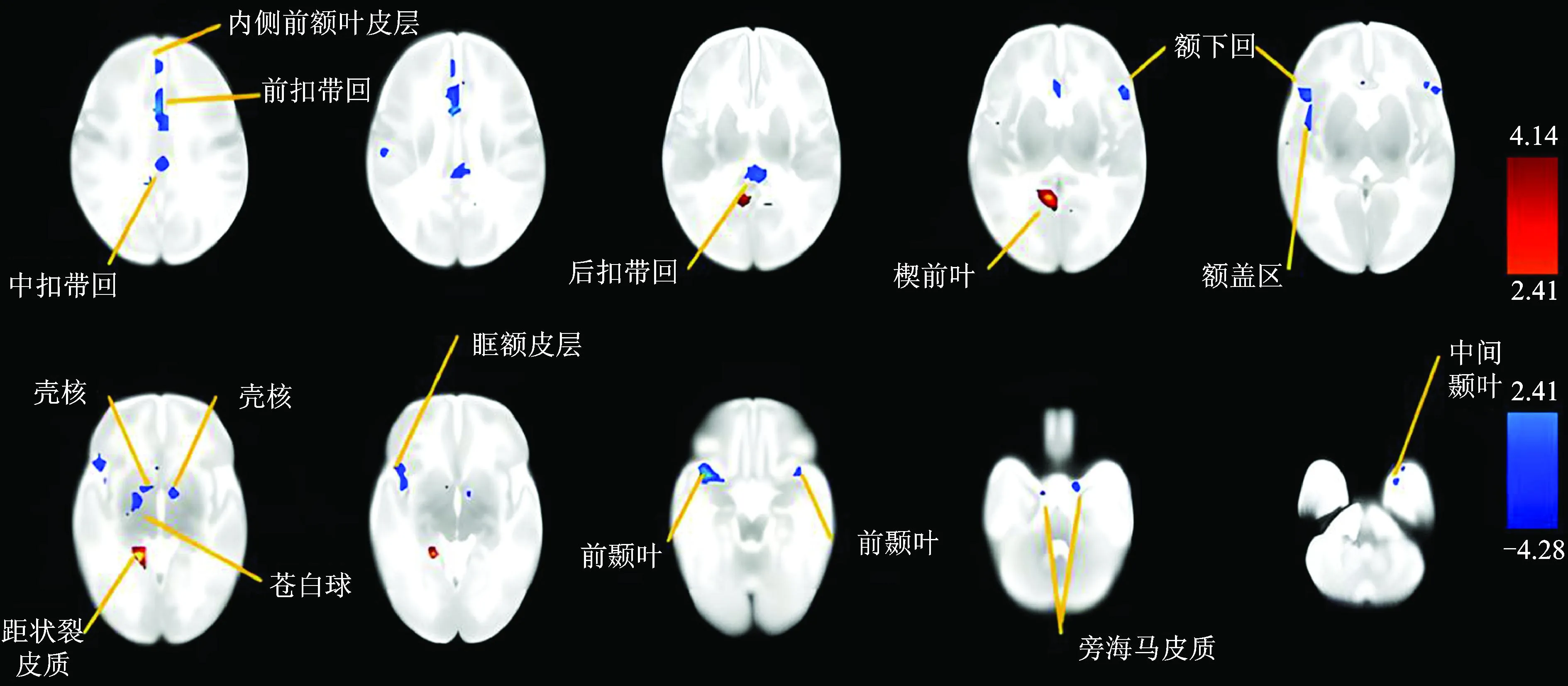
图1 两组患儿ALFF值存在差异的脑区
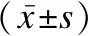
表1 两组患儿不同脑区ALFF值比较
2.2 两组患儿一般资料及脑网络全局属性比较
比较两组患儿的一般资料及脑网络全局属性,结果显示,ND组患儿早产儿占比、重度HIE占比、宫内窘迫占比及低出生体重占比高于非ND组,出生5 min Apgar评分、Eloc、Cp、λ低于非ND组,差异均有统计学意义(χ2/t值介于2.059~27.640之间,P<0.05);两组患儿性别、分娩方式、Sp、Eglob、Lp、γ等方面比较差异无统计学意义(P>0.05),见表2。
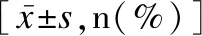
表2 两组患儿一般资料及脑网络全局属性分析
2.3 HIE患儿发生ND的影响因素
以HIE患儿是否发生ND为因变量(是=1,否=0),以胎龄(早产定义为1,足月定义为0)、出生5 min Apgar评分、HIE分度(重度定义为2,中度定义为1,轻度定义为0)、宫内窘迫(发生为1,未发生为0)、出生体重、Eloc、Cp、λ作为自变量,进行多因素Logistic回归分析,结果显示,采用向后逐步回归方法,调整潜在的混杂因素λ后,发现早产、HIE分度(重度)、宫内窘迫是HIE患儿发生ND的独立危险因素,其OR值及95%CI分别为2.217(1.377~2.983)、1.635(1.224~2.358)、1.492(1.039~1.875);出生5min Apgar评分、出生体重、Eloc、Cp是HIE患儿发生ND的保护因素,其OR值及95%CI分别为0.864(0.418~0.902)、0.846(0.313~0.961)、0.753(0.255~0.884)、0.548(0.374~0.923),见表3。
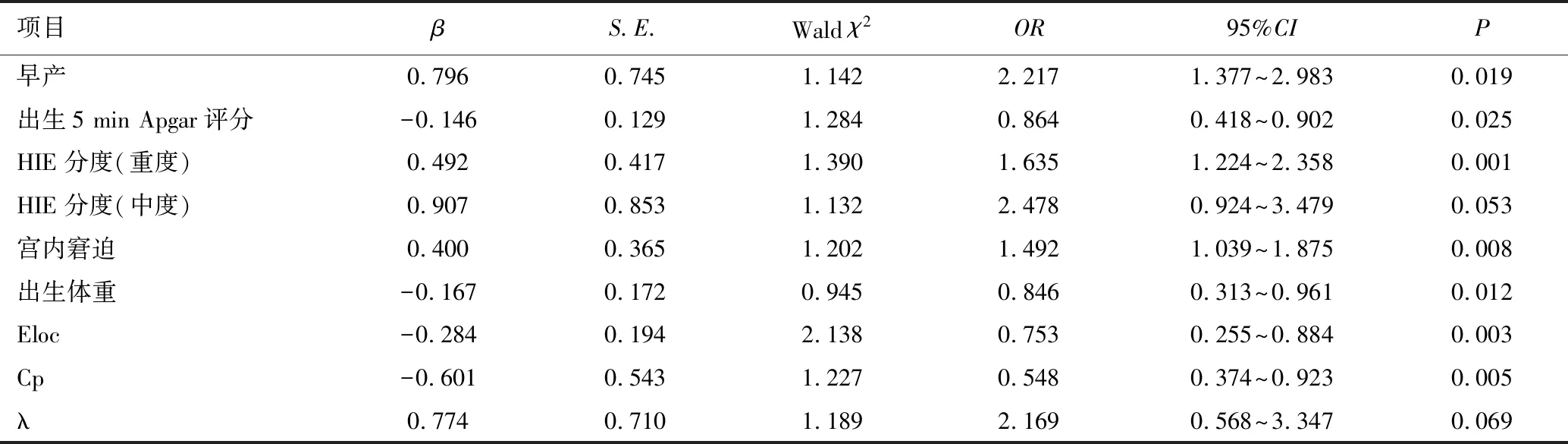
表3 HIE患儿发生ND的多因素Logistic回归分析
2.4 ROC曲线分析全局属性指标对HIE患儿发生ND的预测价值
采用ROC曲线分析Eloc、Cp、λ对HIE患儿发生ND的预测价值,结果显示,Eloc、Cp、λ单独预测及联合预测的曲线下面积(area under the curve,AUC)分别为0.803(0.768~0.871)、0.782(0.724~0.838)、0.769(0.683~0.815)及0.815(0.773~0.896),联合预测的工作性能优于单独作为诊断指标预测重度脑损伤的工作性能,见图2和表4。
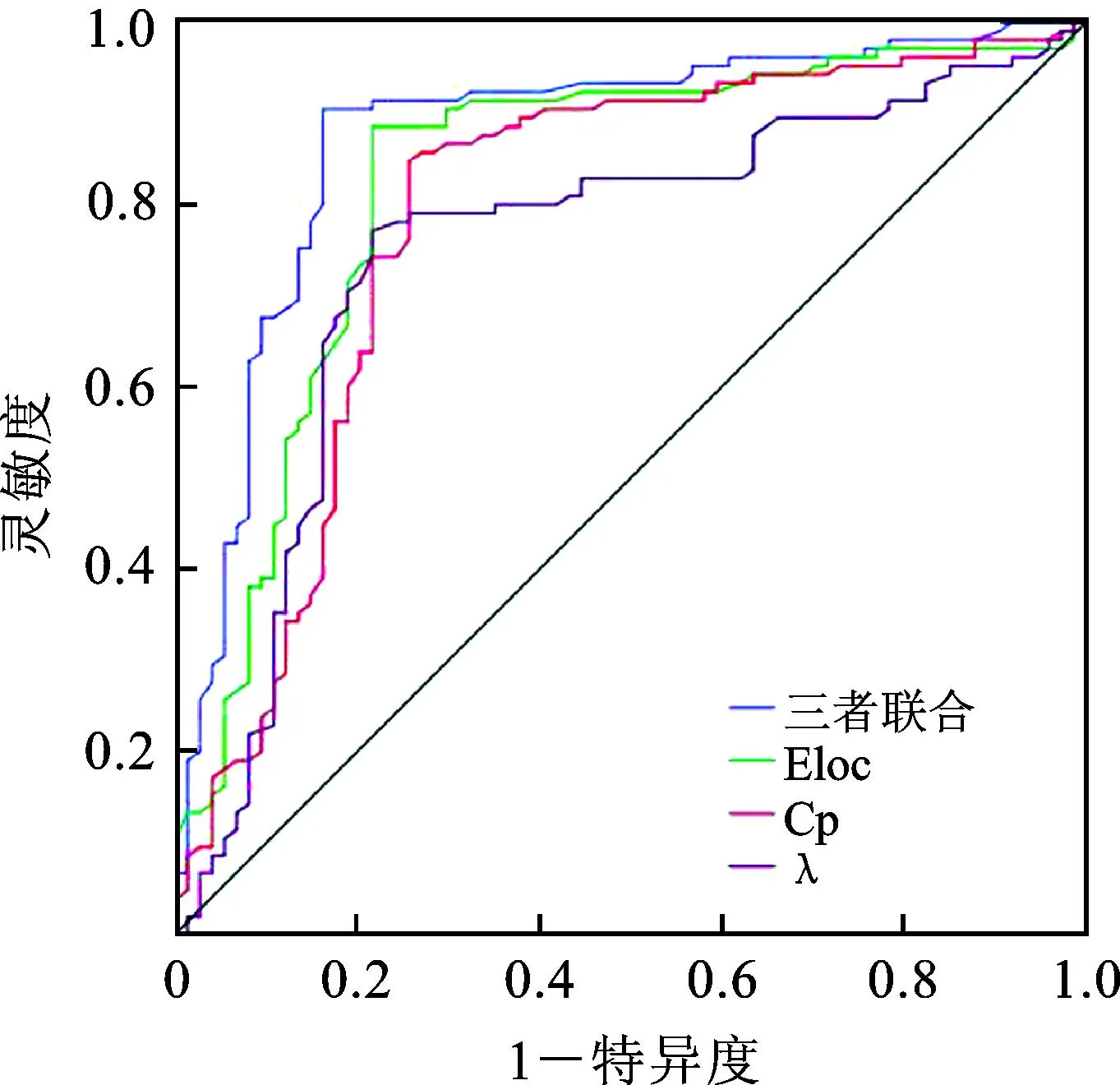
图2 ROC曲线分析全局属性指标对HIE患儿发生ND的预测价值
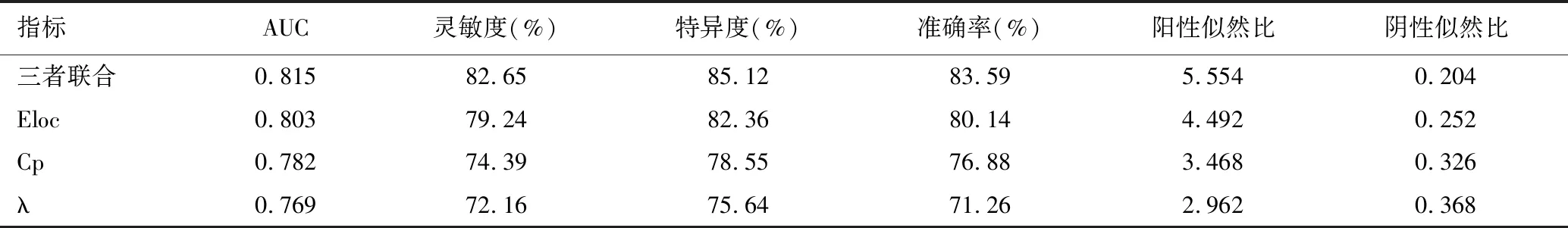
表4 联合预测因子及各原始协变量预测HIE患儿发生ND的ROC曲线参数
2.5 构建HIE患儿发生ND的列线图预测模型
基于上述7项独立预测因素建立HIE患儿发生ND的列线图风险预测模型,列线图中各变量对应分值大小表示该变量对ND发生风险的影响。使用该模型预测HIE患儿ND风险的步骤如下:①确定该患儿各预测变量对应的分值;②将各分值相加,计算总分;③在“总分刻度尺”上找出总分对应位置,得出该患儿ND的风险值,见图3。
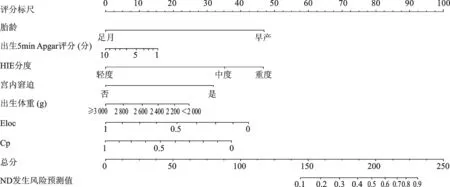
图3 HIE患儿发生ND的列线图风险预测模型
2.6 列线图模型验证
列线图模型的ROC曲线下面积为0.857(0.769~0.923),灵敏度、特异度分别为84.28%和88.43%,区分度较好,见图4。校准曲线结果显示,模型拟合度良好,Hosmer-Lemeshow检验结果差异无统计学意义(P>0.05),该模型的预测指数为0.876,表明该模型整体预测准确度较高,见图5。
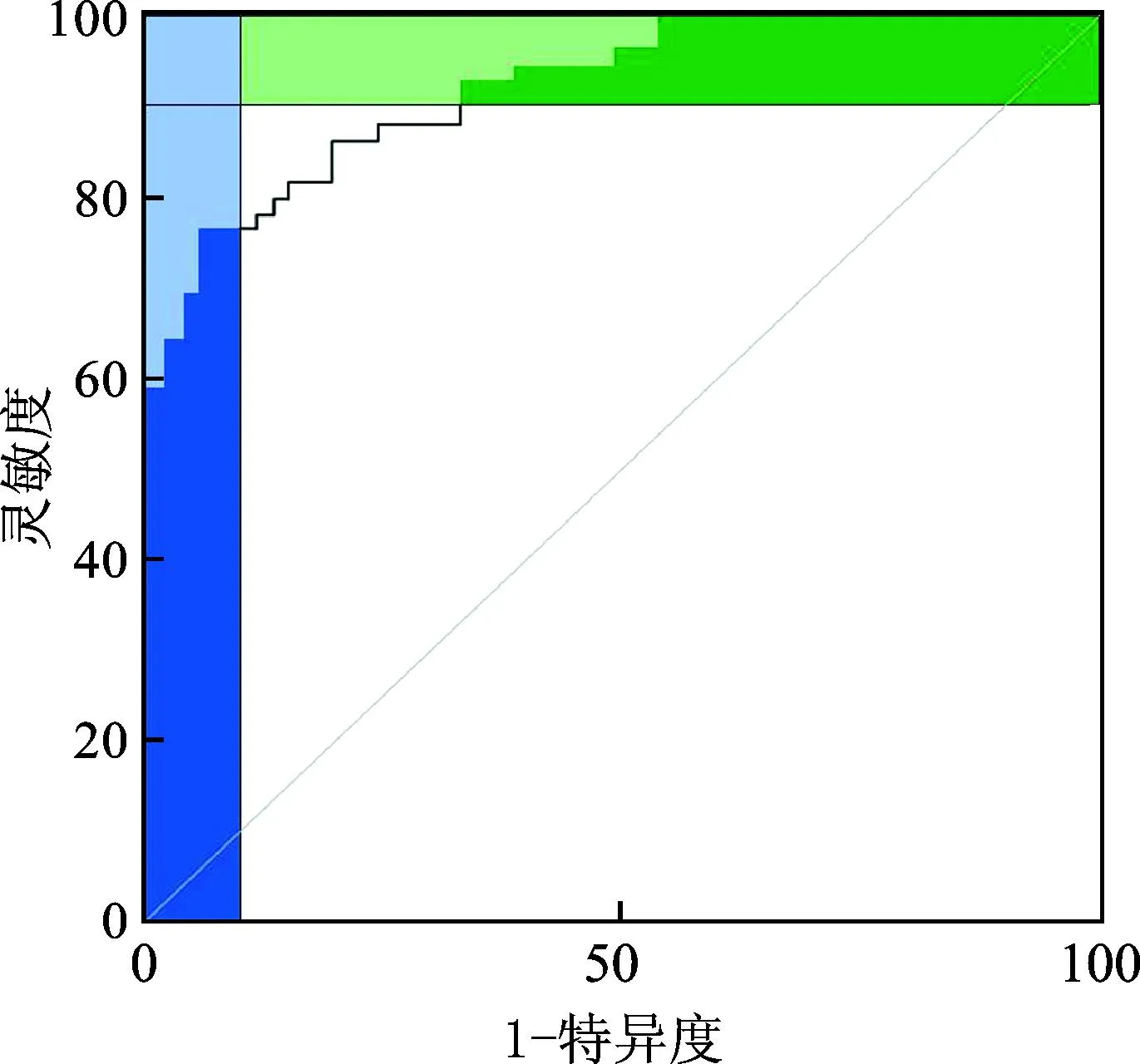
图4 列线图模型的ROC曲线
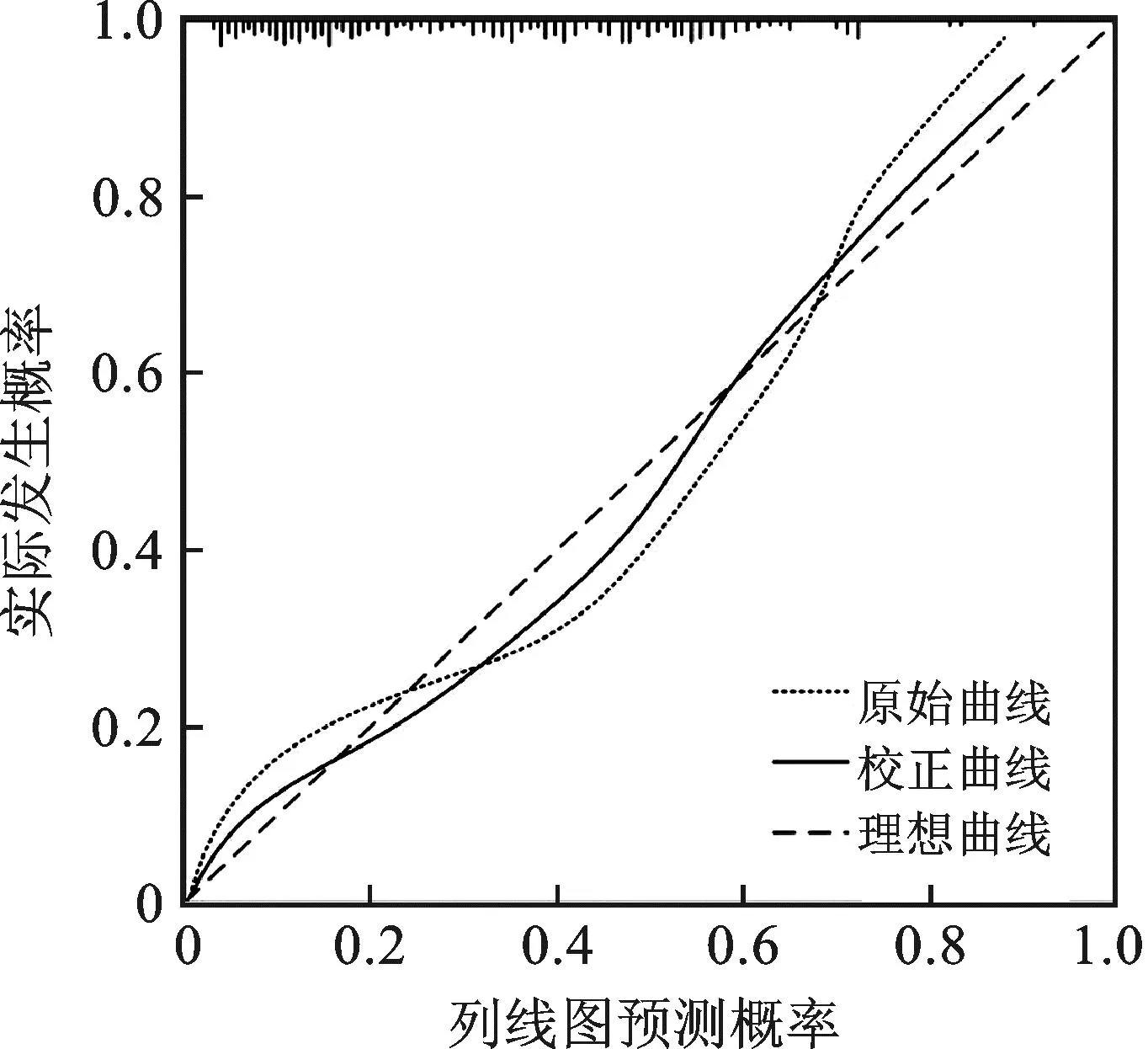
图5 列线图模型的校准曲线
3 讨论
HIE是导致新生儿发生ND、脑损伤及死亡的常见疾病之一,发病机制复杂多样,病情严重者可遗留癫痫、脑瘫等严重后遗症[9]。根据HIE患儿临床表现及形态影像学检查判断脑部结构,明显落后于脑部神经损伤时间[10]。因此,及早诊断及准确评估HIE患者详细病情及脑部结构有助于降低患儿脑神经元凋亡、坏死的风险,从而降低新生儿病死率及致残率。NBNA评分用于评估新生儿综合性行为神经,根据评分结果判断微脑损伤是否发生,可灵敏反映HIE患儿神经系统损伤情况[11]。rs-fMRI技术的应用需采集患者安静时的头颅影像数据,不需要给予外界刺激,可较好的反映患儿静息态脑网络[12]。本研究探讨了HIE患儿的静息态脑网络改变与ND的相关性,以期为临床HIE患儿ND的防治提供理论参考。
3.1 HIE合并ND患儿静息态脑网络变化
本研究中,230例HIE患儿发生ND的概率为29.57%(68/230)。依据ND的发生与否进行分组,比较两组患儿不同脑区ALFF值,结果显示,ND组患儿前颞叶、中间颞叶、前扣带回、后扣带回、中扣带回、内侧前额叶皮层、额下回、眶额皮层、旁海马皮质、壳核、苍白球脑区的ALFF值均明显低于非ND组,而楔前叶、距状裂皮质脑区ALFF值明显高于非ND,提示上述脑区的变化可能与ND发生相关。距状裂皮层与患儿情绪调节有关,其ALFF值的降低可导致患儿情绪处理障碍;苍白球及后扣带回皮层主要与记忆和认知方面有关,处于关键节点,可导致患儿日后记忆较差及认知发展障碍[13]。HIE的发生导致大脑神经运动功能及信息整合、学习记忆相关的纤维受损严重,致使静态脑网络ALFF值降低,患儿的主动肌张力和行为能力评分相应地降低,进而导致NBNA评分降低,从而导致ND的发生。
3.2 HIE患儿发生ND的影响因素分析
本研究比较了发生ND的HIE患儿与未发生ND患儿的临床资料和脑网络全局属性参数,经分析发现,早产、HIE分度、宫内窘迫是HIE患儿发生ND的独立危险因素,出生5 min Apgar评分、出生体重、Eloc、Cp是发生ND的保护因素。与足月患儿相比,早产患儿胎龄较小、出生体重较轻,各器官及身体功能发育完善度较低,机体耐受较差,缺氧情况下脑组织及神经细胞更易损伤,从而引发患儿发生ND[14]。HIE分度越高提示患儿HIE病情越严重,重度HIE患儿心、脑等各脏器负担较重,身体机能紊乱更加严重,致使大脑负担加重、行为神经受损,NBNA评分降低[15]。宫内窘迫的发生可导致胎盘、脐带与胎儿之间血液循环受阻,引起新生儿缺氧窒息,若未进行及时干预,缺氧缺血情况持续加重直至突破新生儿身体耐受力,便会导致脑组织大量神经细胞被破坏,引起新生儿智力下降、认知较差、行为异常等不良结局[16]。出生5 min Apgar评分越低说明患儿窒息较严重,脑细胞正常功能及患儿神经系统被损伤的可能性较大,Apgar评分持续保持低水平的情况下,说明患儿窒息仍未得到有效缓解,可引发脑水肿、脑损伤等严重后遗症[17]。
3.3 合并ND的HIE患儿全局属性参数变化及相应列线图预测模型的构建
既往研究表明[18],人脑功能网络具有“小世界”特性,即Cp较高和Lp较短,可高效完成信息传递。已有研究证实,婴儿出生开始大脑网络就已具有小世界属性,本研究结果与之一致[19]。在本研究中,ND组患儿Eloc及Cp明显低于非ND组患儿,提示HIE合并ND患儿脑功能网络发育较不成熟,尤其网络整体及局部传递信息的能力较差,致使大脑指令下达速度较慢,患儿行为迟缓[20]。本研究将筛选出的影响HIE患儿ND发生的7个独立预测因素进行整合,建立预测HIE患儿ND发生风险的列线图模型,并进行了模型评价,结果显示,该列线图模型具有良好的区分度和预测准确度。
同时,本研究还存在以下几点局限性:第一,本研究所纳入研究对象均来源于单个中心,所收集的潜在预测变量种类受临床实际限制;第二,本研究为回顾性研究,且纳入患儿病例较少,日后仍需进一步扩大样本量,进行前瞻性、多中心的研究;第三,仅以是否发生ND作为模型因变量,可考虑从ND程度或NBNA评分方面对其进行量化,进一步优化模型。
综上所述,发生ND的HIE患儿静息态脑网络的脑区ALFF值具有明显改变,早产、HIE分度、宫内窘迫是HIE患儿发生ND的独立危险因素,出生5 min Apgar评分、出生体重、Eloc、Cp是发生ND的保护因素,可通过检测患儿静息态脑网络状态判定患儿ND的发病情况。

