基于eDNA 技术的舟山近海中国团扇鳐定性与定量分析
高天翔,张浩博,王晓艳,陈 治
(1.浙江海洋大学水产学院,浙江 舟山 316022;2.浙江海洋大学,国家海洋设施养殖工程技术研究中心,浙江 舟山 316022;3.海南热带海洋学院水产与生命学院,海南 三亚 572022)
生物都通过产生粪便、尿液、唾液、皮肤细胞的方式将DNA 排出或脱落到周围环境中,这类大量存在于环境中的DNA 片段总和称之为环境DNA(environmental DNA,eDNA)[1]。eDNA 技术即以此为基础,通过适当的研究手段实现对环境中的目标物种或生物群落进行监测。该技术具有低成本[2],高灵敏度[3],非侵入性等优势[4],能够有效克服传统水生生物调查方法的弊端,已成为监测水生生物物种多样性、生物量及其时空分布的重要手段[5-6]。目前,eDNA 分析技术已被证明可以有效地对目标物种进行定性和定量检测。例如,Parsons 等[7]利用eDNA 在阿拉斯加东南部内陆水域中检测到难以监测的鼠海豚(Phocoena phocoena);Goutte 等[8]的研究表明,eDNA 方法与电鱼调查结果中各个物种丰度相差无几,eDNA 在水生生物定量研究方面具有可靠性;Wang 等[9-11]使用TaqMan 探针在东海成功监测到大黄鱼(Larimichthys crocea)、小黄鱼(L.polyactis)以及入侵物种——眼斑拟石首鱼(Sciaenops ocellatus)的分布。总体而言,eDNA 分析既可以用于单个物种,如入侵物种或稀有物种的调查[12],也可以与高通量测序技术结合,研究整个群落的物种组成和多样性[13]。研究表明,单一物种特异性PCR 方法可能比多物种高通量测序方法更为敏感和准确[14-15]。荧光定量PCR(qPCR)是目前基于eDNA 样本分析物种特异性最常见的方式。然而,最近的研究表明,与qPCR 技术相比,微滴式数字PCR (ddPCR)技术对环境样本中eDNA 的检出率更高[16-17]、对反应抑制物的耐受能力也更强[18-19]。目前,ddPCR技术已成功应用于鱼类eDNA 检测[16-17,20]。
中国团扇鳐(Platyrhina sinensis)隶属于软骨鱼纲(Chondrichthyes)鲼目(Myliobatiformes)团扇鳐科(Platyrhinidae)团扇鳐属(Platyrhina),为小型底层软骨鱼类,主要分布于北太平洋西部,我国东海南部(台湾海峡)及南海海域,是近海底拖网的重要渔获物之一。目前,已有不少关于中国团扇鳐生长特性、肌肉水分、灰分与能值、年龄结构、生长特性、肝脏的生化组成以及鳐类的系统进化等研究报道[21-23]。2018 年,Chen 等[24]对采自浙江舟山近海的中国团扇鳐进行了详细的形态描述和DNA 条形码分析,这是目前关于中国团扇鳐在中国境内的最北记录。中国团扇鳐系暖温性沿岸鱼类,在台湾海峡以北分布数量并不多。由于其活动力差,仅能利用其强壮尾部左右摆动前进,故常蛰伏于近海底层,通过传统渔业调查方式采集样品存在较大难度。因此,使用eDNA 分析技术能够更加有效地探测中国团扇鳐的潜在分布区及生物量。目前,国内外尚未见关于中国团扇鳐eDNA 分析方面的研究报道。本研究尝试使用eDNA 定量检测技术,探讨该技术用于中国团扇鳐监测方面的可行性。通过建立和检验中国团扇鳐的特异性引物和TaqMan 探针,以监测舟山近海中国团扇鳐的分布与生物量。本研究将为其他海域的中国团扇鳐资源eDNA 追踪监测奠定基础。
1 材料与方法
1.1 样品采集
采样地点位于浙江省舟山市朱家尖东沙海滩附近(图1)。中国团扇鳐样品主要委托当地渔民采集。采集方式为定置网(采样位点处于朱家尖东沙风景区,该海域禁止拖网作业)。eDNA 水样主要由作者采集完成。采样时间分别为2017 年12 月19 日、2018 年4 月13 日 和2018 年7 月14 日。使用6 个体积为5 L 的矿泉水瓶进行取样,采样前用浓度为0.1%的次氯酸钠溶液对矿泉水瓶进行消毒处理,并取等量的纯净水作为阴性对照。水样采集过程中测量海水表层温度,并观测取样点的底质。实验过程中操作人员严格遵守浙江海洋大学动物实验伦理规范,并按照浙江海洋大学动物实验伦理委员会制定的规章制度执行。

图1 中国团扇鳐采样站位图Fig.1 Stations of P.sinensis and water samples
1.2 DNA 提取及PCR 扩增验证
采用苯酚-氯仿方法从中国团扇鳐肌肉中提取DNA。使用硬骨鱼类细胞色素c 氧化酶亚基I基因(COI)通用引物F1(5′-TCAACCAACCACA AAGACATTGGCAC-3 ′)、R1(5 ′-TAGACTTCTG GGTGGCCAAAGAATCA-3′)进行PCR 扩增[25]。反应体系:DNTPs 2 μL (2.5 μmol/L),10×buffer(含Mg2+) 2.5 μL,rTaq0.15 μL(5 U/μL),上下游引物各1 μL(10 μmol/L),DNA 模板1 μL(50 ng),超纯水补齐总体积至25 μL。反应程序:95 °C 预变性5 min;40 次循环过程为95 °C 变性30 s,58 °C退火30 s,72 °C 延伸30 s,最终在72 °C 延伸10 min 后于4 °C 保存。PCR 产物质量采用1%琼脂糖凝胶电泳法来检测,挑选电泳条带单一且明亮的PCR 产物送至生工生物工程(上海)股份有限公司进行双向测序。测得的序列使用SeqMan 软件进行拼接、比对及人工手动校对,得到准确的中国团扇鳐COI 基因片段序列。
1.3 中国团扇鳐特异性引物及探针的设计和验证
在中国近海,中国团扇鳐的科内近缘种仅汤氏团扇鳐(P.tangi)一种,因此本实验采用汤氏团扇鳐作为验证物种。使用Primer Express 3.0 软件基于中国团扇鳐标准COI 片段进行特异性引物与TaqMan 探针的设计。设计好的引物和探针由生工生物工程(上海)股份有限公司合成。TaqMan 探针5′端使用FAM (荧光素) 进行标记,3′端用TAMRA进行修饰。使用实时荧光定量PCR (quantitative real-time PCR,qPCR)验证引物和探针的特异性。
qPCR 反应体系采用20 μL 体系:Premix ExTaq10 μL,正反向引物各0.4 μL (10 μmol/L),DNA模板2 μL (50 ng),探针0.4 μL(10 μmol/L),超纯水补齐至20 μL。扩增反应程序:预变性94 °C 10 s;94 °C 5 s,60 °C 23 s,45 个循环。qPCR 扩增仪器为ThermoFisher 7300 Plus Real-Time PCR System。
1.4 eDNA 提取及定量检测
由于舟山近海水体较为浑浊,因此使用优化后的方案提取eDNA。具体提取步骤:使用直径47 mm、孔径0.45 μm 的醋酸纤维素滤膜(上海兴亚)抽滤,将eDNA 富集到滤膜表面。将滤膜使用锡箔纸包裹后放入冻存管,置于-80 °C 保存。同时抽滤等体积的纯净水作为阴性对照。使用DNeasy Blood and Tissue Kit 试剂盒进行eDNA 提取,随后用酶标仪及iQuantTM BR dsDNA Quantitation Kit (0.05~1 000 ng/μL)核酸定量检测试剂盒测定其质量浓度。对提取的eDNA 样品使用QuantStudioTM3D 数字PCR 仪进行eDNA 定量分析。反应体系与“中国团扇鳐特异性引物及探针的设计和验证”中qPCR 验证相同。热循环条件:50 °C 孵育2 min 进行UNG 酶激活,95 °C 预变性2 min,45 次循环过程为95 °C 变性5 s,60 °C 退火/延伸23 s。对于浓度极低的水样,模板eDNA量加倍(由2 μL 增加到4 μL)后进行扩增。将反应体系加入电子芯片后进行油封并压紧,随后放入反应箱进行PCR 扩增,最后直接用芯片读取eDNA 浓度。
1.5 数据分析
使用SPSS 18.0 软件对水样eDNA 浓度与采样点、采样时间进行差异显著性分析。
2 结果
2.1 中国团扇鳐定置网样品采集情况
“2018 年4 月14 日—2018 年7 月14 日”期间共采集到中国团扇鳐21 尾,日均采集样品数最高,为0.228 2 尾/d。“2017 年10 月1 日—2017 年12月19 日”期间共采集到12 尾样品,日均样品数约为0.104 3 尾。“2017 年12 月20 日—2018 年4 月13 日”期间仅采集中国团扇鳐5 尾,在3 个时间段中渔获尾数最少 (表1)。

表1 中国团扇鳐样品采集信息Tab.1 Sampling information of P.sinensis
多数采样点底质为礁石和细沙。A、D 两点较为特殊,分别为碎砾、礁石与细沙(图1)。7 月水温最高且均大于26 °C,12 月和4 月水温差异不大,在15~16 °C 波动。采样水温及采样点底质具体信息如表2 所示。

表2 采样时的水温及采样点质地Tab.2 Water temperature and sediment information of sampling stations
2.2 中国团扇鳐特异性引物和探针及其验证
通过中国团扇鳐与汤氏团扇鳐COI 基因片段序列比对,设计的特异性引物和探针位于中国团扇鳐线粒体基因组2 636~2 769 bp 位置处 (图2)。包括引物在内的扩增片段大小为134 bp,其引物为ZF-F-2636: 5 ′-GCAGGAGCTTCTGTGGACT-TAACTATT-3′、ZR-F-2769: 5′-ACATCTAGCGGGAGTCTCTTCCATTCTG-3′,探针为Zpro-2671:FAM-ACATCTAGCGGGAGTCTCTTCCATTCTGTAMRA (表3)。
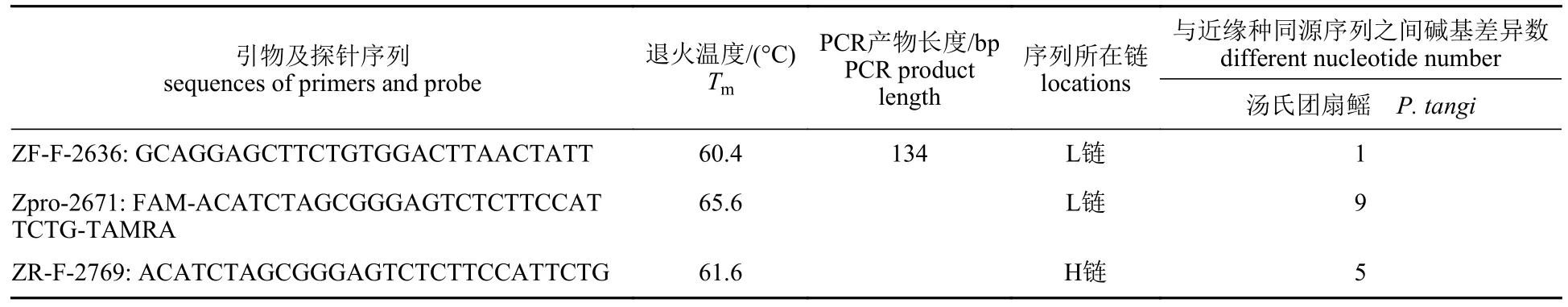
表3 中国团扇鳐特异性引物、探针信息Tab.3 Information of specific primers and probe of P.sinensis
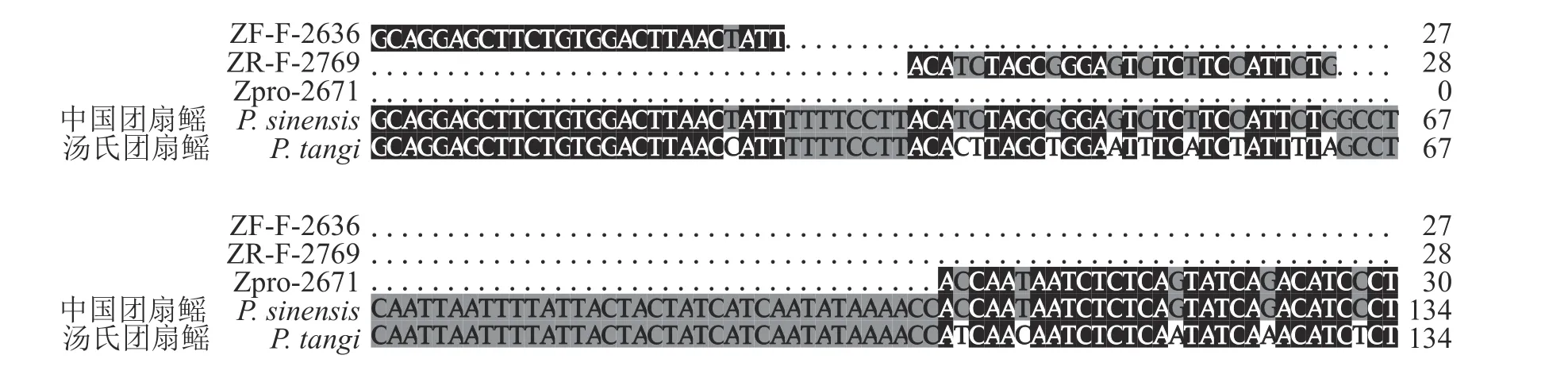
图2 中国团扇鳐引物、探针序列与汤氏团扇鳐碱基差异情况Fig.2 Nucleotide variation of primers and probe between P.sinensis and P.tangi
经qPCR 扩增验证,中国团扇鳐特异性引物和探针仅对中国团扇鳐样品出现强荧光信号,表现为阳性扩增,而其近缘种汤氏团扇鳐和空白对照均未获得扩增,表现为阴性。qPCR 验证的Ct值见表4。上述结果表明,本研究所设计的引物与探针具有高度的特异性,可用于舟山近海中国团扇鳐的检测和区分。

表4 基于荧光定量PCR 的中国团扇鳐引物、探针特异性验证结果Tab.4 Specificity verification results of primers and probes of P.sinensis by qPCR
2.3 数字PCR 定量结果
数字PCR 监测结果显示,于2018 年7 月14日采集的水样中检测到的eDNA 浓度最高,其次是2017 年12 月19 日采集的水样(表5)。于2018年4 月13 日期间采集的水样中,仅在少数站位检出中国团扇鳐eDNA,且浓度较低(图3)。

表5 不同采样点的中国团扇鳐eDNA 浓度Tab.5 eDNA concentration of P.sinensis from different stations
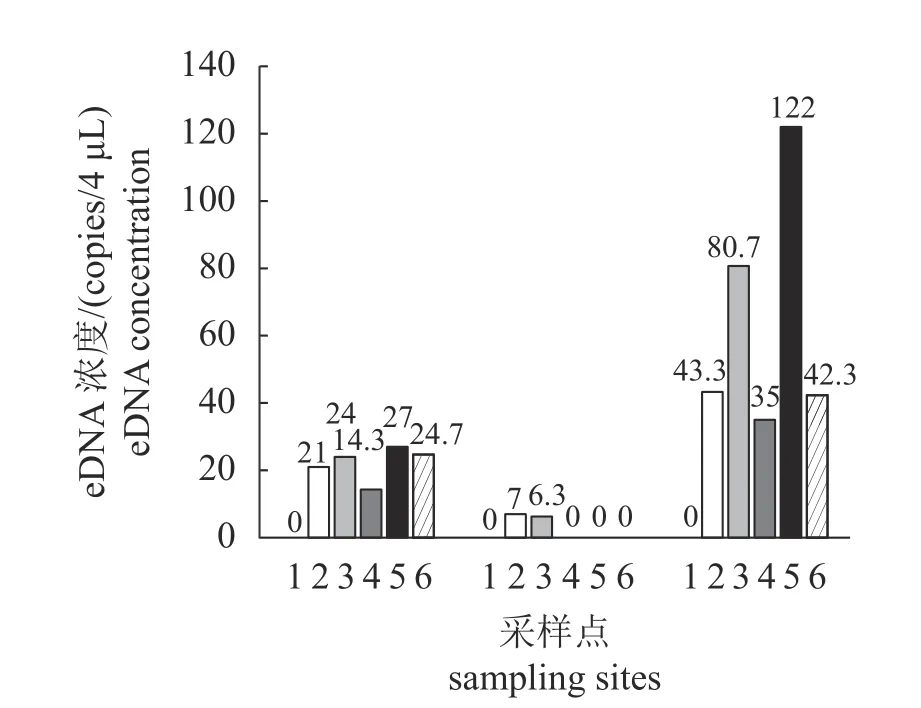
图3 不同时间、不同地点的中国团扇鳐eDNA 浓度横坐标数字代表采样位点:1.A,2.B1,3.B2,4.C1,5.C2,6.D。Fig.3 eDNA concentration of P.sinensis at different time and stationsThe numbers in the horizontal coordinates represent the sampling sites:1.A,2.B1,3.B2,4.C1,5.C2,6.D.
2.4 显著性分析
同一时间不同采样点对中国团扇鳐eDNA浓度的影响 单因子方差分析结果显示,2017年12 月19 日、2018 年4 月13 日、2018 年7 月14 日A、B1、B2、C1、C2、D 等6 个采样点之间的eDNA 分子拷贝数之间皆存在极显著差异(表6)。
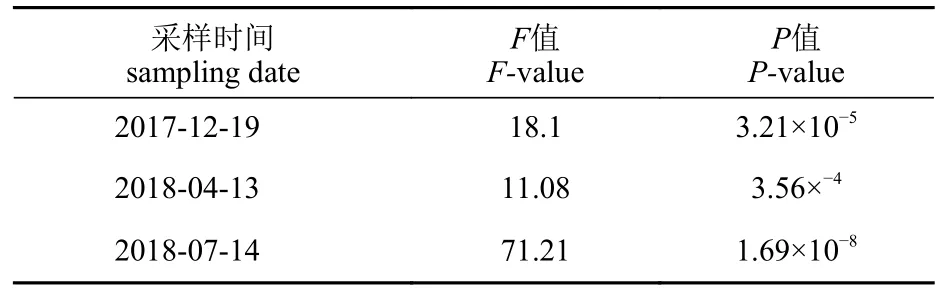
表6 各采样点间eDNA 浓度差异显著性分析Tab.6 Significance analysis of eDNA concentration difference among each sampling stations
同一采样点在不同采样时间内的差异使用单因素方差分析同一采样点在不同采样时间内的差异结果如表7 所示。除A 采样点外,其余4 个采样点在3 个采样时间组间均存在极显著差异。上述显著性分析表明,季节和采样点底质可能是影响中国团扇鳐eDNA 浓度的因素。

表7 不同采样时间eDNA 浓度差异显著性分析Tab.7 Significance analysis of eDNA concentration difference among different sampling date
3 讨论
3.1 中国团扇鳐的特异性引物和探针
使用特异性引物和探针监测单一物种是eDNA 技术重要的应用之一。相比于扩增序列非特异性检测方法(如SYBR green I 染料法),特异性检测方法(如使用TaqMan 探针)具有更强的特异性和更高的稳定性,能够更好地排除假阳性结果的产生[26]。目前基于TaqMan 探针的eDNA 检测技术已被广泛应用于各类水生生物。Ficetola 等[27]对入侵物种美国牛蛙(Rana catesbeiana)的研究表明,即使目标水域内的牛蛙数量很少,亦可通过eDNA 方式将其检测出来,并且首次证明了eDNA 方法在水生生态系统进行研究的可行性。Tillotson 等[28]使用TaqMan 探针在小溪中发现了eDNA 浓度与红鲑(Oncorhynchus nerka)丰度之间存在强烈的定量关系。Knudsen 等[29]针对大西洋鲱(Clupea harengus)、大西洋鳕(Gadus morhua)、欧洲比目鱼(Platichthys flesus)、欧洲鲽(Pleuronectes platesa)和大西洋鲭(Scomber scombrus)开发和测试了TaqMan 探针,并成功应用于这些物种在波罗的海的检测。李苗等[30]在建立和优化使用eDNA 检测技术评估中国明对虾 (Fenneropenaeus chinensis) 生物量时也建议采用TaqMan 探针法。最近,Wang 等[9-11]使用TaqMan 探针在东海成功监测到大黄鱼、小黄鱼以及入侵物种—眼斑拟石首鱼(Sciaenops ocellatus)的分布。本研究中,将中国团扇鳐和汤氏团扇鳐的COI 序列进行比对,设计了中国团扇鳐的特异性引物和TaqMan 探针。在引物探针的特异性验证过程中,仅有中国团扇鳐样品检测出阳性信号。表明所设计的引物和TaqMan 探针有效,可用于舟山近海中国团扇鳐资源的定性与定量检测。
3.2 eDNA 检测技术的高灵敏度
本实验使用eDNA 定量检测技术,证明了该技术用于中国团扇鳐资源监测的可行性。根据中国团扇鳐定置网样品采集情况,推测舟山近海中国团扇鳐资源量较少。定置网A、B、C 等3 个采样点的最大捕获量为92 d21 尾,平均每天0.228 3尾。但eDNA 定量分析结果仍成功检测出了中国团扇鳐阳性信号。eDNA 定量检测技术在目标物种密度较低的情况下具有很高的灵敏度。这与已有的eDNA 定量检测结果一致[31-34]。然而,eDNA定量检测技术的高灵敏度是有限度的。2018 年7月14 日,定置网A 中出现一尾重量为370.6 g 的中国团扇鳐,ddPCR 检测却并没有检出中国团扇鳐eDNA 的存在。水体中的eDNA 分子可能受到了水体体积、水体流速、水样采集点与定置网距离等诸多因素的影响,导致水样中未能采集到中国团扇鳐eDNA 分子。
3.3 栖息环境对中国团扇鳐分布的影响分析
底质对中国团扇鳐的分布影响显著。本次实验进行了3 个时间点的样品采集。A 点3 次取样都未能检测到水体中存在中国团扇鳐eDNA,该点是中国团扇鳐的一个“盲区”。单因子方差分析结果显示,A、B1、B2、C1、C2、D 6 个采样点之间的eDNA 分子拷贝数存在极显著差异。造成A 点中国团扇鳐数量较少的原因,可能是因为A点的底质以“礁石、碎砾”为主(肉眼可见),而其他采样点虽有礁石,但却有面积较大的细沙。表明中国团扇鳐对栖息环境存在不同喜好,这与已报道的中国团扇鳐的“喜沙”生态习性相一致[35]。
水深对中国团扇鳐的分布亦有影响。B1、B2、C1、C2、D 5 个采样点中,以D 点的泥沙数量最多、粒径最细,但该点的eDNA 分子拷贝数却并非最高—B2、C2 2 处的eDNA 浓度都高于或略高于该点。造成这种现象的原因,很可能是D 点的水深较浅(30~50 cm),而B2、C2 采样点由于离沙滩较远,导致水下坡度急剧增大,说明中国团扇鳐会寻找泥沙和水深的最适点。有研究表明,中国团扇鳐主要栖息于水深60 m 的海底[33-34]。本研究虽然在近岸水域发现并捕捞到中国团扇鳐个体,但并未对其他水深区域进行eDNA 调查,离岸较远的深水区可能有更多数量的中国团扇鳐分布。
中国团扇鳐具有喜温性。同一采样点不同采样时间内的差异分析表明,除A 点外,其余5 个eDNA 采样点中的任意一点在2017 年12 月19 日、2018 年4 月13 日、2018 年7 月14 日3 个时间组间均存在显著差异。这意味着季节对中国团扇鳐的分布具有极显著的影响。该特点在C2 点表现得尤为典型:4 月海水表面温度最低时(15.7 °C),其eDNA 浓度低于检测极限;而7 月水温较高时(26.6 °C)时,其eDNA 浓度高达(122.0 ± 14.1) 个/4 μL。定置网结果与eDNA 结果比较相似,均表明在“2017 年12 月20 日—2018年4 月13 日”冬季到初春期间海水温度的降低,造成了中国团扇鳐数量的减少。
近年来,全球变暖影响了许多鱼种原有的栖息环境[36-38],使得许多鱼类的分布范围发生变动[39-42]。此外,黑潮暖流也是影响中国近海鱼类分布的重要因素[43-45],不同的水流和水团具有不同的温度和盐度特征,从而影响鱼类的洄游[46]。这些因素可能是中国团扇鳐向北迁移的重要原因。本研究中,基于样品采集和环境DNA 两种调查方式,证实了中国团扇鳐在舟山海域3 个季节的存在,表明舟山海域环境适合于该鱼种栖息。尽管舟山是目前为止记录中国团扇鳐分布的最北界[35],但由于中国团扇鳐对栖息环境具有偏好性以及其他环境因素的存在,长江径流、苏北浅滩[47-49]等水流、底质环境因素是否会影响中国团扇鳐在舟山以北的分布尚不得而知,需要进一步研究。
感谢舟山朱家尖东荷嘉园贺敏光先生帮助采样。
(作者声明本文无实际或潜在的利益冲突)

