低渗诱导合浦珠母贝的三倍体
范 超,张学开,张兴志,唐黎明,李金龙,李琼珍,王昭萍*
(1.中国海洋大学,海水养殖教育部重点实验室,山东 青岛 266003;2.广西水产科学研究院,广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
近年来,利用先进生物技术和细胞遗传技术改善生物品质和养殖品种,是生物育种研究和养殖的热点。其中,多倍体育种是通过增加染色体组的方法改变生物的遗传基础,从而培育出具有较高经济价值的优良品种,是目前生物遗传育种中具有较高应用价值的领域之一。三倍体由于比二倍体多一套染色体组,一般生长速率较快、个体较大、糖原含量也更高。由于三倍体育性较差,因此在繁殖季节肥满度较高,死亡率更低。
三倍体育种作为国内外的研究热点之一,在水产动物遗传育种研究中也取得了较好的成绩。从20 世纪70 年代开始,研究成功的海产鱼类便已有十余种,如黄盖鲽(Pseudopleuronectes yokohamae)、大菱鲆(Scophthalmus maximus)、漠斑牙鲆(Paralichthys lethostigma)、大西洋鲑(Salmo salar)、真鲷(Pagrus major)及黑棘鲷(Acanthopagrus schlegelii)等[1]。Stanley 等[2]于1981 年利用细胞松弛素B(Cytochalasin B,CB)首次成功诱导出的美洲牡蛎(Crassostrea virginica)三倍体。自此之后,研究人员对多种贝类进行了三倍体研究,并成功诱导出三倍体。如利用CB、6-DMAP 等药物通过化学方法诱导得到的三倍体贝类有长牡蛎(C.gigas)[3-5]、海湾扇贝(Argopecten irradians)[6]、虾夷扇贝(Patinopecten yessoensis)[7]、栉孔扇贝(Chlamys farreri)[8-9]、皱纹盘鲍(Haliotis discus hannai)[10]和缢蛏(Sinonova culaconstricta)[11]等;利用温度、盐度等物理方法诱导得到三倍体的贝类有栉孔扇贝[12-13]、文蛤(Meretrix meretrix)[14]、长牡蛎[15]及虾夷扇贝[16]等;此外,还有利用生物方法实现规模化生产的长牡蛎、美洲牡蛎等。
合浦珠母贝是我国最主要的海水珍珠贝类,我国海水珍珠几乎全部由合浦珠母贝所产。但近年来,由于受城市建设和长期不当养殖及近亲繁殖的影响,合浦珠母贝野生资源遭到破坏。不注重科学育种及母贝的择优与复壮研究,使得我国合浦珠母贝所产珍珠颗粒变小、珠层薄,养殖规模和产量急剧滑坡。因此,利用三倍体的不育性和生长速率快等特点来降低繁殖期的死亡率和增大珍珠规格是改善这一现状的方法之一。国内外学者对此也进行了诸多研究。其中涉及了静水压法诱导[17]、化学药物诱导[18-19]等。
目前还没有利用低渗对合浦珠母贝进行三倍体诱导的相关报道。本研究通过不同盐度对合浦珠母贝进行三倍体诱导,为合浦珠母贝三倍体育种提供新的实验依据;同时利用主成分分析方法对卵裂率、孵化率、存活率、壳长以及三倍体率进行综合评估,以期为合浦珠母贝三倍体育种规程的构建提供理论依据。
1 材料与方法
1.1 亲本来源
实验组和对照组所用亲贝均为在北海铁山港区火禄村小宇宙合作社的二龄养殖群体。亲本于2019 年4 月从养殖场运至广西水产科学院国家贝类产业技术体系广西综合试验站孵化场。去除死贝和壳型不规整的个体,清除贝壳上的附着物,装入扇贝笼中吊养在水泥池中暂养1 周。暂养期间每天投饵两次,每次投喂足量亚心形扁藻(Platymonas subcordiformis),每天全量换水1 次。暂养水温24~25 °C,盐度30。本研究获得了中国海洋大学实验动物管理和使用伦理委员会批准,实验过程中操作人员严格遵守中国海洋大学伦理规范,并按照中国海洋大学伦理委员会制定的规章制度执行。
1.2 人工授精
实验采用解剖法进行人工受精。用牡蛎刀将珍珠贝闭壳肌割断后肉眼观察性腺发育情况,保留性腺饱满的个体。用牙签蘸取少量性腺,在显微镜下(10×)鉴定性别。将雌雄个体分开,雄性置于阴凉处备用。将卵子挤入盛满砂滤海水的20 L 桶中,用100 μm 筛绢滤去组织碎块等大块杂质后,用25 μm 筛绢洗卵3 次。向卵液中滴入几滴氨水(2~3 mmol/L)[20]对卵子进行1 h 以上活化。用1 000 μL 移液枪从每个雄贝性腺中吸取1 mL 精液,放出盛有砂滤海水的5 L 小桶中。显微镜下观察卵子成熟后,向精液中滴入几滴氨水激活精子。在正式受精前检查卵子以排除意外受精的发生。当观察到精子完全激活后,向卵液中注入适量精液开始受精,镜下观察每个卵周围约5~8 个精子。受精后持续观察受精卵发育状态。
1.3 低渗诱导三倍体
诱导盐度 当40%~50 %合浦珠母贝受精卵释放第一极体(PB Ⅰ)时,将受精卵液置于加入后盐度分别为10、12、14、16、18、20、22 的砂滤海水中诱导15 min。以此确定最佳诱导盐度。
诱导时机 当显微镜下观察合浦珠母贝受精卵排放出第一个PB Ⅰ,50 %排放出PB Ⅰ以及第一个第二极体(PB Ⅱ)时开始诱导。诱导盐度为上述盐度中确定的最佳盐度,诱导时间为15 min。以此确定最佳诱导时机。
诱导时间 利用上述最佳诱导盐度和诱导时机组合分别进行10、15 和20 min 诱导。以此确定最佳诱导时间。
低渗诱导实验在5 L 小桶中进行,每种组合设置3 个重复。同时设置一组对照组(C),对照组未经过低渗诱导。诱导结束后用25 μm 筛绢洗去受精卵液中的多余精子,随后将受精卵液倒入盛满砂滤海水的20 L 塑料桶中进行孵化。
1.4 幼虫培育
受精卵大约20 h 后发育至D 形幼虫。用40 μm 筛绢收集幼虫后继续在原桶中培养。幼虫生长到110~120 μm,幼虫以球等鞭金藻(Isochrysis galbana)作为饵料,随着幼虫的生长,饵料中加入牟氏角毛藻(Chaetoceros muelleri)和亚心形扁藻。饵料密度从每天3 000 个/mL 增加至每天8 000 个/mL。三种饵料的比例为1∶1∶1(数量比)。幼虫培育期间每天全量换水1 次,水温24~27 °C,盐度30。
1.5 数据收集和计算
对各组的卵裂率(公式1)、孵化率(公式2)、3、6、9、12、15 日龄的存活率(公式3)和生长参数以及1、3、6、9、12、15 日龄的三倍体率(公式4)进行收集和计算。收集、计算方式:
式中,CR 代表卵裂率(%),NCe代表单位体积内发生卵裂的受精卵数(个/mL),NFe代表单位体积受精卵数(个/mL)。
式中,HR 代表孵化率(%),ND代表1 日龄时单位体积内的D 形幼虫数(个/mL)。
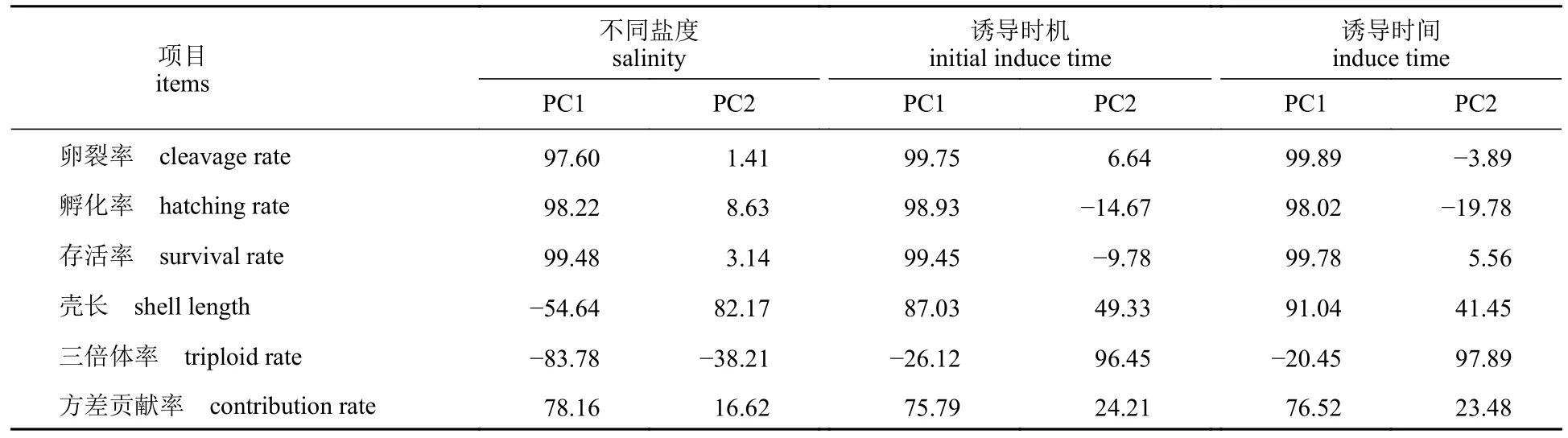
表1 提取主成分的负荷及方差贡献率Tab.1 Factor loading and variance contribution rate of the extracted principal components %
式中,SR 代表存活率(%),Nt代表测量时单位体积内存活幼虫数量(个/mL)。
式中,TR 代表三倍体率(%),ST代表测试群体经流式细胞仪检测后的三倍体细胞数(个),SD代表测试群体经流式细胞仪检测后的二倍体细胞数(个)。
生长参数 分别在显微镜下(10×)测量各组在3、6、9、12、15 日龄时的壳长(μm)。
1.6 数据分析
采用单因素方差分析、Duncan 氏多重比较方法分析不同组合间的孵化率、存活率、生长参数和倍化率的差异。根据李艳双等[21]和李阳春等[22]的方法,对卵裂率、孵化率、15 日龄壳长、15 日龄存活率以及15 日龄三倍体率进行主成分分析。以累积方差贡献率≥85%作为主成分选取标准。综合的得分计算方式:
所有统计分析均使用SPSS 软件(版本22.0)进行,所有分析的显著水平均设置为P<0.05。
2 结果
2.1 不同条件下卵裂率、孵化率和三倍体率比较
不同条件下诱导合浦珠母贝三倍体时的卵裂率、孵化率及1 日龄D 型幼虫三倍体率如图1。结果显示,随着盐度的升高,卵裂率和孵化率逐渐升高,D 型幼虫三倍体率则先上升后降低;对照组的卵裂率和孵化率均与实验组差异显著(P<0.05);盐度14 时,D 型幼虫三倍体率最高(64.16%±6.92%),但仅与盐度22 时(36.48%±4.59%)的差异显著(P<0.05),与其他组的差异均不显著(P>0.05,图1-a)。随着诱导时机的延迟,合浦珠母贝的卵裂率和孵化率逐渐升高;在出现第一个PB Ⅰ和50% PBⅠ时的卵裂率和孵化率差异均不显著(P>0.05);50% PBⅠ时的D 形幼虫三倍体率最高(65.87%±6.51%),与其他2 个时机时的差异显著(P<0.05,图1-b)。随着诱导时间的延长,合浦珠母贝的卵裂率和孵化率逐渐降低,各组之间的差异显著(P<0.05),且均显著低于对照组(P<0.05);诱导15 min 时,D 形幼虫三倍体率最高,为65.14%±1.93%,但与诱导20 min 时的差异不显著(图1-c)。

图1 不同诱导条件下合浦珠母贝卵裂率、孵化率和1 日龄D 形幼虫三倍体率(a) 50%受精卵释放PBⅠ在不同盐度中持续诱导15 min;(b) 不同诱导时机时在盐度14 中诱导15 min;(c) 50%受精卵出现PB Ⅰ在盐度为14 中诱导10、15、20 min。1.卵裂率,2.孵化率,3.1 日龄幼虫三倍体率;相同项目中,不同字母表示差异显著(P<0.05),下同。Fig.1 Cleavage rate,hatching rate,and triploid rate of 1-day-old D-shaped larvae in different induction conditions.(a) 50% of the zygotes released PB Ⅰand were continuously induced at different salinity for 15 min;(b) at different initial induction times,induced at a salinity of 14 for 15 min;(c) 50% of the fertilized eggs released PB Ⅰ and were treated at a salinity of 14 for 10,15,20 min.1.cleavage rate,2.hatching rate,3.triploid rate of 1-day-old D-shaped larvae;in the same index,different letters indicate multiple comparisons significant differences between groups (P <0.05),the same below.
2.2 不同条件下存活率比较
随着培养时间的延长,各诱导盐度中的幼虫存活率逐渐降低,诱导盐度越低,下降速度越快;3 日龄时,只有盐度16 中的幼虫存活率与对照组差异显著(P<0.05),而到了15 日龄,所有实验组幼虫的存活率均与对照组差异显著(P<0.05)(图2-a)。不同诱导时机时,各实验组幼虫的存活率在3~15 日龄时的差异均不显著(P>0.05);6 日龄时,只有出现第一个PBⅡ时的存活率与对照组差异显著(P<0.05),而9~15 日龄时各实验组的存活率均与对照组差异显著(P<0.05)(图2-b)。随着培养时间的延长,诱导时间越长,存活率下降速度越快;3~12 日龄时各实验组的存活率差异不显著(P>0.05),而15 日龄时,诱导20 min 组的存活率显著低于诱导10 min 组(P<0.05)(图2-c)。
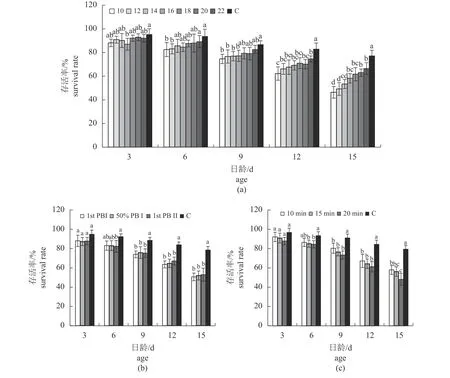
图2 不同诱导条件下合浦珠母贝在不同日龄的存活率Fig.2 Survival rate at different age in different induction conditions
2.3 不同条件下壳长生长比较
不同盐度处理后,各实验组幼虫的壳长差异不明显,并未表现出三倍体生长优势;15 日龄时,盐度10 中的幼虫壳长仅次于对照组,且与对照组没有显著差异(P>0.05,图3-a)。在不同诱导时机和不同诱导时长实验中,50% PB Ⅰ和诱导15 min 2 个实验组的壳长均大于其他实验组,甚至出现了高于对照组的情况(图3-a~b)。

图3 不同诱导条件下合浦珠母贝在不同日龄的壳长Fig.3 Shell length at different age in different induction conditions
2.4 不同条件下三倍体率变化比较
不同条件下,各实验组幼虫在3~15 日龄的三倍体率在培养期内均有所下降。在不同盐度诱导实验中,盐度16~22 实验组中的幼虫三倍体率降低幅度均超过了10%(图4-a);不同诱导时间实验中,诱导时间为10 min 时的幼虫三倍体率降低幅度超过了10%(图4-c);其他实验组均较为稳定;幼虫的三倍体率变化多集中在壳顶期。
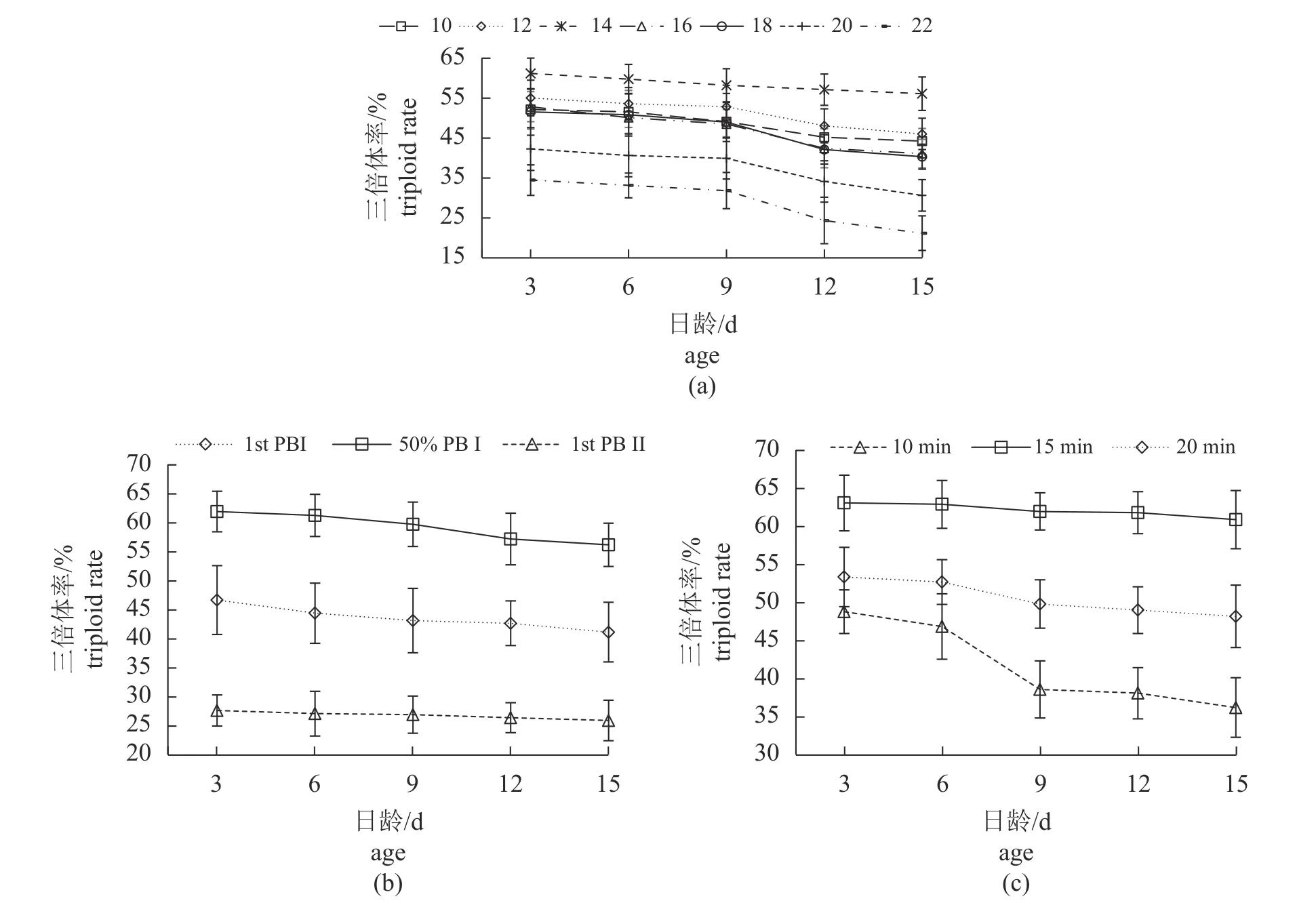
图4 不同诱导条件下合浦珠母贝在不同日龄的三倍体率Fig.4 Triploid rate at different age in different induction conditions
2.5 主成分分析
本研究以累计方差贡献率≥85%为标准,3种实验方法均选择了前两个主成分用于进行主成分分析综合评价得分计算。不同盐度实验中,前两个主成分的累积方差贡献率为94.78%;主成分1 主要反映了卵裂率、孵化率和存活率这三个原始变量;主成分2 则主要反映的原始变量为生长。在不同诱导时机实验中,前两个主成分的累积方差贡献率为100%;主成分1 在卵裂率、孵化率、存活率和生长的特征向量分别为99.75%、98.93%、99.45%和87.03%;主成分2 在三倍体率上的特征向量为96.45%。与不同诱导时机实验类似,在不同诱导时间实验中,前两个主成分同样很好的反映了所有原始变量;主成分1 主要反映了卵裂率、孵化率、存活率和生长这4 个原始变量,而主成分2 则主要反映原始变量为三倍体率(表1)。在不同盐度实验中,当诱导盐度为20 时,其综合评价得分最高(89.08);诱导三倍体率最高的盐度14 仅排名第6,其综合评价得分为-44.04。不同诱导时机和诱导时间实验中,三倍体率最高的两个条件(50% PB Ⅰ和15 min)的综合评价得分排名均为第1,二者的得分分别为75.75 和74.47(表2)。
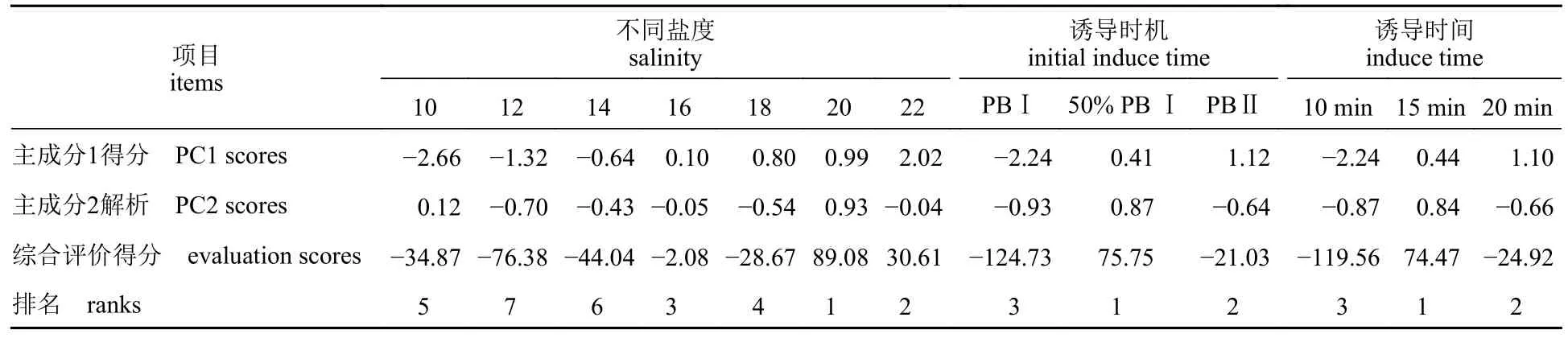
表2 不同诱导条件下的综合评价得分Tab.2 Comprehensive evaluation scores under different inducing conditions
3 讨论
通过低渗抑制第二极体被认为是诱导贝类三倍体的一种有效方式。此外,配子的成熟度也是提高诱导效率的关键因素之一,配子的成熟度决定了受精卵发育的同步性。获得高质量配子的方法主要包括种贝促熟、诱导产卵排精和解剖获得精卵等[23]。其中,解剖获得精卵的方式更容易控制,但对于合浦珠母贝来说,解剖获得的精卵往往不具有受精能力,需要进行激活。本实验所用的亲本性腺发育良好,因此,向卵液中滴入几滴氨水后浸泡约1 h 可有效提高合子发育的同步性。
本研究中,各实验组中的卵子经过促熟后,发育水平较为一致,因此,受精卵的发育同步性也较高。利用不同盐度在相同的诱导时机和诱导时间下诱导三倍体,各盐度中受精卵的卵裂率和孵化率均随着盐度的升高而升高,而D 形幼虫三倍体率则随着盐度的升高先上升后降低。盐度的改变会迫使受精卵渗透压发生改变,严重者可能会使胚胎受损,造成畸形或者使三倍体胚胎无法发育至D 形幼虫[24]。这可能是盐度10 和12 中的幼虫三倍体率低于盐度14 的原因。类似的结果在长牡蛎、近江牡蛎(C.ariakensis)及熊本牡蛎(C.sikamea)中均有报道[15,25-26]。在不同诱导时机实验中,当50%受精卵排出PB I 时开始诱导,D 形幼虫的三倍体率最高。本实验采用抑制PB Ⅱ的方式诱导三倍体,三倍体率的高低与受精卵发育的同步性有直接关系。当显微镜下观察到50%受精卵已经释放PB Ⅰ时,实际上绝大多数受精卵的PB Ⅰ已经释放完毕,准备释放PB Ⅱ。因此,在此时开始诱导可能具有较好的效果。目前已有的研究中,诱导时机的选择主要有两种方式,一种是如本研究中所采用的以某一发育阶段为起点开始诱导[16,27],此方法的其实标志清晰,容易观察,但有时需等待较长时间;另外一种以时间为标志[28-30],即受精后的一定时间点时开始诱导,此方法虽然等待时间较短,但可能出现在此期间未达到目标发育阶段的情况。在不同诱导时间实验中,三个诱导时间中D 形幼虫的三倍体率先上升后下降。在多次实践过程中我们发现,合浦珠母贝受精卵从PB I 释放完成到PB Ⅱ释放完成,一般在15min 内完成。这可能也是为什么在之前的报道中多选择15 min 或15 min 诱导效果最好的原因[18,31]。而诱导时间低于或高于15 min 时D 形幼虫三倍体率低的原因可能是未完全达到抑制PBⅡ释放的效果或对胚胎产生了不可逆的影响。
在本实验中,在盐度10 和诱导20 min 时的两组幼虫的存活率均最低,存活率持续而快速降低。诱导盐度的降低以及诱导时间的延长使胚胎处于不适环境中,使其受到潜在伤害,这种潜在伤害在D 形幼虫中的表现为高死亡率[32]。同时,由于发育同步性的原因,高强度的诱导可能使一部分受精卵的PB Ⅰ排放受到抑制,进而导致染色体多级分离产生非整倍体[33],非整倍体的低存活能力也是存活率下降的原因。相比于对照组,各实验组从受精卵发育至D 形幼虫的时间明显延长。且在整个实验期内,三倍体并未表现出明显的生长优势。盐度10 中诱导的幼虫在15 日龄时的壳长仅次于对照组,但这可能并非是三倍体体现出的生长优势。这可能是由于低渗对胚胎造成持续性的损伤及染色体多级分离,孵化后体型较小的个体和非整倍体不断死亡,仅留下体型较大的个体。这也是为什么在15 日龄时,盐度10 中幼虫壳长方差在所有实验组中最小的原因。同时,体型较小的个体和非整倍体不断死亡可能也是幼虫培养过程中三倍体率降低的原因。除此之外,三倍体率降低的另外一个原因可能是由于染色体丢失造成的[28]。
主成分分析是通过将多个变量进行降维,尽可能多地保留原始变量信息,利用少数几个主成分来解释原始变量的分析方法[21]。本研究中的三个实验均保留了前两个主成分,且保留的主成分累积方差贡献率均超过了85%。说明所保留的主成分能够很好的反应所有原始变量,达到了减少变量的目的。从综合评价得分的结果来看,我们选择的三个最佳三倍体诱导条件并非都得到了最高的综合评价得分。诱导时机和诱导时间中,50% PB Ⅰ和诱导15 min 时在各自所属的实验中均排名第1,而盐度14 在不同盐度实验组中仅排名第6。此结果与李阳春等[22]关于长牡蛎的研究结果不同,其原因可能与原始变量的数量有关。本研究中的原始变量不仅有卵裂率、孵化率和三倍体率,还增加了15 日龄时的存活率和壳长,低渗造成的生长减慢和存活率下降可能导致了此结果的产生。由此可见,利用低渗诱导合浦珠母贝三倍体虽然可诱导出一定比例的三倍体且成本较药物诱导更低,但如何提高胚胎卵裂率、孵化率以及幼虫存活率是日后需要解决的问题。
(作者声明本文无实际或潜在的利益冲突)

