氮素添加对羊草非结构性碳水化合物和脯氨酸的影响
倩 娜,樊 荣,时一平,那木汗,3,乌云娜
(1.内蒙古自治区国土空间规划院,内蒙古 呼和浩特 010010;2.大连民族大学 环境与资源学院,辽宁 大连 116605 3.沈阳农业大学 生物科学技术学院,辽宁 沈阳110866)
近年来,由于人类活动以及气候变化的影响,大气氮沉降不断加剧并迅猛增长,预计2050年大气氮沉降总量将达到195 T g N·a-1[1],这已经远远超出全球氮素的临界负荷(100 T g N·a-1)[2-4]。氮素增加会引起土壤理化性质的改变,促进一些机会主义物种快速占据生态位[5-6],从而会降低植物物种丰富度,而物种丰富度的降低也会使群落生产力和稳定性随之变化[7-10]。如,何玉惠等在黄土高原荒漠草地中进行的氮添加实验研究表明,施氮显著提高了植物群落生产力,并促进优势种的生长[11]。
氮素(N)作为组成氨基酸的基本元素之一,是生物不可或缺的重要元素。大气中以氮气(N2)形态存在的氮素高达70%以上,适量施氮有利于叶片延缓衰老,有助于光合物质的生产[12]。其中植物光合作用产生的重要能源物质NSCs的代谢可以反映植物对环境因子的响应,主要包括可溶性糖(SS)和淀粉(ST),其含量反映了植物的碳代谢状况及抗逆性质[13]。SS是植物主要的光合产物,糖的代谢与运转形式,在渗透调节中起关键作用;ST作为存贮物质,主要供应将来的生长发育需求,维持其稳定对植物缓冲干旱威胁以及干旱后的组织修复至关重要。近年来对草地植物NSCs的研究报道显著增加,如,苏原等[14]研究结果表明,氮素添加会降低盐渍化草地赖草 (Leymussecalinus)NSCs含量;施加高浓度的氮素化合物会使大针茅(Stipagrandis)和羊草(Leymuschinensis)叶片中的SS含量显著降低,施加低浓度的氮素则会使叶片内的ST含量显著降低[15]。PC作为植物蛋白质的组成之一,当植物处于干旱或者水分胁迫下,蛋白质的合成受到阻碍,其体内游离的PC会大量积累,降低细胞的渗透势,维持和提高植物组织的持水能力[16],因此其被视为植物抗逆性的重要生理指标之一[17]。朱爱民等[18]研究表明PC的增高有利于提高紫花苜蓿(Medicagosativa)适应低温环境的能力。
探讨草地生态系统对氮沉降的响应成为近年来国内外生态学家关注的热点和焦点之一。尽管不同胁迫下植物生理生化和代谢能力变化的研究获得了许多成果,但关于草甸草原优势种在氮沉降环境下生理生化响应特征的差异性表现,目前研究还十分有限。羊草通过长期的环境选择,拥有抵抗干旱、寒冷、土地盐碱化的环境压力能力[19],在草甸草原的持续利用、退化修复、草原畜牧业发展等方面占据十分重要的地位[20-23]。本研究以草甸草原优势种羊草为研究对象,进行模拟氮沉降的实验,探究不同剂量的尿素和硝酸铵添加对羊草生理生化特征的影响,以期为草原生态系统的适应性管理提供依据。
1 材料与方法
1.1 研究区域概况
研究地点位于内蒙古呼伦贝尔市额尔古纳市中国科学院沈阳应用生态研究所额尔古纳森林草原过渡带生态系统研究站(50°10′28′′ N,119°23′34′′E),该地区海拔550~600 m,地势平坦,气候属于寒温带大陆性季风气候,四季鲜明。研究区域的草原类型为草甸草原,优势物种为羊草、贝加尔针茅(Stipabaicalensis)等,主要土壤类型为黑钙土。2018年生长季(6~9月)平均月降水量为73.05 mm,生长季总降水量为292.2 mm;2019年生长季(6~9月)平均月降水量为66.475 mm,生长季总降水量为265.9 mm。降水量变化如图1。
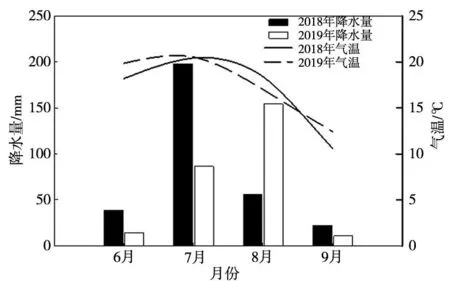
图1 2018、2019年6~9月实验样地降水、气温的变化
1.2 试验设计
本实验依托氮素添加实验平台开展。平台采用随机区组设计,5个区组为5个重复,每个区组内均包含对照,添加硝酸铵(NH4NO3)添加量为2、10、20、50 g N·m-2·yr-1,尿素(CO(NH2)2)浓度为2、10、20、50 g N·m-2·yr-1共9个处理。共计45个小区,每个小区大小为6 m×6 m,相邻小区间隔1 m。在每个小区随机设置1 m×1 m固定样方用于取样调查。
1.3 测定指标与方法
1.3.1 植物地上生物量测定方法
植物地上生物量:野外采样时间为2018年和2019年的8月15~8月19日。在每个小区的固定样方中,采用刈割法收获植物地上部分,完全随机区组设计,每个样方共设5个重复,共45个样方。将采集的样品带回实验室烘干称重进行下一步处理。
植物叶片相对生物量:样方内植物叶片地上生物量与样方总植物生物量之比。
1.3.2 植物SS、ST和PC含量的测定
叶片预处理:在每个实验小区随机选取10~15株植物,共30~50片叶片,放入牛皮纸袋中并标记相应样地编号;将所取样品带回野外站实验室,将其放入烘箱在105 ℃下进行3 h杀青,之后放入65 ℃烘干24 h;烘干后将植物叶片样品用球磨仪(MM400)进行粉碎,之后放入自封袋标记好样地号备用。
测定方法:SS、ST采用蒽酮比色法[24],植物PC含量采用茚三酮染色法[25]。
1.3.3 植物NSCs含量的计算
为SS含量与ST含量的总和。
1.4 数据处理与分析方法
采用Excel 2016和SPSS 20.0软件对数据进行统计分析。将施氮种类、施氮浓度、采样时间及其交互作用对羊草叶片NSCs及其组分的方差分析结果进行了Pearson 线性相关分析,并采用Tukey·s Honestly Significant Difference (HSD)检验法和 Student-t检验法分析不同处理之间的差异;一般线性模型将施氮浓度、施氮种类、采样时间进行多因素方差分析,检验主效应及交互效应的显著性(P<0.05),数据结果均以平均数±标准误的结果进行表示,运用Excel 2016进行绘图。
2 结果与分析
2.1 尿素和硝酸铵添加下羊草叶片NSCs及其组分的变化
2.1.1 SS含量的变化
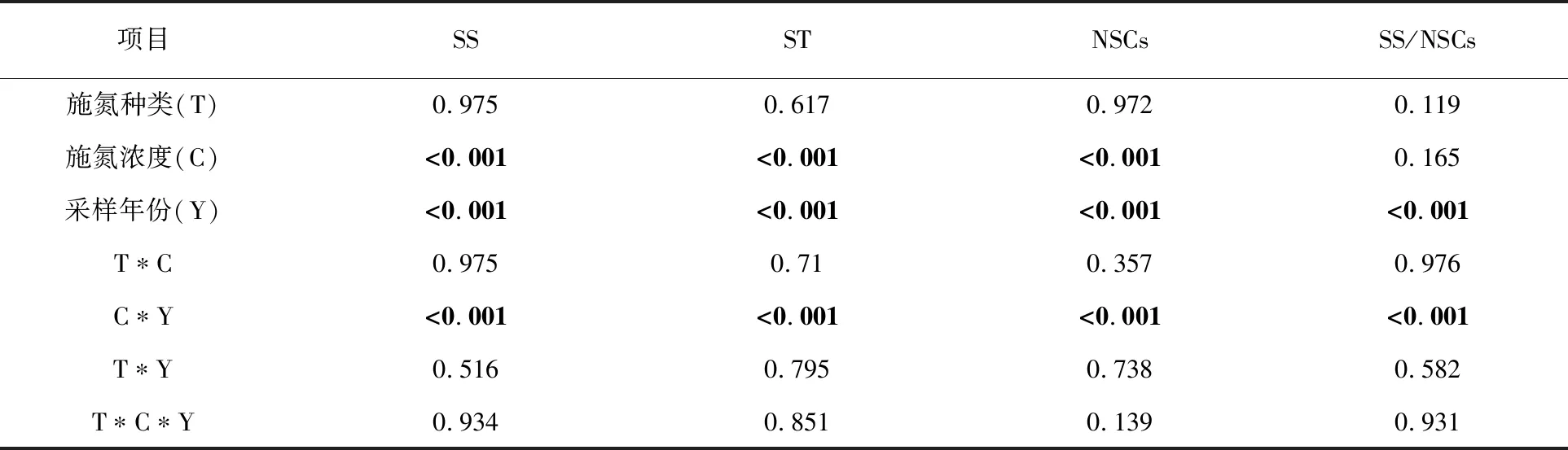
表1 施氮种类、施氮浓度、采样时间及其交互作用对羊草叶片NSCs及其组分,SS/ST的方差分析结果(P值)
尿素和硝酸铵添加下,羊草叶片SS含量变化见图2。在2018年,随着施氮量的提高,尿素和硝酸铵添加下的羊草叶片SS含量均呈升高趋势,均在浓度为50 g N·m-2·yr-1时达到最高,尿素处理下浓度为50 g N·m-2·yr-1显著高于0、2 g N·m-2·yr-1(P<0.05),且硝酸铵处理下浓度为50 g N·m-2·yr-1显著高于0、2、10 g N·m-2·yr-1(P<0.05);在2019年,两种氮肥处理下羊草叶片SS含量变化趋势并不一致,随着施氮量的提高,尿素添加下的羊草叶片SS含量呈升高趋势,在浓度为50 g N·m-2·yr-1时达到最高并显著高于0 g N·m-2·yr-1(P<0.05),但硝酸铵添加下的羊草叶片SS含量呈先升高后降低的趋势,在浓度为20g N·m-2·yr-1时达到最高并显著高于0 g N·m-2·yr-1(P<0.05)。由于2019年生长季总降水量显著低于2018年,因此2019年的SS含量显著低于2018年。
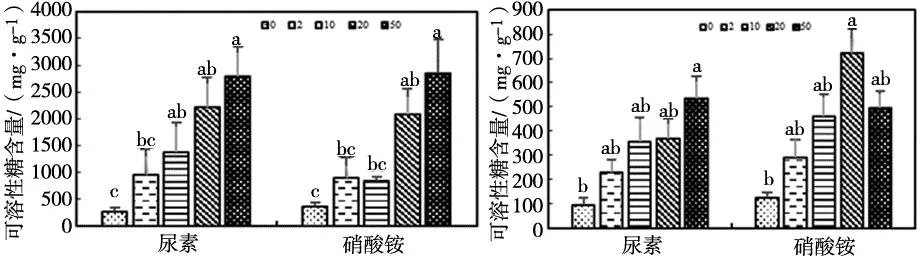
(a)2018年 (b)2019年
2.1.2 ST含量的变化
尿素和硝酸铵添加下,羊草叶片ST含量变化如图3。随着施氮量的提高,尿素和硝酸铵添加下的羊草叶片ST含量均呈升高趋势,均在浓度为50 g N·m-2·yr-1时达到最高,尿素处理下浓度为20、50 g N·m-2·yr-1显著高于0、2 g N·m-2·yr-1(P<0.05),且硝酸铵处理下浓度为50g N·m-2·yr-1显著高于0、2、10、20 g N·m-2·yr-1(P<0.05);在2019年,两种氮肥处理下羊草叶片ST含量变化趋势并不一致,随着施氮量的提高,尿素添加下的羊草叶片ST含量呈先升高后降低的趋势,在浓度为10 g N·m-2·yr-1时达到最高且显著高于0 g N·m-2·yr-1(P<0.05),硝酸铵添加下的羊草叶片ST含量呈升高趋势,在浓度为50 g N·m-2·yr-1时达到最高并显著高于0 g N·m-2·yr-1(P<0.05)。
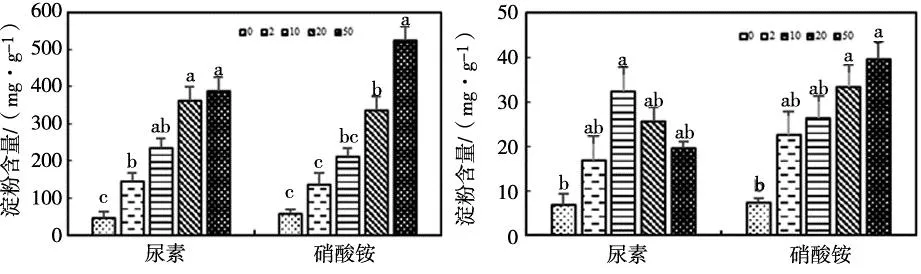
(a)2018年 (b)2019年
2.1.3 NSCs含量的变化
尿素和硝酸铵添加下,羊草叶片NSCs含量变化如图4。在2018年,随着施氮量的提高,尿素和硝酸铵添加下的羊草叶片NSCs含量均呈升高趋势,均在浓度为50 g N·m-2·yr-1时达到最高,且尿素与硝酸铵处理下浓度为50 g N·m-2·yr-1显著高于0、2、10 g N·m-2·yr-1(P<0.05);在2019年,随着施氮量的提高,尿素添加下的羊草叶片NSCs呈升高趋势,在浓度为50 g N·m-2·yr-1时达到最高且显著高于0 g N·m-2·yr-1(P<0.05),但硝酸铵添加下的羊草叶片NSCs含量呈先升高后降低的趋势,在浓度为20 g N·m-2·yr-1时达到最高且显著时高于0 g N·m-2·yr-1(P<0.05)。

(a)2018年 (b)2019年
2.1.4 SS/ST的变化
尿素和硝酸铵添加下,羊草叶片SS/ST变化如图5。在尿素和硝酸铵添加下,2018和2019年羊草叶片SS/ST均无明显变化趋势,且无显著差异(P>0.05)。

(a)2018年 (b)2019年
2.2 尿素和硝酸铵添加下羊草叶片PC含量的变化
尿素和硝酸铵添加下,羊草叶片PC含量变化如图6。在2018年,随着施氮量的提高,尿素和硝酸铵添加下的羊草叶片PC含量均呈升高趋势,均在浓度为50 g N·m-2·yr-1时达到最高,尿素处理下浓度为50 g N·m-2·yr-1显著高于0 g N·m-2·yr-1(P<0.05),硝酸铵处理下浓度为50 g N·m-2·yr-1显著高于0、2 g N·m-2·yr-1(P<0.05);在2019年,随着施氮量的提高,尿素和硝酸铵添加下的羊草叶片PC含量均呈先升高后降低的趋势,均在20 g N·m-2·yr-1时达到最高,均显著高于0 g N·m-2·yr-1(P<0.05)。

(a)2018年 (b)2019年
2.3 尿素和硝酸铵添加下羊草叶片相对生物量与各项生理生态特征之间的相关性
羊草叶片相对生物量与各项生理指标相关性变化见表2。羊草叶片的相对生物量与叶片ST含量极显著正相关关系(P<0.01)、与PC含量呈正相关关系(P<0.05)。叶片SS含量与叶片ST含量、NSCs含量呈极显著正相关关系(P<0.01),与叶片PC含量呈极显著负相关关系(P<0.01)。叶片ST含量与叶片NSCs含量呈极显著正相关关系(P<0.01),与叶片PC含量无相关性(P>0.05)。叶片NSCs与叶片PC含量呈极显著负相关关系(P<0.01)。
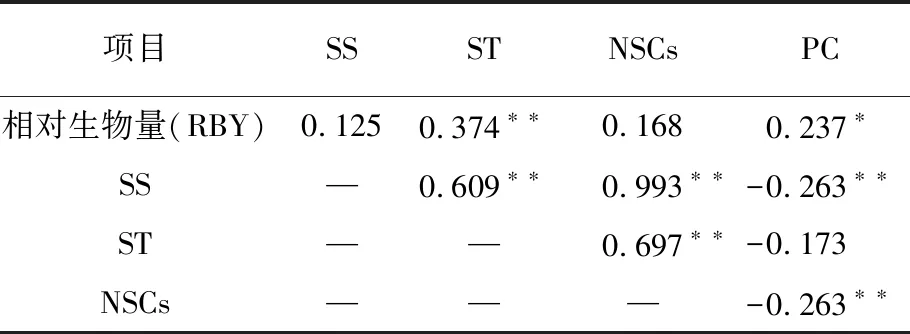
表2 羊草叶片植物生理性状与相对生物量相关性分析
羊草叶片的相对生物量与ST含量呈极显著正相关关系(P<0.01),与叶片PC含量呈正相关关系(P<0.05),随着相对生物量的增加,叶片ST和PC含量均升高,但无显著相关性。相关性变化如图7。
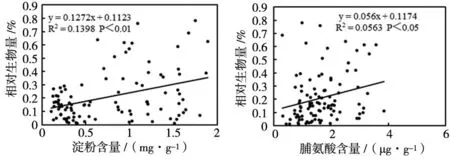
(a)ST含量 (b)PC含量
3 讨论
NSCs是储存于植物体内用于光合产物供应不足时的碳源和能量补充,NSCs及其组分含量体现了植物在环境胁迫下的生态策略[26]。本实验结果表明,羊草叶片NSCs含量在两种氮素添加下随着浓度的提高均呈现上升趋势,SS含量显著增加,ST显著增加。这表明外源性N添加改善了羊草N素缺乏,增强了植物光合固碳作用,而且施N量增加,有利于ST水解转化为SS[27-28],供植物构建碳骨架,促进植物生长。2018和2019两年间羊草的NSCs数值相差较大,这可能由于两年生长季降水量分别为314.4 mm和265.9 mm,相对于上年降低了15.43%,水分的限制导致氮的利用率明显降低[29-30],减弱了植物光合固碳作用,从而使2019年的SS含量显著低于2018年。
随着氮添加量的提高,羊草植物叶片PC含量均呈上升的趋势,这是由于植株体内的PC含量对环境的变化敏感[31-32]。在2018年,羊草叶片PC含量在施氮浓度为50 g N·m-2·yr-1时达到最高;在2019年,羊草叶片PC含量在20 g N·m-2·yr-1浓度时达到最高,相比2018年提前达到顶点,这说明水分胁迫对羊草PC积累较明显,这与李颖等[33]人结论相一致。
其中羊草的相对生物量与叶片ST含量、PC含量呈极显著正相关关系,ST是植物重要的储能物质,当保证植被不受能量胁迫时,才能达到更好地生长状态,而PC作为植物体内的渗透调节物质,随着浓度的升高,叶片渗透调节能力增强,植被可以更好地适应环境以促进其生长,因此施加氮肥的条件下相对于N素缺失情况下的生物量提高了。羊草因为具有较高的氮利用效率, 可以通过碳氮两种代谢途径进行防御的结果相一致[34-35]。
4 结 语
两种氮素化合物处理下,随着氮素化合物的添加其PC含量增加,在低浓度(≤10 g N·m-2·yr-1)氮素添加水平下,其含量的增幅更大;两年期间, NSCs及其组分的含量在降水较多的2018年高于2019年;降水较少的年份,PC对氮添加梯度增加的响应更为敏感,羊草的相对生物量与其ST含量、PC含量呈显著正相关关系。本研究发现了在降水较少的胁迫条件下20 g N·m-2·yr-1的硝酸铵更适用于羊草。

