酸和碱的化学性质突破
耿昌福
酸和碱是初中化学的重点,也是中考命题的热点,涉及的物质多,概念多,化学反应也多,知识具有较强的综合性。现将这部分内容的考点整理如下,供同学们参考。
考点速览
考点1:酸的化学性质
(1)酸与酸碱指示剂反应:紫色石蕊试液遇到酸变红色。
(2)酸与活泼金属单质反应:在金属活动性顺序中,排在氢前面的金属单质会与酸反应生成盐和氢气。其中,单质铁与酸发生置换反应时生成亚铁盐(+2价)。
(3)酸与金属氧化物反应:酸与金属氧化物反应生成盐和水。例如:稀盐酸与铁锈(主要成分是Fe2O3)反应,生成可溶性的氯化铁和水。
(4)酸与碱反应:酸与碱反应生成盐和水。例如:稀硫酸与氢氧化钡溶液反应,化学方程式为H2SO4 + Ba(OH)2 =====BaSO4 ↓+ 2H2O。
(5)酸与某些盐反应:酸与某些盐反应生成新盐和新酸。例如:碳酸钠与稀盐酸反应,化学方程式为Na2CO3 + 2HCl =====2NaCl + CO2↑+ H2O(碳酸不稳定,分解成CO2和H2O)。
考点2:酸的化学性质异同
(1)酸的化学性质相似,原因是它们在水溶液中都能电离出H + 。
(2)不同的酸的化学性质会有差异,原因是阴离子不同(酸根离子不同)。
例如:稀盐酸跟硝酸银溶液反应,化学方程式为HCl + AgNO3 =====AgCl↓+ HNO3;稀硫酸与可溶性钡盐溶液(如氯化钡溶液)反应,化学方程式为H2SO4 + BaCl2 =====BaSO4↓+ 2HCl。
鉴别稀盐酸和稀硫酸应选用氯化钡溶液和稀硝酸,而不能用硝酸银溶液。原因是硝酸银溶液与盐酸反应生成氯化银沉淀,与硫酸反应生成微溶的硫酸银,无法区分。
考点3:碱的化学性质
(1)碱与酸碱指示剂反应:紫色石蕊试液遇到碱变蓝色,无色酚酞试液遇到碱变红色。
(2)碱与某些非金属氧化物反应:碱与某些非金属氧化物反应生成盐和水。例如:氢氧化钠与二氧化碳反应,化学方程式为2NaOH + CO2 =====Na2CO3 + H2O。
注意:不是所有的非金属氧化物都能和碱反应,如一氧化碳、水等。
(3)碱与酸反应:碱与酸反应生成盐和水。例如:稀盐酸与氢氧化钠溶液反应,化学方程式为NaOH + HCl =====NaCl + H2O。
(4)碱与某些盐溶液反应:碱与某些盐溶液反应生成新盐和新碱。例如:2NaOH + CuSO4 =====Na2SO4 + Cu(OH)2↓,现象是有蓝色沉淀生成;3NaOH + FeCl3 =====3NaCl +Fe(OH)3↓,现象是有红褐色沉淀生成。
考点4:碱的化学性质异同
(1)碱有相似的化学性质,原因是它们在水溶液中都能电离出OH-。
(2)不同的碱的化学性质会有差异,原因是阳离子不同。
例如:氢氧化钙溶液能與碳酸钠溶液反应,化学方程式为Ca(OH)2 + Na2CO3 =====CaCO3↓+ 2NaOH,而氢氧化钠溶液不能与碳酸钠溶液反应。
鉴别氢氧化钠溶液与澄清石灰水的方法:取样,分别滴加碳酸钠溶液(或取样,分别通入二氧化碳气体),出现白色浑浊现象的是澄清石灰水。
应用提升
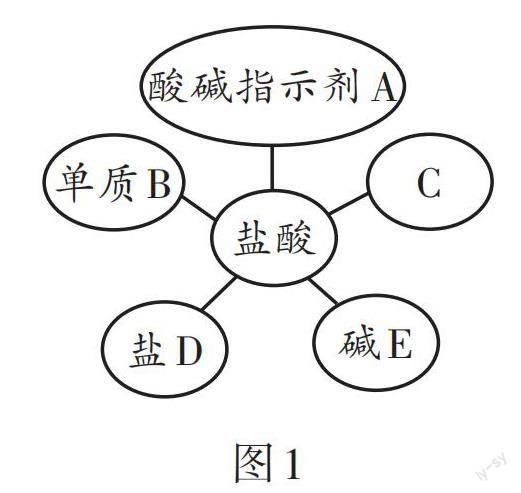
例1 复习酸的化学性质时,某同学总结了盐酸化学性质的思维导图如图1所示(A、B、C、D、E均能与盐酸发生反应)。请根据图示回答下列问题。
(1)若C是红棕色固体,则其化学式为。
(2)若单质B是铁,取一根打磨光亮的铁钉置于试管中,向其中加入足量的稀盐酸,可观察到的现象是______。单质B这类物质与稀盐酸发生反应,需满足的条件是____________。
(3)若E为氢氧化钾溶液,向该溶液中滴加几滴无色酚酞溶液后,再向其中滴加一定量的稀盐酸,当观察到溶液呈无色时,则所得溶液的溶质是______。该实验发生的化学反应基本反应类型为____________。
解析:(1)根据酸的通性,可知C表示金属氧化物,且是红棕色固体,故C是氧化铁,化学式为Fe2O3。(2)铁和盐酸反应生成氢气和氯化亚铁,可观察到的现象是铁钉表面有气泡产生,溶液由无色变成浅绿色;金属与盐酸反应,金属要满足的条件是在金属活动性顺序里,位于氢前面。(3)反应的化学方程式为KOH + HCl =====KCl + H2O,酚酞溶液变成无色,溶液可能呈中性或酸性,故此时溶液的溶质是KCl或KCl、HCl;该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。
答案:(1)Fe2O3 (2)铁钉表面有气泡产生,溶液由无色变成浅绿色 在金属活动性顺序里,位于氢前面 (3)KCl或KCl、HCl 复分解反应
例2 通过观察和实验等方法获取证据是科学探究的重要环节。
(1)向少量Fe(OH)3沉淀中加入稀盐酸,观察到______,可判断发生了反应。
(2)向Ca(OH)2溶液中通入CO2,观察到______,可判断发生了反应。
(3)向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。
①甲同学向滴有酚酞试液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,溶液由红色变成无色,证明溶液中______,可判断Ca(OH)2与HCl发生了反应。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有Ca2+ 和Cl-,他据此认为Ca(OH)2与HCl发生了反应,且生成了CaCl2。你认为乙同学是否找到了反应发生的证据?请说出你的观点并阐述理由:______ 。
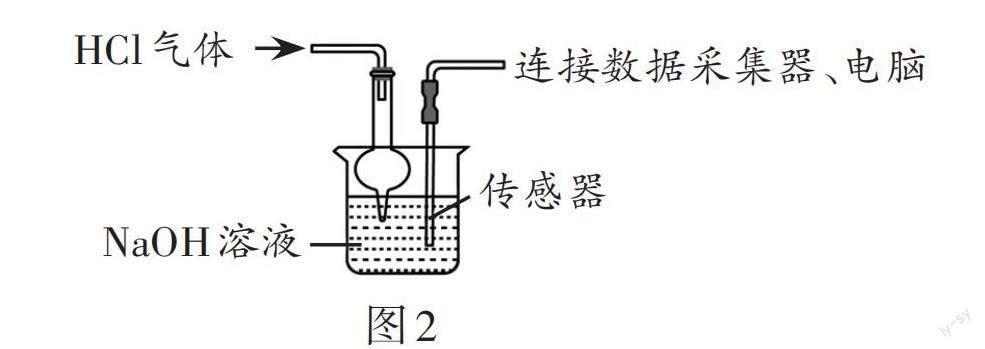
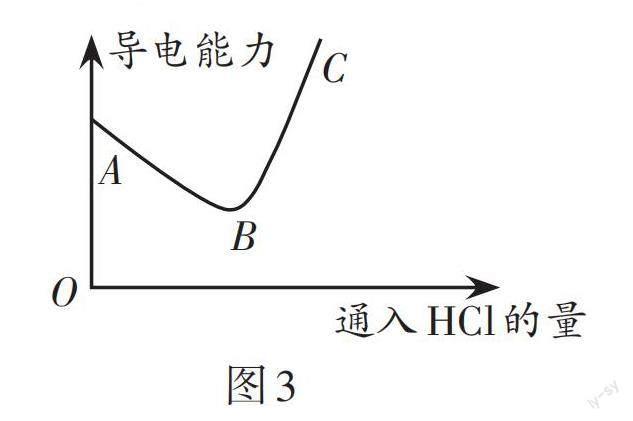
(4)如图2所示,向NaOH稀溶液中缓缓通入HCl气体,测定该过程中溶液导电能力的变化,实验结果如图2。(溶液体积、温度的变化可忽略)
①分析A→B段变化,其他条件相同,导电能力:OH-______(选填“>”“<”或“=”)Cl-。
②分析B→C段变化,溶液的导电能力除了与离子种类有关,还与______有关。
解析:(1)Fe(OH)3和HCl反应生成氯化铁和水,固体溶解说明反应物氢氧化铁减少,溶液由无色变为黄色说明有新物质生成。(2)Ca(OH)2和CO2反应生成碳酸钙沉淀和水,溶液变浑浊,说明有新物质生成。(3)①Ca(OH)2溶液呈碱性能使酚酞试液变红,溶液由红色变成无色,证明溶液中的氢氧化钙消失了,则说明氢氧化钙和盐酸发生了反应。②Ca(OH)2在水中解离出钙离子和氢氧根离子,氯化氢在水中解离出氢离子和氯离子,即使氢氧化钙和盐酸不反应,二者混合后溶液中也会有钙离子和氯离子,所以乙同学没有找到反应发生的证据。(4)①氯化氢溶于水形成盐酸,NaOH + HCl =====NaCl + H2O,反应中,相同数目的氢氧根离子替换为氯离子,A→B段导电能力下降,则导电能力:OH- > Cl-。②B→C段盐酸和氢氧化钠反应完后,继续通入氯化氢气体,氯化氢溶于水解离出氢离子和氯离子且不再发生反应,溶液中离子的数目增加了,但溶液体积不变,B→C段导电能力增强,说明溶液的导电能力还与离子的浓度有关。
答案:(1)固体溶解(或溶液由无色变为黄色) (2)溶液变浑浊 (3)①氢氧化钙消失了 ②没有找到反应发生的证据,因为氢氧化钙溶液中有钙离子,盐酸中有氯离子,混合后即使二者不反应也会存在钙离子和氯离子 (4)①> ②离子的浓度
(作者单位:江苏省镇江市丹徒区世业实验学校)

