纳米酶在疾病治疗中的研究与应用*
刘 行 李奕璇 秦梓通 赵佳雯 周悦捷 刘晓菲
(1)西安交通大学第一附属医院MED-X研究院再生与重建医学研究所,西安 710061;2)西安交通大学医学部,西安 710061)
天然酶是一种高效的生物催化剂,可以特异性地降低反应活化能、增加生化反应速率以调节催化反应,能够控制新陈代谢、能量转化和疾病发生等生理病理过程[1]。然而,它们的催化过程在只能在相对温和的条件下进行,当外界环境发生波动时容易失活,因此不适用于大规模的生产使用[2]。作为高度稳定和低成本的酶的替代品,人工酶具有成本低、制备简单、性能稳定的特点,在生物医学应用中展现出了巨大的潜力[3]。最近,纳米技术和生物技术的最新进展为开发具有高催化活性的纳米颗粒人工酶提供了新思路。纳米酶是一类既有纳米材料的独特性能,又有类似天然酶的催化效率和酶促反应动力学的人工模拟酶。同时,纳米酶具有稳定性好、制备成本低、储存时间长等优点,能有效避免天然酶制备和纯化过程中的复杂性,可应用于生物检测、肿瘤治疗以及其他类酶催化反应,在各种生物应用领域中展现出了良好的应用前景[4-5]。本文综述了具有不同类酶活性的纳米酶在疾病诊治中的应用,并对影响纳米酶活性的主要影响因素进行了阐述,讨论了纳米酶技术目前所面临的挑战和未来发展方向。
1 影响纳米酶活性的因素
影响纳米酶活性的主要因素如图1所示,详细介绍如下。
1.1 理化性质
1.1.1尺寸
纳米材料的尺寸能够影响纳米酶的催化效率。比表面积随着粒径的减小而增大,即纳米酶的尺寸越小,其比表面积越高,而较高的比表面积可以暴露更多的活性位点,促进与底物的相互作用从而使纳米酶具有更高的催化活性[6-7]。Kalantari等[8]依次研究了尺寸为1.2、1.4、1.9、2.1、2.9 nm 的高硫含量金纳米酶,结果发现,金纳米颗粒的尺寸影响了其类过氧化物酶的活性,1.9 nm的尺寸具有最大的催化活性。Valden 等[9]在二氧化钛的单晶表面制备了直径为1~6 nm 的金团簇,以研究低温催化氧化一氧化碳的异常尺寸依赖性。研究发现,金团簇在3.5 nm 范围内表现出最大的反应活性。上述研究证实,通过控制纳米酶的颗粒直径可以调节纳米酶的催化活性。
1.1.2形貌
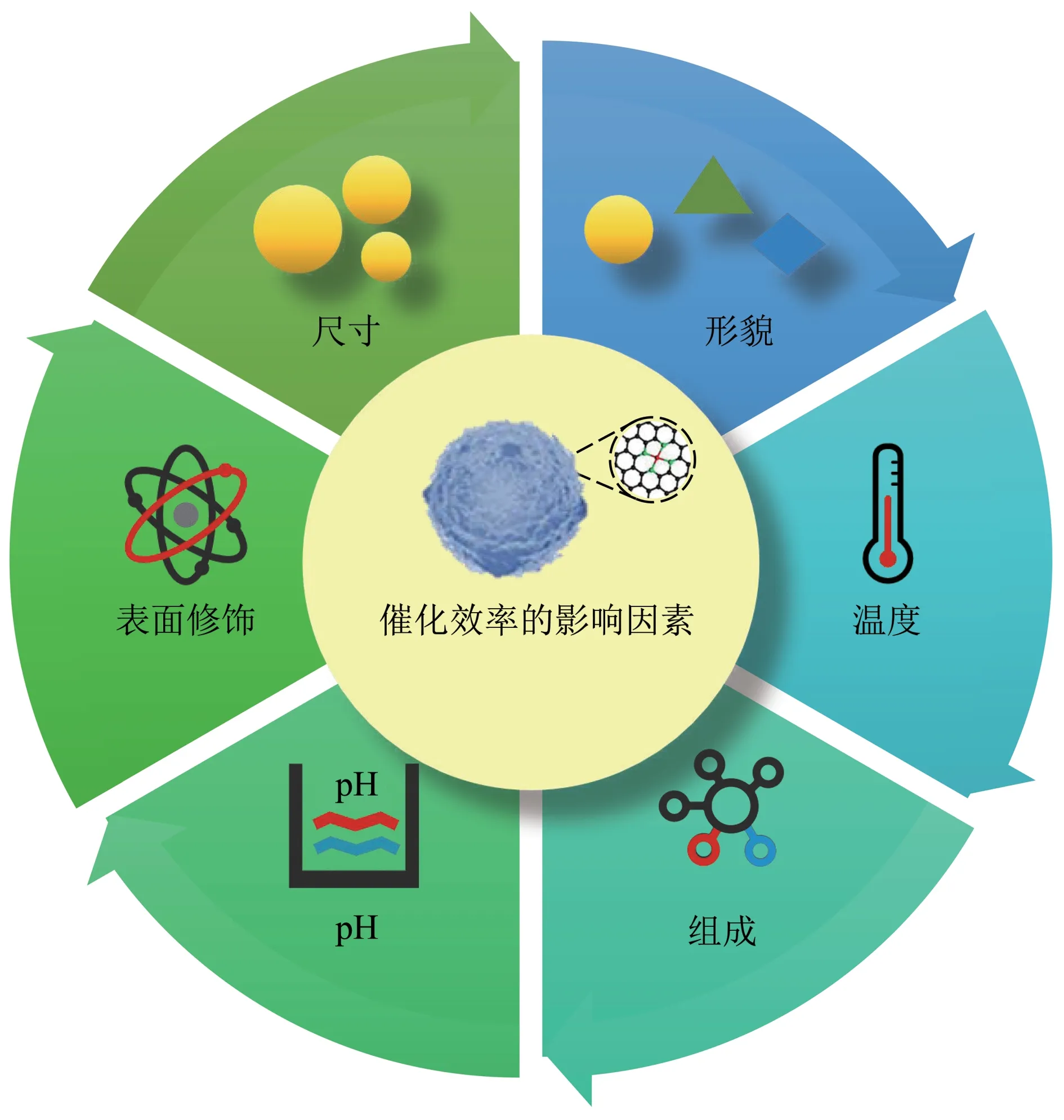
Fig. 1 Major influencing factors of nanozyme activity,including size, morphology, surface modification, element doping, pH, and temperature图1 纳米酶活性的主要影响因素包括尺寸、形貌、表面修饰、组成、pH和温度
纳米酶的催化性能也由其形貌决定,纳米晶体的形貌与纳米晶体表面原子配位环境有关,不同形貌纳米酶表面配位的原子不同,导致其最终的催化活性不同。这可能是因为具有不同晶面显示出不同数量的悬键和各种原子排列,这也决定了纳米酶的选择性和反应性[10]。Singh 等[11]通过测定超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT) 和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)的含量,来比较不同形貌的Mn3O4的纳米酶的活性,发现菜花状的Mn3O4在3 种酶模拟实验中均表现出最高的活性,而其他形貌的纳米酶只表现出SOD 样活性,且其SOD活性均低于菜花状Mn3O4纳米酶活性,得出菜花样Mn3O4纳米酶具有治疗活性氧(reactive oxygen species,ROS)介导的神经疾病的潜力的结论。
Gao等[12]研究了高指数{hk0}面铂凹纳米立方体(HⅠF-Pt-CNCs),研究发现,HⅠF-Pt-CNCs 表现出优越的过氧化物酶样催化活性,其催化活性比天然的辣椒根过氧化物酶和铂纳米球高约1 500 倍和约4 倍,因此HⅠF-Pt-CNCs 可以在过氧化氢存在的情况下通过催化过氧化物酶底物的氧化来提供强大的信号放大。而这一较高的类酶催化速度常数可能是由于HⅠF-Pt-CNCs具有高晶面指数暴露出更多的催化活性位点所致。并且不同晶面对HⅠF-Pt-CNCs催化活性大小也各不相同。
1.1.3表面修饰
大多数化学反应发生在纳米酶的表界面。纳米酶表面经过修饰后通过改变纳米酶表面电荷和微环境,进而影响其活性位点的暴露情况,改变其对底物的亲和力。修饰类型包括物理吸附、共价修饰等。纳米材料的表面改性不仅在纳米材料的合成中起到稳定剂的作用,而且为官能团的进一步耦连提供了反应场所。从而影响其催化效率[13]。Li等[14]制备了具有光热活性的半导体聚合物纳米酶,在近红外光(near infrared,NⅠR)照射下,改变了纳米酶表面修饰的活性位点,使得其活性提高了3.5倍,能够有效地消化肿瘤细胞外基质中的胶原蛋白,增强纳米颗粒在肿瘤中的积累,改善光热治疗效果。Fan 等[15]将组氨酸引入到Fe3O4表面,以期提高Fe3O4对H2O2的亲和力。他们分别制备了裸露的Fe3O4(Naked-Fe3O4)、组氨酸修饰的Fe3O4(His-Fe3O4)和丙氨酸修饰的Fe3O4(Ala-Fe3O4),研究发现,Ala-FesO4催化活性略微提升,而实验组His修饰后的Fe3O4活性得到显著提升。进一步地,通过酶动力学参数比较可知,His修饰可提升Fe3O4活性特异性,显著提高Fe3O4纳米酶对H2O2亲和力。这些通过简单合成和表面修饰的研究,能够促进更优纳米酶的探索。
1.1.4组成
掺杂其他元素或将多种纳米材料复合也是一种提高纳米酶催化活性的有效途径,经掺杂后的复合纳米酶较未复合的纳米颗粒活性位点更多,表面电子转移能力更强,具有更好的催化活性[16]。Liu等[17]合成了掺铁CuSn(OH)6(Fe/CuSn(OH)6)纳米酶,研究发现,CuSn(OH)6则不具有多巴胺氧化的催化作用酶活性,而掺杂在Fe/CuSn(OH)6中的铁元素具有多巴胺氧化的催化作用。Chen等[18]制备出了肝素偶联的Fe@Fe3O4核壳纳米颗粒(metal nanoparticles,MNPs),通过分析比较MNPs 和Fe3O4@肝素NPs的催化活性,发现MNPs的催化活性明显高于Fe3O4@肝素NPs,这是由于铁核释放铁离子,加速了转化。因此,铁核对提高纳米酶的性能具有重要意义。Liu 等[19]以合金纳米颗粒PtRu 为研究模型,通过改变金属盐比例,制备出金属盐组成成分不同比例的PtRu 合金纳米酶。类酶催化活性研究表明,PtRu 合金纳米酶类OXD(oxidase)、POD(peroxidase)、SOD、CAT等活性与Pt/Ru比有关,其中Pt90Ru10其活性最高。通过XPS 实验发现合金化后Pt 的电子结构发生改变,可能有利于类酶催化,改善催化活性。金属组元的数量对类酶催化活性也存在影响。
1.2 环境因素
1.2.1pH和温度
天然酶的催化活性受限于pH 值和温度。相较于天然酶,纳米酶能够在更大的pH 值和温度范围内保持催化活性。张欣等[20]通过水热法制备了得二硫化钼纳米片(molybdenum dioxide nanosheets,MoS2 NSs),研究发现,当温度在15~50℃之间变化时,随着温度升高,酶相对活性呈下降趋势,说明低温有利于催化反应发生,在15~30℃时酶均可表现出较高的活性。同时研究了pH 对酶活性的影响,发现随着pH 值的升高,相对活性表现出先增大后减小的趋势,当pH=4.0 时酶的活性最高。王波等[21]制备了一种具有过氧化物酶活性的锰单原子纳米酶(f-MnNC), 可用于碱性磷酸酶(alkaline phosphatase,ALP)活性,研究表明,在pH=3.0~6.0的范围内,f-MnNC的催化活性随pH值增加而先增强后减弱,在pH=4.0~5.0 时均可以表现出较高的酶活性,当pH=4.4时f-MnNC酶活性最高。在20~60℃的温度范围内,f-MnNC 的催化活性随温度升高而先增强后减弱,当温度在40~60℃时可以保持较高活性,最佳温度为50℃。
1.2.2环境介质
金属基纳米材料具有独特的物理性能,可以受到光、声、电和磁等环境介质的影响,进而影响这类酶的催化活性,目前主要研究声、光、磁等外界环境对酶的催化活性,外部光照可通过材料光热效应将反应温度调整至纳米酶的最佳反应温度附近,或者光生热电子,从而提升催化反应速率,Zhang等[22]制备出表面粗糙的Au 纳米颗粒,发现可基于其等离基元特性在光照下产生热电子从而加速H2O2均裂,且可在Au表面形成OH—,促进3,3',5,5'-四甲基联苯胺(tetramethylbenzidine,TMB) 氧化,提升了Au纳米颗粒类POD的催化活性。Yang等[23]利用化学沉淀法制备出氧化石墨烯-四氧化三铁(GO-Fe3O4)纳米酶,随后将药物盐酸阿霉素(doxorubicin hydrochloride,DOX) 负载到GOFe3O4复合物上形成GO-Fe3O4-DOX 复合物,该复合物在碱性条件下可以分散形成稳定的悬乳液,而在酸性条件下发生聚集。在外加磁场下,可朝某个方向有规律地运动。基于该特性,GO-Fe3O4复合物载药后可实现药物的可控释放以及靶向递送。
研究发现,许多金属离子可以增强纳米酶的酶促反应。金属离子作为辅因子可以稳定纳米酶的构象,中和微环境中的阴离子,降低反应的静电斥力,传递电子加速反应。其中,重金属汞离子(Hg2+)可以显著促进金基纳米酶的过氧化物酶样活性。Huang 等[24]发现,在没有其他离子存在的情况下,柠檬酸盐覆盖的金纳米颗粒(AuNPs)具有较低的过氧化物酶样活性,它可以缓慢地催化过氧化氢产生羟基自由基,氧化TMB。然而,在Hg2+存在下,该纳米酶对TMB 的氧化作用更为明显[25]。另外,Wang 等[26]在研究中发现,将氮掺杂氧化石墨烯(GO)纳米颗粒在Cu2+离子孵育,Cu2+离子能与氧化石墨烯表面的官能团结合形成Cu2+-羧酸盐或混合Cu2+-羧酸盐/胺配合物,得到一种Cu2+-GO 纳米复合物。这种Cu2+-GO 纳米复合物具有辣根过氧化物酶(horseradish peroxidase,HRP)样的作用,能够在H2O2的存在下将多巴胺氧化为氨基色素。相比于未经修饰或经其他金属离子(Ni2+、Co2+、Pd2+、Cd2+)修饰的氧化石墨烯则对多巴胺氧化没有催化活性。基于这种重金属离子对纳米酶的不同作用,探索在更多重金属离子影响下,纳米酶的类酶活性产生的多样性变化,为纳米酶活性的可控调控提供了重要的研究实例。
一些有机小分子也会对纳米酶的活性产生影响。ATP是一种有机的生物小分子,作为生物体内细胞的能量“通货”,在许多生理过程中发挥着重要的作用。此外,ATP 也可作为一种“辅助因子”来影响纳米酶的酶促反应。Lin 等[27]通过将金纳米颗粒包裹在介孔硅(Au-SiO2)中,合成了一种具有过氧化物酶样活性的纳米酶。在生理温度(37℃)下,Au-SiO2纳米酶能在H2O2存在下有效催化过氧化物酶的显色底物2,2'-氮基-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)生成显色产物。然而,在高温(85℃)条件下,Au-SiO2纳米酶不能正常催化ABTS的显色反应。而在反应体系中引入ATP 后,从25~85℃的不同梯度温度下,Au-SiO2纳米酶均展现出良好的催化效果。由此可见,ATP的存在,使原本Au-SiO2纳米酶较窄的工作温度范围被大大拓宽。
DNA作为一种生物聚合物,具有明确的序列、可编程的自组装和特定的碱基配对规则。随着合成生物学成本的降低和化学修饰的快速发展,DNA纳米技术[28]已经实现了广泛的应用。此外,DNA的结合可以改变纳米酶的酶活性也已经得到证明[29],由于单链DNA(ssDNA)与底物具有高亲和力,使得覆盖ssDNA 之后可以加速氧化铁纳米颗粒的过氧化物酶样活性。Zhang 等[30]设计了两个主要包括突变链球菌(S. mutans)结合适配体的DNA 序列作为探针链。其中第一种序列(Sm1,5'-ATACTATCGCATTCCTTCCGAGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGG GGGGGGGGGGGGGGGGTCGGT-3')通过静电相互作用在Fe3O4NPs 表面被物理连接,而第二种(Sm2,5'-biotin-TTTATACTATCCATTCCTTCCGAGGGGGGGGGGGGGGGGGGGGGTGTGTCGGT-3')具有类似长度的序列通过亲和耦合方法连接,这些工程DNA-Fe3O4NPs界面被称为Fe3O4/Sm1和Fe3O4/Sm2 生物偶联物。研究人员通过比较H2O2存在下TMB 氧化的典型紫外可见光谱,单纯Fe3O4NPs 仅在652 nm表现出很低的吸光度,而经过DNA修饰的Fe3O4/Sm1 和Fe3O4/Sm2 对TMB 的酶活性显著提高,并且在652 nm 表现出较高的吸光度证实了这两种纳米颗粒都比裸纳米颗粒表现出明显的过氧化物酶样活性增强,其次还发现Fe3O4/Sm2 生物偶联物比Fe3O4/Sm1生物偶联物在652 nm表现出更大的吸光度,这表明通过亲和偶联的DNA 附着比物理吸附更显著地改善了酶的性能。
2 纳米酶的种类及其在疾病中的应用
2.1 过氧化物酶
过氧化物酶是一种以H2O2作为电子受体、催化底物氧化的酶。2007年,Gao等[31]报道了Fe3O4纳米颗粒具有与过氧化物酶相似的类酶活性。近年来,有文献报道,其他种类的金属基纳米酶,如MnO2、Fe3O4、Au、Ag 和CuO 纳米颗粒,也具有类似于Fe3O4纳米酶的催化活性。
几种类型的纳米酶氧化还原活性的机制如下所述(图2)。
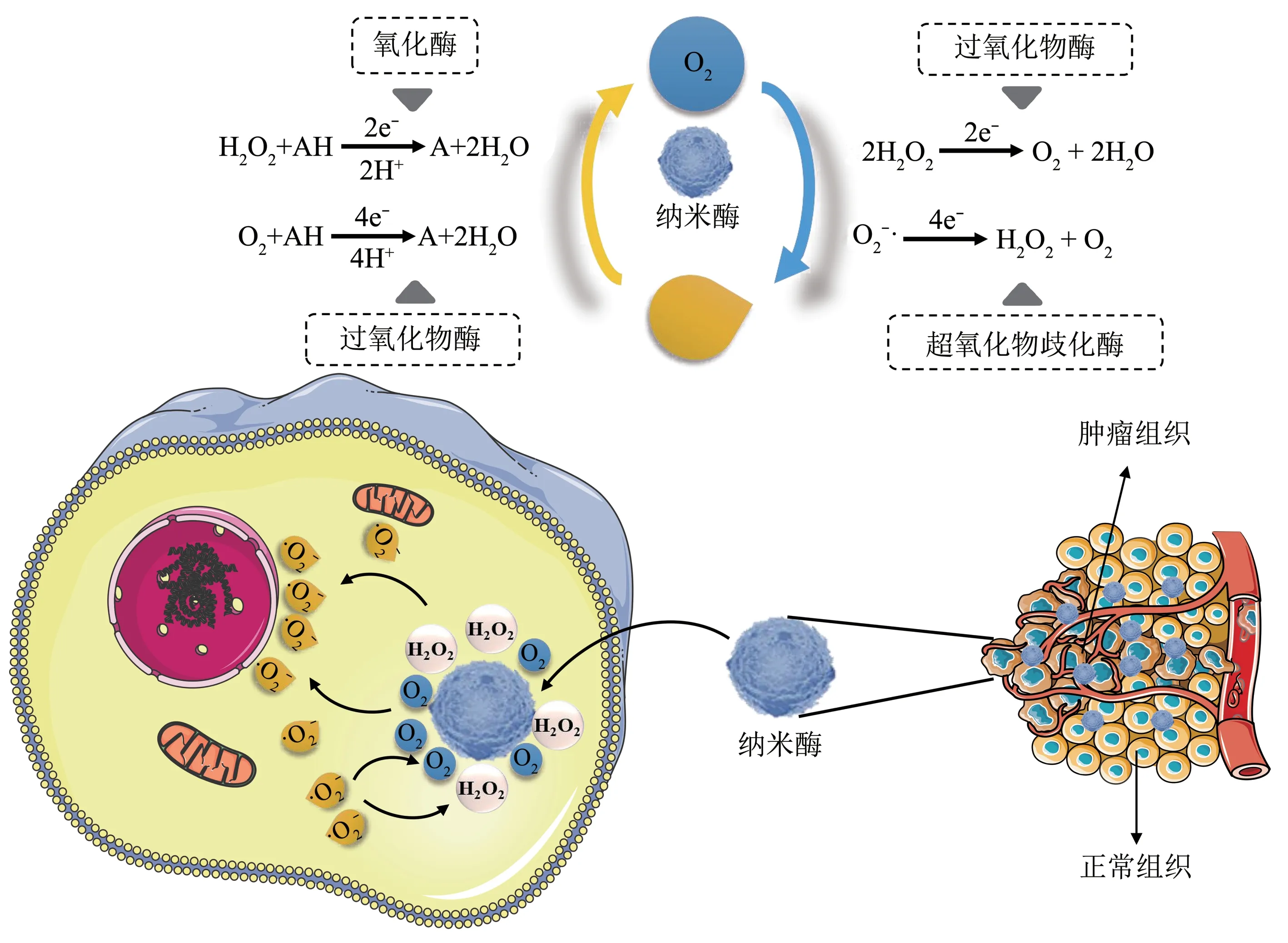
Fig. 2 Nanozymes regulate ROS balance by their intrinsic redox reactions图2 纳米酶氧化还原活性调节ROS平衡
2.1.1基于Mn的过氧化物酶样纳米酶
Mn 作为一种过渡金属,被研究用于基于Fenton 反应的化学动力学治疗(chemodynamic therapy,CDT)。例如,MnO2可以破坏细胞的抗氧化防御系统,增强癌细胞的氧化应激作用。最近,MnO2涂层的介孔二氧化硅纳米颗粒(MSN@MnO2)被报道用在基于自强化Fenton反应样的CDT[32]。MSN@MnO2可使瘤内谷胱甘肽(glutathione,GSH) 还原产生谷胱甘肽二硫和Mn2+。随后,Mn2+的Fenton反应样作用在生理介质中分解H2O2产生·OH。研究表明,MSN@MnO2对人胚肾293T 细胞的毒性低于人脑胶质瘤细胞U87MG。 在磁共振成像(MRⅠ) 指导下,MSN@MnO2通过诱导肿瘤间质内GSH消耗和ROS生成,能够显著抑制肿瘤生长[33]。
具有大孔隙率的Mn基纳米网络可能具有更高的GSH 消耗和ROS 生成能力。Wang 等[34]开发了一种具有高肿瘤特异性和消退能力的富含精氨酸的硅酸锰纳米气泡(AMSNs),这种材料具有良好的水分散性、生物相容性和肿瘤靶向作用,其表面的精氨酸显著增强了纳米微泡在肿瘤内的聚集,进而通过谷胱甘肽依赖性过氧化物酶4(glutathione peroxidase 4,GPX4)途径消耗GSH,最终导致肿瘤细胞发生铁死亡。
众所周知,癌细胞的迁移是导致癌症患者死亡的主要原因。Li等[35]通过将超小锰铁氧体纳米颗粒(UMFNPs)与肿瘤靶向肽CREKA 结合构建出一种超灵敏T1 加权MRⅠ造影剂UMFNP-CREKA,它能够实现超小乳腺癌转移的检测。锰铁氧体纳米颗粒在肿瘤微环境的低pH 值条件下具有显著的类过氧化物酶活性,通过与肿瘤周围丰富的纤维蛋白-纤维连接蛋白复合物结合再到肿瘤转移灶边缘,催化H2O2产生ROS,进而释放锰离子(Mn2+)到转移灶。Mn2+的局部释放及其与蛋白质的相互作用影响T1 加权MRⅠ信号的显著放大,实现对转移灶的显示。为了提高肿瘤治疗的特异性,Chen等[36]在K2Mn[Fe(CN)6](PBA)纳米粒子上包覆MⅠL-100,开发了一种治疗性纳米剂(PBAM)的前体。在酸性肿瘤微环境中,PBAM的MⅠL-100壳逐渐降解,触发Mn2+的释放,通过离子交换解除空间限制,使PBAM作为类过氧化物酶与细胞内HCO3-和H2O2反应产生·OH,从而进行抗肿瘤的化学动力学治疗。
2.1.2基于Fe的过氧化物酶样纳米酶
铁磁性纳米粒子(Fe3O4NPs)已被证明具有过氧化物酶样活性。该特性已被用于分析物检测、肿瘤组织可视化以及肿瘤治疗等。利用这一活性,Fu等[37]在添加低浓度H2O2的肿瘤治疗中发现,在Fe3O4NPs 被内吞到HeLa 细胞后,Fe3O4NPs 通过Fenton 反应催化细胞内H2O2分解产生ROS,从而对癌细胞产生杀伤作用。
此外,Wu 及其同事[38]设计了一种利用聚乙二醇化纳米粒子与α环糊精包合的磁性水凝胶纳米酶用于协同肿瘤治疗。在肿瘤的酸性环境中,Fe3O4纳米酶的过氧化物酶样活性可以通过Fenton反应产生·OH 用于肿瘤的化学动力学治疗,同时可以在交变磁场中通过磁热机制产生热,起到协同肿瘤治疗作用。
2.1.3基于Au或Ag的过氧化物酶类纳米酶
截至目前,许多稀有金属已被证明具有类似过氧化物酶的性质。Ye等[39]成功地制备了薄的二维金纳米海藻(AuNSWs),较大的表面积和只有两个原子层的超薄特性使其具有很多暴露的催化活性位点,表现出了显著的催化性能,可以还原4-硝基酚和降解H2O2。研究发现,Au@Ag 异质纳米棒(NRs)具有较高的催化活性,在接近中性的pH和较宽的温度范围内可以作为过氧化物酶类似物。Au和Ag的合金化导致的电子结构的变化,提高了Au@Ag 异质纳米棒(NRs)的活性,使其在催化过程中获得更好的性能[40]。
低浓度的银纳米颗粒(AgNPs)可以破坏病原体的关键膜蛋白,破坏线粒体呼吸链,因此AgNPs 可以基于Ag+的低动力学释放用于抗菌应用[41]。此外,银离子也能够催化类Fenton 反应,Duan 等[42]发现了一种基于Ag NPs 的新型催化纳米系统(Ag NPs-TAMRADNA@GO)[42],该系统是以荧光猝灭DNA 探针(TAMRA-DNA)为模板制备Ag NPs,然后通过在氧化石墨烯纳米片上自组装得到的。Ag NP 催化的Fenton 样反应有助于TAMRA-DNA 的裂解,从而实现对肿瘤的实时成像和CDT 过程的监测。同时,基于Ag NP 的CDT纳米系统对富含H2O2的肿瘤显示出高度的特异性,为追踪细胞内H2O2和肿瘤治疗提供了潜在的可行性[43]。
2.1.4基于碳的过氧化物酶样纳米酶
具有过氧化物酶样活性的氮化碳纳米片(g-C3N4纳米片)因其在可见光下具有出色的光催化能力而备受关注。通过将g-C3N4与AuNPs(g-C3N4@AuNPs,CNA)结合,Sun 等[44]在生物耐受的H2O2水平上实现了耐药细菌和其生物膜的根除。由于单链DNA 可以增强纳米酶的过氧化物酶样活性[45],Li 等[46]将g-C3N4纳米片与CD63 特异性结合的ssDNA 适配体结合,开发了一种新型的杂合纳米酶,实现了TMB 氧化细胞外囊泡的检测功能。
2.1.5基于Cu的过氧化物酶样纳米酶
近年来, 肿瘤微环境 (tumor microenvironment,TME)介导的Fenton 反应在肿瘤治疗中得到了广泛的研究。有研究发现,Cu2+在中性和弱酸性条件下参与Fenton反应的效率较高,可以达到Fe2+/Fe3+的160 倍,具有作为类Fenton 反应催化剂的巨大潜力[47]。
Lin等[48]在OH-的辅助下开发了Cu2+和H2O2配位的过氧化铜纳米点(CPNs)。CPNs 在含OH–介质中表现出良好的稳定性,但在细胞内吞后的弱酸性环境中可被分解,促进Cu2+和H2O2释放,导致·OH 诱导的肿瘤细胞脂质过氧化和凋亡。此外,小颗粒CPNs静脉给药后在肿瘤中蓄积程度高、穿透深度深,为增加细胞内H2O2以增强CDT 提供了新的渠道。研究显示,CPNs 在剂量为10 mg/kg 时会显著抑制U87MG肿瘤生长。
Wen 等[49]发现的Cu2-xTe NEs 具有两种类酶活性(谷胱甘肽氧化酶(GSHOx)和过氧化物酶),可分别促进GSH 的消耗和ROS 的生成,在NⅠR-ⅠⅠ光照射下可以逆转免疫抑制的肿瘤微环境。Chen等[50-51]发现,Cu2+-NMOFs能够模拟NADH过氧化物酶,催化二氢烟酰胺腺嘌呤二核苷酸(NADH)氧化为烟酰胺腺嘌呤二核苷酸(NAD+),可用于开发探测葡萄糖或NADH等物质的传感器。Ma等[52]通过Cu2+和半胱氨酸的自组装,制备了用于化学动力学治疗的铜-氨基酸巯基纳米颗粒(Cu-CysNPs)。Cu-CysNPs可以消耗谷胱甘肽(GSH)并产生Cu+,Cu+将进一步催化H2O2生成·OH,用于癌症治疗。
2.1.6其他
由于抗生素耐药性的出现,细菌感染引起了极大的关注。近年来,提高H2O2的抗菌活性,并减少其使用量是伤口消毒的要求。所以,在提高H2O2抗菌性能的同时,避免高水平H2O2引起的毒性已成为治疗中的一个明显问题。因此,越来越多的具有类过氧化物酶性质的新型抗菌纳米材料相继出现。其中,铂基纳米晶体的形状、尺寸、形态和结构控制良好,因此在催化过程中得到了广泛的应用。Wu 等[53]成功地开发了Pt 空心纳米枝晶,由于最大限度地利用了Pt 原子和高折射率晶面,这些纳米枝晶表现出了优异的过氧化物酶样活性,并在较大的温度范围内均表现出催化活性,证明其具有良好的热稳定性。
2.2 过氧化氢酶
过氧化氢酶是一类广泛存在于动物、植物和微生物体内的天然氧化酶,是生物体内H2O2和活性氮代谢的关键酶,构成了生物体内抗氧化酶体系内的重要组分。其能够以H2O2为底物,分解产生水和氧气[54]。其调节ROS平衡的机制可见图3。
癌细胞的特征是ROS 的增加和抗氧化酶谱的表达改变,使癌细胞对氧化剂更加敏感,为肿瘤的氧化治疗提供了思路。但是多种促氧化疗法(如光动力疗法、声动力疗法等)依赖于较高的氧气浓度,其应用受到肿瘤微环境缺氧条件的限制。在这种情况下,利用过氧化氢酶类纳米酶解决肿瘤缺氧是一种治疗癌症的新方法[55]。
2.2.1基于Mn的过氧化氢酶样纳米酶
光动力疗法(photodynamic therapy,PDT)和放射疗法是严重受O2影响的肿瘤治疗方法,肿瘤缺氧对其有一定的限制[56]。因此,构建一种产氧剂-光敏剂复合的治疗体系,在光动力治疗的同时实现氧气生成,进而产生更多的细胞毒性ROS 来增强PDT 迫在眉睫。Wang 等[57]设计了一种介孔纳米酶(MnCoO-PDA-PEG),该介孔结构为纳米酶MnCoO 和光敏剂Ce6 负载提供了大量的活性位点,可以催化内源H2O2分解,有效地生成O2,缓解肿瘤缺氧的作用,显著提高PDT效果。Qu等[58]以Ce6 为光敏剂、MnO2为类过氧化氢酶合成了PPy@MnO2-BSA(牛血清白蛋白稳定二氧化锰(MnO2)/PPy),该复合材料体系可以在肿瘤微环境中持续分解H2O2产生氧气,缓解肿瘤缺氧情况并实现氧气增强的PDT 治疗。Liu 等[59]制备了与上述纳米酶功能类似的纳米平台(R-MnO2-FBP),实现氧气自给自足以增强PDT 治疗效果。R-MnO2-FBP经过EPR效应(高渗透性和滞留效应)进入肿瘤细胞后,在富含H2O2的肿瘤微环境中分解H2O2,产生的氧气可进一步用于增强PDT 治疗效果。在Zhang 等[60]的研究中,一种介孔二氧化锰纳米颗粒被构建为原位产氧材料,以缓解肿瘤缺氧状况。MnO2纳米颗粒催化H2O2在肿瘤部位产生氧气,迅速消耗内源性葡萄糖,切断肿瘤细胞的能量供应进行癌症饥饿治疗,增强ROS的生成。
缺氧是肿瘤增殖的关键调控因子之一,缺氧诱导因子1(hypoxia inducible factor-1,HⅠF-1)是缺氧引起的肿瘤标志物,在肿瘤缺氧区域表达上调。HⅠF-1与肿瘤增殖分化、代谢以及血管新生也密切相关,高活性的HⅠF-1可诱导肿瘤对放疗产生耐药性[61]。Meng 等[62]制备了一种结合了亲水性阳离子吖啶黄(acriflavine, ACF) 与MnO2NPs(ACF@MnO2ROS)的新型响应型纳米平台,该纳米颗粒在肿瘤组织内聚集后,可被肿瘤细胞有效内吞,主要位于溶酶体内。一旦在酸性条件下与H2O2发生反应,纳米颗粒将产生氧气以缓解缺氧微环境,并实现直接辐射敏化。同时释放出来的ACF会逐渐转移到细胞核内,抑制缺氧诱导因子1(HⅠF-1 hypoxia inducible factor-1)的转录功能,协同HⅠF-1 下游信号分子(如PD-L1)抑制异位瘤的增殖。
2.2.2基于Fe的过氧化氢酶样纳米酶
除Mn2+外,Fe3+也是一种常见的抑制肿瘤缺氧的金属离子,氧化铁可作为催化剂显著加速H2O2在中性和碱性环境中分解为水和氧的速度。Yin等[63]开发了一种具有类似过氧化氢酶和类似谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)的活性的MnFe2O4@MOF核壳纳米平台,该纳米平台一旦内化到肿瘤中,就可以通过循环Fenton 反应持续催化H2O2产生O2来克服肿瘤缺氧,同时MnFe2O4@MOF 也能够在H2O2存在的情况下更高效地消耗谷胱甘肽(glutathione, r-glutamyl cysteingl+glycine,GSH),而GSH含量的降低是一种潜在的凋亡早期激活信号,与产生的氧自由基共同促使细胞发生凋亡[63]。
2.2.3基于铈(Ce)的过氧化氢酶样纳米酶
二氧化铈纳米材料,由于其纳米尺寸下具有较多的氧空位,可以实现Ce3+和Ce4+的可逆转化,产生催化效应,催化H2O2分解为水和氧气。张玉涛[64]合成了PAH(烯丙胺·盐酸)修饰的二氧化铈纳米管(PAH-CNt),在含有过氧化氢和酸性环境下,ABTS能够被氧化生成在近红外区具有较强吸收作用的ABTS自由基,产生光热效应。含有过氧化氢和酸性环境两者均是ABTS自由基产生的必要条件,故在搭载ABTS 后形成的ABTS@PAHCNt可以对肿瘤细胞产生选择性的光热效应。Jiang等[65]利用Ce元素(Ce(ⅠV),Ce(ⅠⅠⅠ))和CuS纳米颗粒合成了纺锤状CuS@CeO2纳米颗粒。CeO2作为纳米酶催化内源性H2O2转化为O2,满足了PTT(光热治疗)/RT(放射治疗)治疗时对较高浓度氧气的需求,其纺锤状结构可增强其穿透肿瘤和随后被癌细胞内化的能力,有利于在实体肿瘤中的运输和进一步的细胞摄取。
2.2.4基于Pd的过氧化氢酶样纳米酶
Sun 等[66]通过Pd@Pt 纳米板与中-四(4-羧基苯基) 卟啉(T790) 桥接制备了超声响应的Pd@Pt-T790 纳米酶。在正常条件下,T790 修饰Pd@Pt可以阻断Pd@Pt的过氧化氢酶样活性;而在超声作用下,Pd@Pt-T790的过氧化氢酶活性恢复,产氧能力增强。该现象可能是由于超声促进了H2O2的扩散,增加了H2O2与Pd@Pt 的相互作用,使纳米酶活性被有效地恢复。这种由超声触发的酶活性具有良好的疾病位点特异性和时空可控性,能够实现肿瘤的精准治疗并降低对正常组织的损伤。Dai 等[67]构建了一种集成铂纳米酶和光敏剂的MOFs 纳米平台,MOFs 可以有效阻止相邻铂纳米颗粒的聚集,从而保证了铂纳米酶的稳定性和过氧化氢酶样活性。该纳米平台可以通过分解H2O2产生O2来提高PDT在肿瘤缺氧部位的治疗效率。
2.2.5其他
Ge 等[68]使用ESR 血氧法测量了O2的产生,验证了钯八面体比钯纳米晶体具有更高的过氧化氢酶样活性。Feng等[69]制备了一种二维(2D)碳化钒(V(2)C)MXene纳米酶(mx酶),可以模拟包括过氧化氢酶在内的6种自然产生的酶。Xu等[70]合成了聚乙烯吡咯烷酮改性二硫化钨(WS(2)-PVP)纳米花,WS(2)-PVP 纳米花不仅在体内外均具有良好的生物相容性,还有模拟过氧化氢酶的能力。这些具有过氧化氢酶样高活性的纳米酶都可能对肿瘤的治疗有积极的作用。

Fig. 3 Mechanisms of catalase and superoxide dismutaselike nanozyme regulating ROS balance图3 过氧化氢酶样纳米酶和超氧化物歧化酶样纳米酶调节ROS平衡
2.3 超氧化物歧化酶(SOD)
SOD 是生物体系中抗氧化酶系的重要组成成员,是机体内超氧自由基的天然清除剂。在正常情况下,机体内SOD 与超氧自由基保持动态平衡。但在病理状态下,机体内产生过量的超氧自由基破坏动态平衡,此时机体本身产生的SOD 不能完全清除过多的超氧自由基,引起生物系统中严重的氧化应激,导致细胞生物分子的损伤和各种疾病的发生。研究表明,利用具有SOD 样特性的纳米酶以选择性调节细胞内ROS 水平,可以保护正常细胞免受ROS威胁并减缓细胞功能退化。
2.3.1基于Fe的超氧化物歧化酶样纳米酶
普鲁士蓝纳米颗粒(PBNPs)可作为多酶模拟剂和活性氧清除剂,Zhang 等[71]采用氧化低密度脂蛋白、高葡萄糖含量和再灌注等方法建立了一系列体外ROS 生成模型,在小鼠体内建立了脂蛋白炎症模型,并证明了PBNPs 在上述病理过程中具有抑制或缓解ROS损伤的潜力。Zhou等[72]制得了具有清除活性氧酶活性的典型普鲁士蓝类似物(FeCo-PBA NPs),证实了其在细胞生长中的积极作用,这为生物技术应用中建立控制细胞的机制提供了新的途径。
2.3.2基于Mn的超氧化物歧化酶样纳米酶
锰基纳米材料具有类超氧化物歧化酶等多种特性。其中Mn3O4纳米酶已被证实具有SOD 样活性,可治疗由ROS 引起的神经障碍的潜力。在急性缺血性脑卒中,溶栓前的缺氧和溶栓后的增氧均可导致自由基水平升高,导致神经细胞受到持续损伤,因而在治疗中需要清除自由基,调节缺氧和促氧微环境。Shi 等[73]设计出工程纳米海绵(Mn3O4@nanoerythrocyte-T7,MNET),通过自适应调节氧和清除自由基来重塑中风时的微环境。借助红细胞的隐匿作用和T7 肽的辅助作用,MNET在血液中的循环时间得以延长,可在溶栓前通过快速清除自由基和及时供氧挽救神经细胞,在溶栓后通过储氧抑制促氧,清除自由基以避免再灌注损伤。
2.3.3其他
Sun 等[74]通过组装蛋白质,成功设计并制备出含硒纳米酶。凭借固有的类似谷胱甘肽过氧化物酶(GPx)的特性,该纳米酶可以通过Se纳米成分分解H2O2,产生无毒产物谷胱甘肽,作为抗氧化剂保护线粒体免受ROS的伤害。Guo等[75]利用二维过渡金属硫化物(TMCs)纳米片和聚乙二醇(PEG)合成了Mo3Se4纳米片(PMNFs)。该纳米片具有SOD 等多种酶活性,对葡聚糖硫酸钠(DSS)诱导的结肠炎具有抑制氧化损伤、炎症和肠屏障破坏的作用。其作用机制主要是通过抑制TLR4/NF-κB通路以逆转DSS诱导的氧化损伤,减缓DSS 引起的上皮细胞凋亡,激活抗氧化通路Nrf2-keap1 信号,阻止紧密连接蛋白(ZO-1、occludin和claudin-1)和黏蛋白2(muc2)的减少。
铂纳米颗粒同样具有出色的催化性能,Zhang等[76]用铁蛋白包裹铂纳米颗粒,使其在具备类SOD活性的同时具有更强的稳定性。
2.4 氧化酶
氧化酶是过氧化物酶体中的主要酶类,可氧化多种底物。在生物体内存在多种氧化酶,如胆碱氧化酶,也称胆碱酯酶,主要存在于胆碱能神经末梢突触间隙,可水解乙酰胆碱,避免因乙酰胆碱过剩后集聚引起的胆碱能神经过度兴奋。细胞内NADH(还原型辅酶Ⅰ)产生于糖酵解和细胞呼吸作用中的柠檬酸循环,可作为生物氢的载体和电子供体,在线粒体内膜上参与氧化磷酸化过程,转移能量,供给ATP合成,在维持细胞生长、分化和能量代谢以及细胞保护方面起着重要作用。
评估血清中葡萄糖的氧化程度能够定量测定其中肌红蛋白的浓度水平,而临床常以肌红蛋白作为准确诊断心肌梗死的生物标志物。Zhang 等[77]研究设计了一种由捕获抗体修饰的玻璃碳电极和检测抗体偶联的CuS-MoS2组成的“信号”电化学免疫传感器系统,其中CuS-MoS2部分可将电化学检测液中的葡萄糖氧化,进而对肌红蛋白进行定量检测,该系统的应用可能在心肌梗死诊断中发挥作用。
近年来,癌症饥饿治疗作为一种新型肿瘤治疗手段被广泛研究。葡萄糖氧化酶(GOx)作为一种在葡萄糖饥饿疗法中发挥作用的治疗剂,可在氧气的参与下催化癌细胞内的葡萄糖水解为葡萄糖酸和过氧化氢,减弱糖酵解及核苷酸、脂质和氨基酸等中间代谢物的产生,切断癌细胞所需的各种必需成分的供应,同时提高肿瘤环境的缺氧程度与酸度,抑制肿瘤增殖。由于GOx 具有不稳定性和易失活性,易被体内存在的大量蛋白酶诱导而水解或失活,Wang等[78]将阳离子聚合物聚(N,N'二甲氨基-2-甲基丙烯酸乙酯,PDMA)定点引入GOx 的N末端,以生成具有良好保留活性和稳定性的GOx–PDMA复合物,避免了其他基团随机修饰引起的活性降低,使Gox的活性保持在90.7%。将该缀合物及GOx 分别注射至结肠癌小鼠模型的肿瘤内部之后,复合物的耐受性相比游离GOx 增加了5 倍,细胞毒性增加了1.5 倍,肿瘤保留率增加了2 倍,可完全消除肿瘤。
2.5 水解酶
水解酶是催化水解反应的一类酶的总称,例如,它们可以水解核苷酸和磷酸基团。胶原蛋白是存在于肿瘤细胞外基质中的一种蛋白质,它能够阻碍抗肿瘤药物对肿瘤组织的浸润、降低治疗效果。Li 等[79]使用两亲性半导体聚合物和菠萝蛋白酶(Bro)合成了一种具有光热效应的半导体聚合物纳米酶(PCB1-Bro)。在近红外光的照射下,半导体聚合物通过光热机制产热,升高局部组织温度,激活温度敏感的菠萝蛋白酶,进而能有效地消融肿瘤细胞外基质中的胶原蛋白,实现了可控的酶活性激活效果,降低了全身副作用并增强了纳米颗粒对肿瘤的穿透和滞留。
Lin 等[80]以一次性口罩(disposable face masks,DFMs)作为金属离子Pb(ⅠⅠ)、Cd(ⅠⅠ)和Sr(ⅠⅠ)的载体,通过老化及金属吸附过程中发生的一系列的原子转移,展示了DFMs 水解酶的特性。在紫外线辐射的诱导作用下,DFMs的碳氢键断裂并与氧反应形成过氧自由基(ROO•),后进一步吸收空气中的氢原子,最终形成过氧化氢基团(RCOOH),实现DFMs 的老化。老化DFMs 表面存在的过氧化氢基团作为电子供体结合金属,通过络合作用使得DFMs表面出现更多的金属离子。
Li 等[81]通过微调金属团簇的路易斯酸度(Lewis acid)以提高水解纳米酶的固有活性,并提供缩短配体长度以提高其活性位点的密度,最终筛选和预测出MOF(金属-有机框架)基水解纳米酶的催化活性位点,成功设计了基于Ce-FMA-MOF的水解纳米酶。该纳米酶能够切割磷酸键、酰胺键、糖苷键甚至生物膜,水解底物的效率很高。这是因为未活化的Ce-FMA即使在不使用助催化剂的情况下也可表现出优异的磷酸酶样活性,其次是Ce-FMA对牛血清白蛋白(BSA)具有较高的水解活性,其水解效率是多功能Zr 基MOF-808 的12.7倍。除此以外,该纳米酶还可推断非生物活性位点,而不是局限于直接修饰天然活性位点,以带来新的裂解位点,扩大多肽的多样性,增加获得活性多肽的可能性。
表1列举总结了不同类型的纳米酶在体内外的应用。

Table 1 Summary of the types and applications of the major nanozymes表1 主要的纳米酶种类和应用总结

续表1
3 总结与展望
本文总结了近年来纳米酶的最新研究进展。目前已经成功地设计出来的纳米酶,能够模拟大多数关键的天然酶(POD、CAT、SOD、氧化酶和水解酶),相比于天然酶,纳米酶具有性能稳定、尺寸可调、制备简单等优点,其应用也已经涉及到生物化学、生命科学和医学的许多领域,包括生物检测和抗炎、抗氧化损伤和癌症治疗。
虽然纳米酶在疾病治疗与诊断方面取得了一定的研究进展,但仍存在一部分问题。a. 纳米酶对于底物选择性较差,导致纳米酶催化特异性较差,因此纳米酶的催化速率难以达到体内天然酶的水平。b. 目前,纳米酶催化的反应类型已经从氧化还原扩展到水解等。但范围仍然不够宽,对于裂解酶等其他酶的研究较少,不足以覆盖所有重要的酶促反应[82]。c. 部分纳米酶材料为重金属,生理条件下可能分解出重金属离子,材料本身的毒性以及清除率限制了其应用。d. 目前基于纳米酶的诊断方法主要是通过在纳米酶表面修饰抗体、多肽、小分子或者适配体等靶向分子,赋予其靶向性,从而特异性地识别待检物质。然而,这种方法会存在一些非特异性吸附的情况[83],使得探针的特异性降低,而且操作步骤比较繁琐,增加了临床转化的难度。e. 不同的纳米酶在抗肿瘤过程中可能具有协同作用。f. 目前仍缺乏不同类型的纳米酶催化体系的建立,纳米酶的催化机制多种多样,具有多种酶活性的纳米酶的分子机制尚不清楚。因此构建具有多种功能、良好生物相容性、高靶向效率的纳米酶系统仍是一个亟待解决的问题[84]。
未来用于体内生物应用的纳米酶也有很广阔的前景:进一步提高纳米酶的催化效率会使其在各方面的应用率大幅提升。当然,拥有高催化效率的同时,纳米酶的选择性和特异性也是一个创新突破口,其目的是为了有效的避免纳米酶在应用中由于未知反应而引起的意外毒性,从而确保未来纳米酶拥有优良的安全性能,为了解决这一问题,合理设计的可控纳米酶对于实现其对各种疾病的酶模拟活性的高特异性具有重要意义。目前已有研究表明,一些外源性刺激,如光和超声等,可以作为控制纳米酶活化的触发器,这些可行性手段也为开发具有更高特异性纳米酶提供了更广泛的思路[85]。另外,相信仍然有一些更实用、更安全的纳米酶及其催化机制未被发现,随着纳米酶的巨大发展,希望看到更多的实际应用,如药物传递、靶向、免疫和治疗干预等领域,甚至一些生物医学设备。不仅是生物医学,还有环境、农业、法医学,甚至国家安全领域,这些方面都非常具有前景。例如,纳米酶也涉及到新型冠状病毒感染(COVⅠD-19)的治疗与诊断,包括用于快速诊断的纳米孔测序和用于传递mRNA疫苗的脂质纳米颗粒载体;纳米酶作为精确的生物传感器,可以检测500 mg/L 人血清病毒的存在[86]。因此,纳米酶的研究对未来全球抗击COVⅠD-19和远期未知的某种新型流行病并保护人类健康来说是一个有前途的工具,有待进一步探究。另外,纳米酶的广阔前景还体现在肿瘤治疗上,纳米酶一方面可以利用肿瘤微环境内的特征信号如低氧浓度、微环境的pH值等作为内源性刺激,另一方面可以利用外部信号如声、光、磁、热等信号作为外源性刺激从而激活其活性[87],理想的纳米酶是应该在特定的位点起作用,因此,具有特定细胞或细胞器靶向能力的纳米酶将更有利于其发挥作用,同时也可以预防全身毒性作用,从而在肿瘤的治疗上发挥里程碑式的作用。对于生物检测,纳米酶在大规模临床使用中的一个主要挑战就是缺乏规范化的标准。不同的技术和测量途径与方法,不同的应用领域,不同的操作实验室可能导致测量结果的变化,这种标准化便是纳米酶检测投入大规模实际应用的一大保证。最后,鉴于纳米酶在疾病治疗与诊断中的良好效果,未来让纳米酶不止局限于实验室,而是更多工艺化、生产化、规模化、标准化的纳米酶产品走出实验室,走向市场,更好地服务于人类健康与提高生活品质,就需要催化效率更高,副作用更少,治疗效果更特异,覆盖领域更广的纳米酶出现。

