台湾独蒜兰组培繁育及其假鳞茎的化学组成分析
孙 健,任江剑,王海阁,江建铭,王志安,俞旭平
(浙江省中药研究所有限公司,浙江 杭州 310023)
台湾独蒜兰(PleioneformosanaHayata) 是兰科(Orchidaceae)独蒜兰属(Pleione)植物,作为重要的观赏及药用植物,市场对独蒜兰属植物资源的需求很大。台湾独蒜兰分布于台湾、福建西部至北部、浙江南部和江西东南部[1],主要生长在林下或林缘腐殖质丰富的土壤或岩石上,生长的小环境条件苛刻。台湾独蒜兰可以通过种子繁殖和假鳞茎增殖的方式繁育。但自然群体中,台湾独蒜兰结实率极低,且种子无胚乳,萌发率极低,同时,通过假鳞茎无性繁殖的比率也很低。低繁殖率和苛刻的生存环境使得台湾独蒜兰自然居群生存极易受到威胁。目前,独蒜兰属所有物种被列入《濒危野生动植物种国际贸易公约》附录Ⅱ和 2021 年版《国家重点保护野生植物名录》的二级保护植物。
同属的植物独蒜兰[P.bulbocodioides(Franch.) Rolfe]和云南独蒜兰[P.yunnanensis(Rolfe) Rolfe]被《中华人民共和国药典》作中药材“山慈菇”的基原植物。独蒜兰和云南独蒜兰以假鳞茎入药,被称为“冰球子”,具有清热解毒、化痰散结、平喘止咳、消炎、镇痛、止血等功效,用于治疗痈肿疔毒、瘰疬痰核、淋巴结结核、蛇虫咬伤、气管炎、百日咳、哮喘、咳血、跌打损伤和化脓性骨髓炎等疾病[2]。近二十年,国内外学者对独蒜兰属植物假鳞茎的化学成分进行了系列分离鉴定,包括联苄类、菲醌类、木脂素类、黄酮类和简单酚类等化合物,这些次生代谢产物或提取物具有抗癌、保肝、抗炎、神经保护和抗氧化等活性[2-4],其中所含的苄酯类是一类存在于兰科植物中且结构较新颖的化学成分,具有益智、延缓衰老、保护神经等作用[5]。但目前云南独蒜兰资源急剧减少,以致面临枯竭,而台湾独蒜兰和独蒜兰是同属的近缘物种,具备潜在的近似功效的药用价值。但是目前未见有关台湾独蒜兰药用方面的报道,本研究通过分析栽培台湾独蒜兰假鳞茎化学组成,以台湾独蒜兰的果荚为材料,探索台湾独蒜兰的组培繁育技术体系,同时应用代谢组学和HPLC技术分析台湾独蒜兰的主要成分组成,并应用组培技术繁育得到台湾独蒜兰的植株,对扩大“冰球子”的入药材料来源有一定指导价值。
1 材料与方法
1.1 仪器
Exactive-UltiMate 3000超高压液相超高效液相色谱-四极杆/静电场轨道阱高分辨质谱仪(美国赛默飞世尔科技有限公司),ACQUITY UPLC BEH C18色谱分析柱(100 mm×2.1 mm,1.8 μm,美国沃特世公司);Agilent 1100液相色谱(美国安捷伦公司),ODS C18色谱柱(250 mm×4.6 mm,5.0 μm,美国波士顿公司);AB204-S型电子天平(瑞士梅特勒-托利多公司);Heraeus Fresco17离心机(美国赛默飞世尔科技有限公司);Milli-Q型超纯水系统(美国密理博公司)。
1.2 试剂和材料
台湾独蒜兰的果荚于2019年8月上旬采集于浙江省景宁自治县东坑镇。培养20个月,选取大于0.5 g的假鳞茎,60 ℃烘干,获得干燥药材。1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯购自成都曼思特生物科技有限公司(Must-22021511,纯度≥99.85%);乙腈、甲醇(色谱纯,美国赛默飞世尔科技公司),其他化学试剂为分析纯。
1.3 组织培养条件
1.3.1 外植体消毒
台湾独蒜兰蒴果置于浓肥皂水中刷洗干净,在超净工作台上将洗涤后的蒴果用75%(体积分数)乙醇表面消毒处理1 min,再用0.1%(质量分数)的HgCl2消毒20 min,用无菌水冲洗6次,用无菌滤纸吸干蒴果表面的水分。
1.3.2 种子接种和原球茎培养
在超净工作台上纵向剖开蒴果,将种子均匀撒播在培养基上。然后将其置于25 ℃暗培养,此阶段培养基为:1/2MS+活性炭(1 g·L-1)+蔗糖(30 g·L-1)+琼脂(6.8 g·L-1),pH值5.8。在播种20 d后种子明显萌发,形成圆球状茎。待种子萌发出原球状茎后更换培养基并采用光照培养,温度为25 ℃,光照时间12 h·d-1,光照强度1 200 lx。换用原球状茎继代培养的培养基为:1/2MS+6-BA(1 mg·L-1)+NAA(0.1 mg·L-1)+活性炭(1 g·L-1)+蔗糖(30 g·L-1)+琼脂(6.8 g·L-1),pH值5.8。
1.3.3 假鳞茎分化增殖
原球状茎经增殖培养60 d后长出第1片叶芽,但丛生芽数量相对较少,叶片细弱,此时,需对继代增殖原球状茎进行叶芽诱导、丛芽增殖,选择大小适合的原球状茎接种于添加不同激素配比(表1)的培养基上,基础培养基为1/2MS活性炭(1 g·L-1)+蔗糖(30 g·L-1)+琼脂(6 g·L-1),pH值5.8,培养100 d左右继代培养1次。采用光照培养,温度为25 ℃,光照时间12 h·d-1,光照强度1 200 lx。
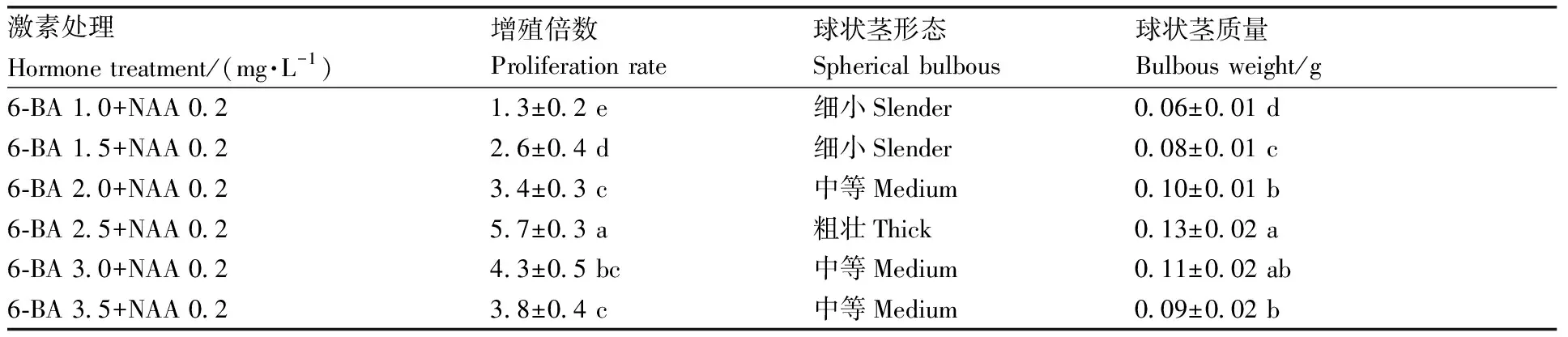
表1 不同激素处理对球状茎的影响
1.3.4 壮苗培养
将丛芽增殖的小苗接种于不同激素种类和浓度的生根培养基上,所选材料为大小和长度,以及生长状况一致的带叶的丛芽小苗。完成接种后将材料移至培养室中,采用光照培养,温度为25 ℃,光照时间12 h·d-1,光照强度1 200 lx。培养100 d左右继代培养1次。基础培养基为1/2MS活性炭(1 g·L-1)+蔗糖(30 g·L-1)+琼脂(6 g·L-1),pH值5.8,不同激素及浓度组合的处理见表2。
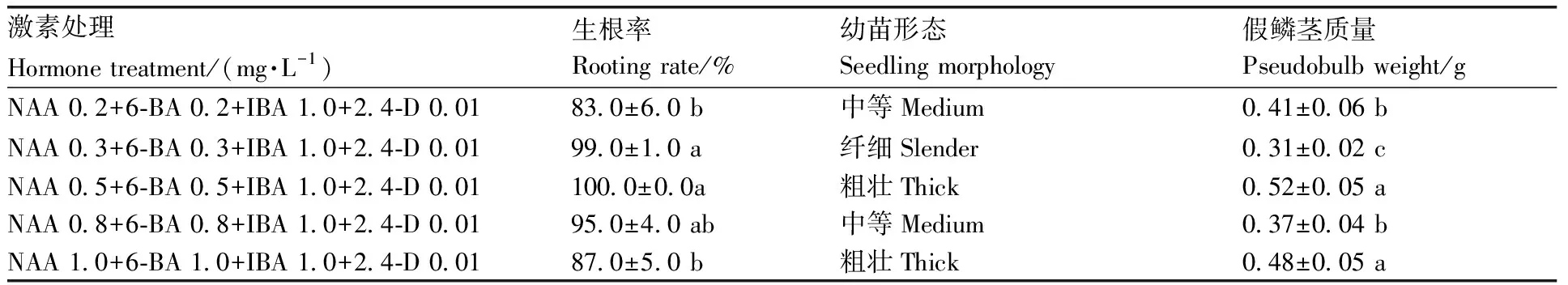
表2 不同激素及浓度组合对壮苗的影响
1.4 HPLC色谱分析
柱温:30 ℃;流速:1.0 mL·min-1;流动相:0.1%磷酸水溶液(A)-乙腈溶液(B),梯度洗脱;检测波长:224 nm;进样量10 μL。梯度洗脱程序:0~36 min,A为90%~83%;36~48 min,A为83%~76%;48~60 min,A为76%~73%;60~62 min,A为73%~69%;62~80 min,A为69%~60%;80~81 min,A为60%~10%;81~85 min,A为10%;85~86 min,A为10%~90%;86~91 min,A为90%。理论板数按1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯峰计算应不低于4 000。
样品制备:称取50 ℃烘干的假鳞茎粉末约0.3 g,精密称定,置具塞锥形瓶中,精密加入稀乙醇25 mL,称定质量,超声处理(功率300 W,频率45 kHz)30 min,取出,放冷,再稳定质量,用稀乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。3次重复。
1.5 代谢组分析
质谱条件:液相条件为,进样量为4 μL,柱温35 ℃,流速为0.4 mL·min-1。采用的流动相为A相:水(0.1%甲酸);B相:乙腈(0.1%甲酸)。液相梯度设置为0~0.5 min 5% B;0.5~7 min 5%~100% B;7~8 min 100% B;8~8.1 min 100%~5% B;8.1~10 min 5% B。应用Q-Exactive (Thermo Scientific) 高分辨质谱仪,正、负离子检测模式,喷雾电压3.5 kV,毛细管温度350 ℃,雾化室温度 320 ℃,鞘气流速 45 arb,辅助气流速 15 arb,扫描模式为Full MS/dd-MS,Full MS分辨率 70 000,dd-MS分辨率 17 500,扫描范围为m/z70~1 050。MS/MS模式时所用碰撞能量为 30 eV。
样品制备:称取假鳞茎粉末100 mg,向样品加入 120 μL 50%甲醇,震动充分混匀,提取样品中的代谢物,常温静置10 min;提取液放-20 ℃过夜,沉淀样品中的蛋白质;4 000×g离心20 min,转移上清液代谢物提取液。
1.6 数据统计
应用CD3.1软件处理本研究所得的质谱数据,应用KEGG数据库 https//www.genome. jp/kegg/pathway.html和HMDB 数据库 https//hmdb.ca/metabolites 进行代谢物代谢通路注释。
2 结果与分析
2.1 台湾独蒜兰组培体系构建
台湾独蒜兰种子培养基上播种15~20 d,发芽率超过90%。经过60 d的原球状茎培养,获得长有1个叶尖的原球状茎。然后进行假鳞茎诱导和增殖培养200 d,此阶段以6-BA 2.5 mg·L-1+NAA 0.2 mg·L-1的激素配比继代培养效果最佳,增殖倍数达到5.7,台湾独蒜兰组培苗球状茎生长粗壮(表1)。
假鳞茎生根壮苗培养以添加NAA 0.5 mg·L-1+6BA 0.5 mg·L-1+IBA 1.0 mg·L-1+2.4-D 0.01 mg·L-1的培养基生根壮苗的效果最佳,生根率最高,为100%,独蒜兰组培苗生长粗壮(表2)。本研究接种5个台湾独蒜兰蒴果,平均每个蒴果可以得到1 050个含有1个叶片的假鳞茎幼苗,即通过组培条件繁育可以达到快速繁育台湾独蒜兰的目的。
2.2 台湾独蒜兰假鳞茎化学成分分析
通过非靶向代谢组数据分析鉴定出不同单株假鳞茎材料的共有化合物1 229种(图1),包括羧酸及其衍生物236种、苯及取代衍生物110种、有机氧化合物106种、脂肪酰基化合物94种、黄酮类化合物43种、甾体及甾体衍生物42种,其中以化合物1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(C34H46O17)为代表的苄酯类化合物在诸多兰科药用植物假鳞茎中发现,如白及、手参、竹叶兰等[6-8],具有肺A549细胞损伤功效[9]。
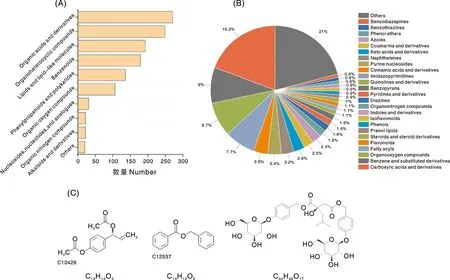
A、B,主要化合物类型组成;C,依据KEGG注释和文献检索确定的苄酯类化合物。A, B, Composition of major compound types; C, Benzyl esters identified according to KEGG annotations and published articles.
鉴于苄酯类化合物为具有近似功效兰科植物所特有的标志性化合物,因此,构建台湾独蒜兰假鳞茎化学成分检测的HPLC检测体系(图2),该体系获得特征峰13个,同时对其代表性物质1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯进行定量分析。以峰面积为纵坐标(y)、对照品质量浓度为横坐标(x)进行线性回归。回归方程为:y=15 409.22x+9.03,R2=0.999 9,在0.034 028~0.136112 μg·mL-1线性关系良好。台湾独蒜兰假鳞茎部位的1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯含量为0.53%±0.01%。
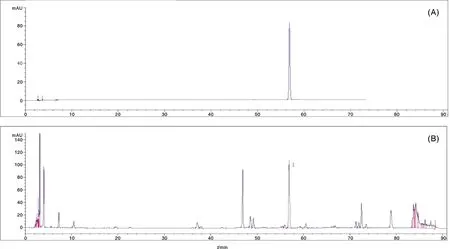
A, 标准品1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯图谱;B,台湾独蒜兰样品图谱。A, Standard 1,4-bis[4-(glucooxy)benzyl]-2-isobutyl malate pattern; B, Atlas of P. formosana samples.
3 讨论
独蒜兰属植物果实为蒴果,透水透气性较差,同时独蒜兰种子细小,无胚乳,种子没有贮藏足够的营养物质,在自然条件下很难萌发成苗,有性繁殖率较低。独蒜兰的组培繁育一般需要经过种子萌发、原球状茎增长、假鳞茎增殖、生根壮苗4个阶段。本研究利用台湾独蒜兰种子进行组培发芽,不需要添加激素,接种2周后种子萌发;其他研究亦发现独蒜兰属植物种子可以在MS、B5、VW等培养基上萌发,萌发率通常高于90%[10]。原球状茎增长、假鳞茎增殖、生根壮苗培养需要激素的干预,在种子萌发形成原球状茎后适当添加6-BA和NAA有利于原球茎的发育和假鳞茎的增殖。陈光芬[11]研究表明,在使用6-BA和NAA的基础上配合使用KT有利于原球状茎的发育;王跃华等[10]研究表明,在假鳞茎诱导培养过程中使用TDZ和KT可以诱导产生丛生苗,后续可以进一步尝试应用苯基噻二唑基脲(TDZ)和激动素(KT)等激素提高台湾独蒜兰的繁殖系数。
目前,国内外对于独蒜兰化学成分的研究主要集中在独蒜兰和云南独蒜兰两种植物,分离鉴定的化合物主要包括菲类、萜类、甾体类和联苄类化合物[2,4-5,12-13],联苄类化合物在兰科植物中分布较多,具有抗肿瘤、降血糖等功效[2]。独蒜兰属植物在世界范围约有33种,我国为该属植物的分布中心,约有29种,其中16种为特有种[14]。诸多近缘的物种与独蒜兰和云南独蒜兰含有近似的化学成分组成[15]。本研究发现,台湾独蒜兰的假鳞茎含有萜类、甾体类和联苄类化合物,表明其可能与同属其他植物具有近似的药理作用。台湾独蒜兰中1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯的含量为0.53%,与已报到的独蒜兰的假鳞茎中的同一物质含量近似。后续实验可以进一步开展药理实验验证独蒜兰属其他植物的药理作用,扩大“冰球子”的入药材料来源,结合快速繁育和人工栽培,缓解药材对于濒危植物的原料需求压力。

