血小板生成素受体激动剂研发进展及安全性特征
刘明霞,韩风生,刘延珍,孙运贝
(1.山东大学,山东 济南 250012;2.山东罗欣药业集团股份有限公司,山东 临沂 276017)
原发免疫性血小板减少症(immune thrombocytopenia,ITP)又称特发性血小板减少性紫癜,是一种复杂的、多种机制共同参与的获得性自身免疫性出血性疾病,以无明确诱因的孤立性外周血血小板计数减少为主要特点,患者常伴或不伴皮肤黏膜出血症状,严重时可因并发颅内出血,严重内脏出血而危及生命,为临床最常见的血小板减少性疾病。ITP 主要发病机制是由于机体对自身抗原的免疫失耐受,导致免疫介导的血小板破坏增多和巨核细胞产生血小板不足。年发病率为(2~10)/10万,目前成人ITP年发病率为(9~20)/10万,60岁以上老年人是高发群体,育龄期女性高于同年龄男性[1]。
阻止血小板过度破坏和促进血小板生成是不可或缺的ITP治疗方法。传统ITP治疗策略包括糖皮质激素(如强的松)、静脉注射免疫球蛋白、脾切除术,以及在治疗难治性ITP时使用免疫调节剂,如达那唑或硫唑嘌呤等,主要通过减轻免疫介导的血小板破坏而达到治疗的目的[2]。但许多患者对这些疗法反应不佳。此外,与治疗相关的副作用和禁忌证限制了上述策略的广泛使用[3]。血小板生成素受体激动剂(thrombopoietin receptor agonist,TPO-RA)是一种新型ITP治疗药物,机理在于刺激血小板生成而非减少破坏,可通过选择性结合于血小板生成素受体,激活TPO-R依赖的STAT和MAPK信号转导通路,刺激巨核细胞增殖和分化,发挥升血小板的作用。TPO-RA的应用为ITP的治疗带来了革命性的突破。
1 TPO-RA类药物分类
血小板生成素(TPO),也称为巨核细胞生长发育因子(MGDF)或血小板生成素受体(c-MpL)的配体,是机体内促进血小板生成最关键的细胞因子。血液循环中的TPO主要由肝细胞合成,少部分由骨髓基质细胞和肾细胞合成,TPO与巨核细胞表面的TPO受体或c-MpL受体结合,并通过触发细胞内信号级联控制巨核细胞生成或血小板生成过程,继而达到提高循环中血小板水平的目的[4-5]。自发现以来,TPO途径一直是血小板减少症相关治疗的重要研究方向。
1.1 第1代TPO-RA类药物第一代的TPO-RA类药物,分别为重组人血小板生成素(recombinant human thrombopoietin,rhTPO)、聚乙二醇化重组人巨核细胞生长发育因子(PEG-rhMGDF)。
rhTPO系利用基因重组技术由中国仓鼠卵巢细胞(CHO)表达,经提纯制成的全长糖基化rhTPO,与内源性TPO具有相同的氨基酸序列。rhTPO与TPO受体的胞外段结合后,引起TPO受体的构象改变,主要通过激活JAK/STAT、RAS/MAPK、PI3K/AKT 3条下游信号通路,刺激多能造血干细胞、巨核祖细胞、多倍体巨核细胞的发育及成熟,促进血小板生成。沈阳三生制药有限公司研制生产的rhTPO于2005年在中国获批上市,商品名:特比澳,临床皮下注射用于治疗实体瘤化疗后所致的血小板减少症以及ITP的辅助治疗。
PEG-rhMGDF系由大肠埃希杆菌表达的非糖基化rhTPO,包含内源性TPO的前163个氨基酸,并与聚乙二醇进行偶联,延长其半衰期[6]。由于Ⅰ/Ⅱ期临床试验发现PEG-rhMGDF给药后可产生中和性抗体,能与内源性TPO发生交叉反应并导致持久性血小板减少,因此中止了PEG-rhMGDF的开发[7]。
由于临床试验结果不佳或免疫原性等不良反应,研发者已基本终止对第1代TPO-RA类药物的研发。国内外对血小板生成素的研发热潮也逐渐转向新型的TPO-RA类药物。
1.2 第2代TPO-RA类药物为了克服第1代TPO-RA类药物的免疫原性,科研人员通过对肽库的回顾分析,寻找能刺激TPO受体但不产生抗体的物质。第2代TPO-RA类药物可与TPO受体结合并激活信号转导,从而导致血小板的增加;且其结构与TPO不同,不会刺激机体产生抗TPO自身抗体;这类药物可以显著升高慢性或持续性ITP 患者血小板水平,降低出血发生率和并发症[2]。第2代TPO-RA类药物主要分为肽类TPO-RA和非肽类TPO-RA两大类。
1.2.1 肽类TPO-RA罗普司亭(Romiplostim)是全球首个获批上市的第2代TPO-RA,为人TPO模拟肽,系采用大肠杆菌表达制备的、由人免疫球蛋白IgG1 Fc结构域通过C-末端与含有2个TPO受体-结合结构域(TRBD)的肽链链接而成,可通过4个TPO拟肽与体内TPO竞争结合TPO受体,使其活化,从而促进血小板生成。该机制类似于内源性TPO,与TPO受体的胞外结构域相结合,并诱导激活JAK-STAT、MAPK信号通路,刺激巨核细胞的增殖和成熟,实现血小板计数增加。其氨基酸序列与内源性TPO不具有同源性,因给予罗普司亭而生成内源性TPO抗体的可能性低,即使生成罗普司亭结合抗体,也不会与内源性TPO结合,进而影响其功能。与Fc恒定区融合则有效延长了其体内半衰期,可每周给药1次,且无饮食禁忌,提高了患者的依从性。
罗普司亭是一种长效TPO-RA,其作用机制优势明显,通过与TPO受体的胞外结构域结合,可全面激活升板信号通路,起效快、应答率高,还延长了半衰期,降低给药频率,提高了患者的依从性,尤其是对于血小板减少,口服的TPO-RA在某些情况下疗效不佳的患者。此外,还具有较好的安全性,有研究证明无论是脾切除或非脾切除的ITP患者,罗普司亭均不增加血栓事件发生率,且具有良好的肝脏安全性。
1.2.2 非肽类TPO-RA非肽类TPO-RA系一种可口服的小分子TPO受体激动剂,与内源性TPO并无序列同源性,对血小板凝集的效应与TPO不同,可选择性结合血小板生成素受体的跨膜结构域,启动信号级联反应,快速提升血小板数量。TPO-RA不与内源性TPO分子竞争结合位点,与内源性TPO具有累加效应。口服TPO-RA具有种属特异性,只与人和黑猩猩的TPO受体跨膜区结合[8]。目前上市的药物有艾曲泊帕乙醇胺片、马来酸阿伐曲泊帕片、芦曲泊帕片、海曲泊帕乙醇胺片。
艾曲泊帕(Eltrombopag)是首个可口服的小分子非肽类TPO-RA,属于联苯腙类化合物,由亲脂性末端、疏水性末端和金属螯合中心组成。艾曲波帕通过与金属离子(Zn2+)和人TPO受体的跨膜结构域相互作用,启动信号级联反应,诱导骨髓祖细胞和巨核细胞的增殖和分化[8]。
艾曲泊帕乙醇胺片[Promacta©/Revolade©(瑞弗兰©),GSK公司)先后于2008年、2009年先后在美国、欧盟上市,2017年进口中国,2015年GSK公司将本品在全球范围内转让给诺华公司,获批适应证:治疗对皮质激素、免疫球蛋白或脾切除反应不充分的持续性或慢性ITP成年患者和1岁及1岁以上儿童患者的血小板减少;治疗慢性丙型肝炎患者的血小板减少(HCVT);与标准免疫抑制治疗联合使用,用于严重再生障碍性贫血(SAA)的成年患者和2岁及2岁以上儿童患者的一线治疗;治疗对免疫抑制治疗缓解不充分的严重再生障碍性贫血患者,每天1次口服用药。艾曲泊帕结构中含有金属离子螯合基团,与抗酸药或含多价阳离子的其他产品合用时会显著降低药物暴露量;且艾曲泊帕的铁螯合作用可以导致组织变色,并可能导致/加剧某些患者的缺铁,尤其是ITP患者,还可能导致其他并发症,如抑制诱导型T细胞细胞因子分泌[9],其用药受到严格的饮食限制。说明书中要求应在以下产品使用前间隔至少2 h或使用后间隔至少4 h服用,包括抗酸药、富含钙(≥50 mg钙)的食物或含有多价阳离子的矿物质补充剂;且不得将本品碾碎后混入食物或液体使用。
马来酸阿伐曲泊帕片:阿伐曲泊帕(Avatrombopag)与人TPO受体的跨膜结构域相互作用,可刺激骨髓祖细胞中巨核细胞的增殖和分化,从而增加血小板的生成。阿伐曲泊帕不与TPO竞争结合TPO受体,在血小板生成上与TPO具有累加效应。
马来酸阿伐曲泊帕片[Doptelet©(苏可欣©),AkaRx Inc公司)于2018年和2019年先后在美国和欧盟上市,2020年进口中国,临床用于择期行诊断性操作或手术的成年慢性肝病患者相关的血小板减少症(CLDT)以及对既往治疗反应不加的ITP患者的血小板减少症。临床口服用药,每天1次、连续口服5 d。阿伐曲泊帕不具有螯合阳离子或铁的潜力,其给药不受饮食限制;与食物同服可以增强阿伐曲泊帕的PK[9]。
芦曲泊帕片:芦曲泊帕(Lusutrombopag)可与表达于巨核细胞上的人TPO受体的跨膜结构域相互作用,从而诱导造血干细胞来源的巨核祖细胞增殖与分化以及巨核细胞成熟。
芦曲泊帕片[Mulpleta©(稳可达©),盐野义制药株式会社]最早于2015年在日本上市,并于2018年和2019年先后于美国和欧盟上市,商品名:Mulpleta©, 2023年进口中国,临床用于计划接收手术的慢性肝病成年患者血小板减少症(CLDT)的治疗,每天1次口服用药,随餐或不随餐。芦曲泊帕末端C链结构不与金属阳离子发生螯合,血药浓度更为稳定,不受饮食状态影响。本品尚未获批用于ITP适应证。
海曲泊帕乙醇胺片:海曲泊帕(Hetrombopag)系我国自主研发的新一代口服、小分子、非肽类TPO-RA,是在艾曲泊帕的基础上改构而成,拟达到提高药效,降低肝毒性的作用。作用机制与TPO相似,在体外试验中,海曲泊帕乙醇胺可促进TPO受体依赖性的32D-MPL细胞株的增殖,促进人脐带血CD34+细胞的增殖和分化。
海曲泊帕乙醇胺片(恒曲©,江苏恒瑞)于2021年在中国获批上市,临床用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,对免疫抑制治疗(IST)疗效不佳的重型再生障碍性贫血(SAA)成人患者。临床每天1次口服用药,海曲泊帕分子结构中均含有金属离子螯合基团,与抗酸药或含多价阳离子的其他产品合用时会显著降低药物暴露量,其用药受到严格的饮食限制。口服2 h后方可进餐,避免与餐同服。非肽类TPO-RA药物均作用于TPO受体的跨膜区域,在信号通路的激活强度方面基本相当。
目前国内外上市用于ITP的非肽类TPO-RA药物有艾曲泊帕乙醇胺片、马来酸阿伐曲泊帕片、海曲泊帕乙醇胺片,均为经口给药,相较于其他需要注射的ITP治疗药物,提高了临床顺应性。艾曲泊帕、海曲泊帕均含有肝毒性基团,临床试验中发现具有肝毒性;海曲泊帕系在艾曲泊帕的基础上改构而成,肝毒性风险相对较低。另外,艾曲泊帕和海曲泊帕都含有酰肼分子结构,应避免与金属离子补充剂同服,需要空腹使用。阿伐曲泊帕引起肝毒性风险低,且可以与食物同服。第2代TPO-RA类药物相关对比详见表1。
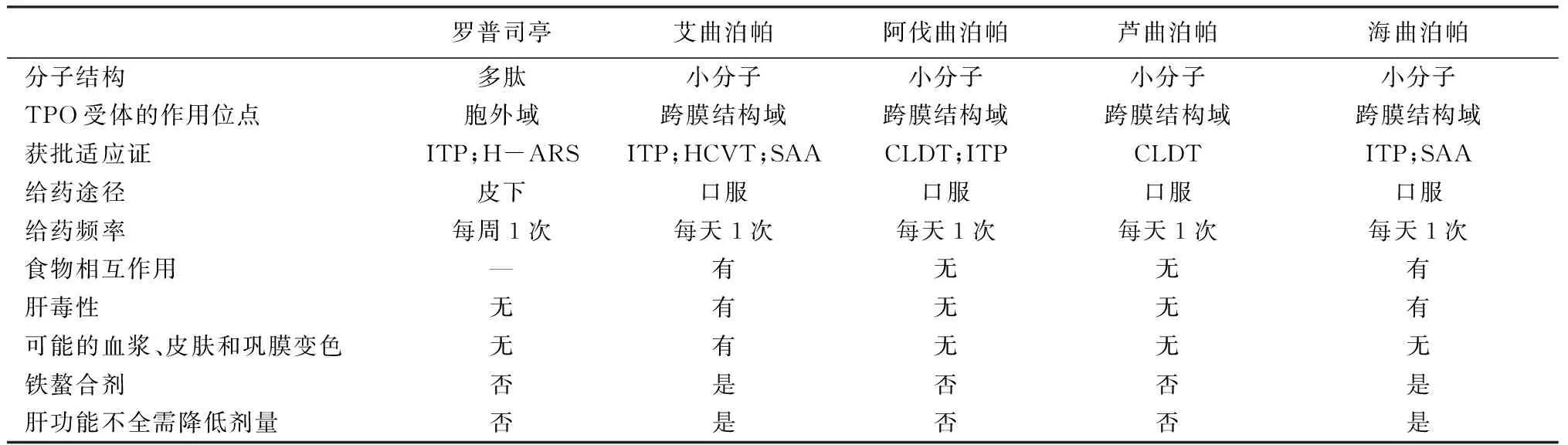
表1 第二代TPO-RA类药物对比[10]
2 研发趋势
2.1 新型TPO-RATPO受体是治疗血小板减少症的主要靶点,除血小板生成素模拟肽Romipostim外,还有新的血小板生成素模拟物相继开发。JNJ-26366821是一种新型聚乙二醇化TPO模拟肽,系两个相同的含14个氨基酸的肽链由赖氨酰残基连接组成,并在每个N-末端连接聚乙二醇(PEG)链。JNJ-26366821与内源性TPO不同源,降低了内源性TPO自身抗体产生以及随后血小板减少的风险。聚乙二醇化延长分子在系统中的半衰期[11-12]。目前已完成健康受试者单次皮下注射给药爬坡试验[13]。
重组人Ⅱ型肿瘤坏死因子受体-Fc-血小板生成素拟肽融合蛋白注射液(代号:SCB-219M、SCB-219)是通过 DNA 重组技术由中国仓鼠卵巢(CHO)细胞表达的融合蛋白,该融合蛋白是人Ⅱ型肿瘤坏死因子受体(TNFRII)结构域与人IgG1 Fc片段的N端融合后,再由Fc片段的C端与3个串联的与罗米司亭一样的TPO拟肽结合形成的同源二聚体糖蛋白,其C端的模拟肽可与TP受体结合,从而激活血小板生成的信息通路,对骨髓巨核细胞生成的各阶段产生刺激作用,从而升高血小板数目。本品于2021年获批肿瘤患者化疗引起的血小板减少症 (CIT)适应证的临床试验,研究者称目前单次皮下注射给药的临床试验中未见严重不良事件 (SAEs)或剂量限制性毒性 (DLT)[14]。
此外还能查到其他非肽类TPO-RA药物(如NIP-004、Butyzamide)和TPO受体激动性抗体(如MA01G4G344)的文献报道[15-17],未见相关临床研究报道。
2.2 仿制药/生物类似药为降低治疗成本,扩大市场竞争以及满足市场需求,许多药企致力于小分子TPO-RA和罗米司亭生物类似药的研发。目前国内已有艾曲泊帕乙醇胺片仿制药已获批上市,已有阿伐曲泊帕片、芦曲泊帕片仿制药申报上市,正在审评中。Biolotus研发的罗普司亭生物类似药于2015年在巴西上市,目前国内尚无罗普司亭生物类似药获批上市,齐鲁制药研发的同品种(研发代号:QL0911)正在上市申报中,另外2家获批临床试验。
目前,该类药物的研发进展较慢,还是集中在已知作用靶点和作用机制上开发,范围较局限。进一步研究ITP 的发病机制,发现新的治疗靶点,对于开发提高ITP患者的依从性,降低不良反应的新药至关重要。
3 安全性特点
TPO-RA在临床治疗中的药物相关的严重不良事件(AE)有血栓事件、骨髓纤维化、肝功能异常、白内障等。
3.1 血栓形成/血栓栓塞并发症血小板计数高于正常范围时,理论上存在血栓形成/血栓栓塞并发症风险。研究结果表明,与未接受TPO-RA治疗的ITP患者相比,接受 TPO-RA治疗的ITP患者血栓形成的可能性更高[18]。ITP患者血栓形成的风险是多因素的,ITP相关因素包括未成熟过度活跃的血小板、循环巨核细胞(MKs)、凝血酶原微粒水平的增加,von Willebrand因子活性改变,以及自身抗体对内皮表面的可能影响。个体风险因素(肥胖、糖尿病治疗、高胆固醇血症治疗、动脉高血压治疗、吸烟、房颤、瓣膜病、冠状动脉疾病)与ITP的固有血栓形成性之间存在复杂的相互作用。TPO-RA 治疗可能会进一步调节这些相互作用[19-20]。在已上市药物TPO-RA药物中均可见血栓形成/血栓栓塞并发症不良反应,文献报道血小板计数与血栓形成风险之间没有明确关联,在ITP患者中开展的艾曲泊帕乙醇胺临床试验显示,血小板计数低和正常时也观察到血栓事件发生[21]。
TPO-RA的使用的一个关注点是诱发血小板增多和增加血栓形成风险的潜力。因此,TPO-RA治疗的目标不是使血小板计数恢复正常,而是仅达到止血水平。临床使用中定期监测血小板数值尤为重要,必要时采取抗凝或者抗血小板治疗。
3.2 骨髓网状蛋白形成和纤维化TPO-RA 所致血液系统 ADR 主要临床表现为骨髓纤维化。TPO途径促进骨髓中巨核细胞的增殖,骨髓中增大的巨核细胞密度可能会增加骨髓网状蛋白水平,导致骨髓纤维化。长期服用罗普司亭、艾曲泊帕、海曲泊帕可能会增加骨髓中网硬蛋白纤维形成和发展的风险,该风险与TPO-RA的相关性尚未被确定。有研究表明,在TPO-RA治疗长达 2 年的时间里,大多数患者仍然存在轻度骨髓网状蛋白纤维化,这些结果可能反映了由TPO-RA修饰的自身免疫引起的骨髓损伤[22]。
3.3 肝毒性肝毒性是艾曲泊帕及海曲泊帕较常见的不良反应,可引起肝胆实验室检查异常、严重肝毒性和潜在致命性肝损伤。ITP受试者接受艾曲泊帕或海曲泊帕治疗的临床研究中主要表现为ALT、AST及间接胆红素升高。亚洲人种多见,大多为轻度,无临床症状,停药后可恢复。但对伴有肝脏基础疾病的人群,可能会加重危及生命的肝毒性风险,使用过程中应监测患者肝功能并适时调整用药。阿伐曲泊帕(噻唑衍生物)因结构和艾曲泊帕(偶氮苯衍生物)存在明显不同,既往研究及上市后安全性监测方面均未发现肝毒性,对于合并肝损伤患者可作为优选。
3.4 白内障在啮齿动物的艾曲泊帕乙醇胺毒理学研究中观察到白内障。艾曲泊帕乙醇胺、海曲泊帕针对成年慢性ITP患者的临床研究中均观察到受试者用药后新发白内障或白内障恶化,说明书建议在使用本品前进行白内障检查并在用药过程中进行规律监测。尚不明确药物导致白内障的毒性机制。
3.5 克隆演变或进展风险TPO-RA是促进产血小板祖细胞扩增、分化和促进血小板生成的生长因子。TPO-R主要在髓系细胞表面表达。TPO-RA能刺激干细胞,也可能刺激增生不良骨髓中的干细胞或白血病干细胞,从而导致或加速患者的克隆演变,并最终进展为骨髓增生异常综合征(MDS)或急性髓细胞白血病(AML)。在罗普司亭治疗MDS患者的成人临床研究中,报告了进展为AML的病例,另外,还观察到了原始细胞计数一过性增加的病例。在一项MDS伴血小板减少症患者中开展的阿扎胞苷与艾曲泊帕或安慰剂联合用药临床试验因无效和MDS进展(包括AML)增加而终止。TPO-RA是否促进恶性克隆增生或克隆演化尚无定论。
TPO-RA所致ADR累及多个系统/器官,以循环系统、血液系统为主,临床表现为动/静脉血栓、骨髓纤维化等。临床使用中,不仅要关注其有效性,更应关注其安全性,还需根据患者疾病特征选择相对安全的 TPO-RA,确保患者用药安全。
4 小结
ITP一线治疗药物有一定的疗效及安全性,但仍存在一些局限性,主要表现在长期疗效不佳,TPO-RA 药物为ITP的治疗带来了革命性的突破。目前已有多个药物获批上市,主要用于一线治疗无效或不耐受的ITP患者,此类药物具有起效迅速,应答率高、疗效持久和使用便捷等特点,国内外指南对于TPO-RA的推荐地位日渐提升。但在临床应用中发现多个严重不良反应,包括动/静脉血栓、骨髓纤维化等,具体毒性机制和/或相关性尚需进一步研究确认。需要强调的是不同TPO-RA的安全性风险存在差异,应根据患者具体情况选择合适的药物。此外进一步研究ITP 的发病机制,发现新的治疗靶点,对于开发可提高ITP患者的相应性,降低不良反应的新药至关重要。

