二氢杨梅素结构修饰及生物活性研究进展
吴 聪,王文茂,彭彩云,2*,盛文兵,2*
1湖南中医药大学 药学院;2湖南中医药大学 中医药民族医药创新发展国际实验室,长沙 410208;3湖南乾坤生物科技有限公司 张家界莓茶工程技术研究中心,张家界427000
二氢杨梅素(dihydromyricetin,DHM,见图1)是显齿蛇葡萄(AmpelopsisgrossedentataW.T.Wang)中最主要的黄酮类成分,约占其嫩芽干重30%[1],具有抗氧化[2]、抗炎[3]、抗病毒[4]、抗癌[5]、抗菌[6]、抗疲劳[7]、抗焦虑[8]、降糖[9]、保肝护肝[10,11]、心脏保护[12]、缓解阿尔茨海默病[13]和缓解哮喘[14]等作用。DHM安全性良好,对大鼠与小鼠进行了DHM的急性口服毒性试验[15]、长期毒性试验[16]和基因毒性试验[17],结果均为阴性。
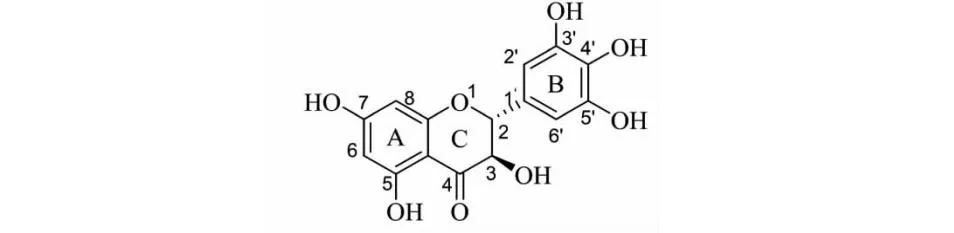
图1 二氢杨梅素化学结构Fig.1 The chemical structure of dihydromyricetin
DHM的稳定性明显弱于其他黄酮类化合物,因为其具有6个羟基,特别是B环的羟基容易氧化。pH≥9、高温及光照均可加速DHM氧化,从而极大限制了其应用[18]。DHM在25 ℃水中的溶解度为263.54 mg/L,加热可以提高其水溶性[19]。在模拟消化系统中,当pH值为6.8时DHM出现伪一级动力学降解成非黄酮类化合物。此外,pH被认为是DHM在胃肠道中稳定性较差的根本原因,从而导致其生物利用度较差[20,21]。为了提高其抗肿瘤、抗菌、抗病毒、抗炎、抗氧化和神经保护等活性,科研人员对DHM展开了大量实验研究,并取得了一定的研究成果。本文从结构修饰和生物活性等方面展开综述,并且提出二氢杨梅素结构修饰过程中存在的问题及发展方向,为更好地开发二氢杨梅素衍生物提供技术服务。
1 化学修饰及其相关生物活性
由于DHM在常温下易氧化成黄酮醇和查尔酮类化合物[18],导致稳定性不好;在模拟肠液中表观油水分布系数为0.93[22],表明在小肠中不易吸收[23];在大鼠口服DHM实验中,绝对生物利用度仅为0.122%,说明只有极少部分能进入体循环[22]。上述实验结果表明,需要对DHM进行化学结构修饰,进一步提高DHM的生物活性。
1.1 DHM结构修饰与抑制病毒活性研究
1.1.1 3-OH位酰化修饰及抑制乙肝病毒DNA复制
Zhang等[24]合成了一系列含硝酸酯基DHM衍生物1~9(见图2),先保护或部分保护DHM酚羟基,后主要在C-3位醇羟基进行酯化修饰。在对HepG2细胞中的乙肝病毒DNA抑制活性实验显示,其中化合物3、5和7的IC50与阳性对照药拉米夫定接近,这三个化合物对乙肝病毒DNA的IC50分别为1.48、1.62和1.76 μmol/L,化合物3和5在80 μg/mL剂量下对乙肝病毒DNA抑制率分别为85.7、81.5%。构效关系表明,通过乙酰化或甲基化保护DHM的部分酚羟基,保留C-3位醇羟基接入活性基团硝酸类化合物,脂溶性有所提高,生物活性有明显提升。
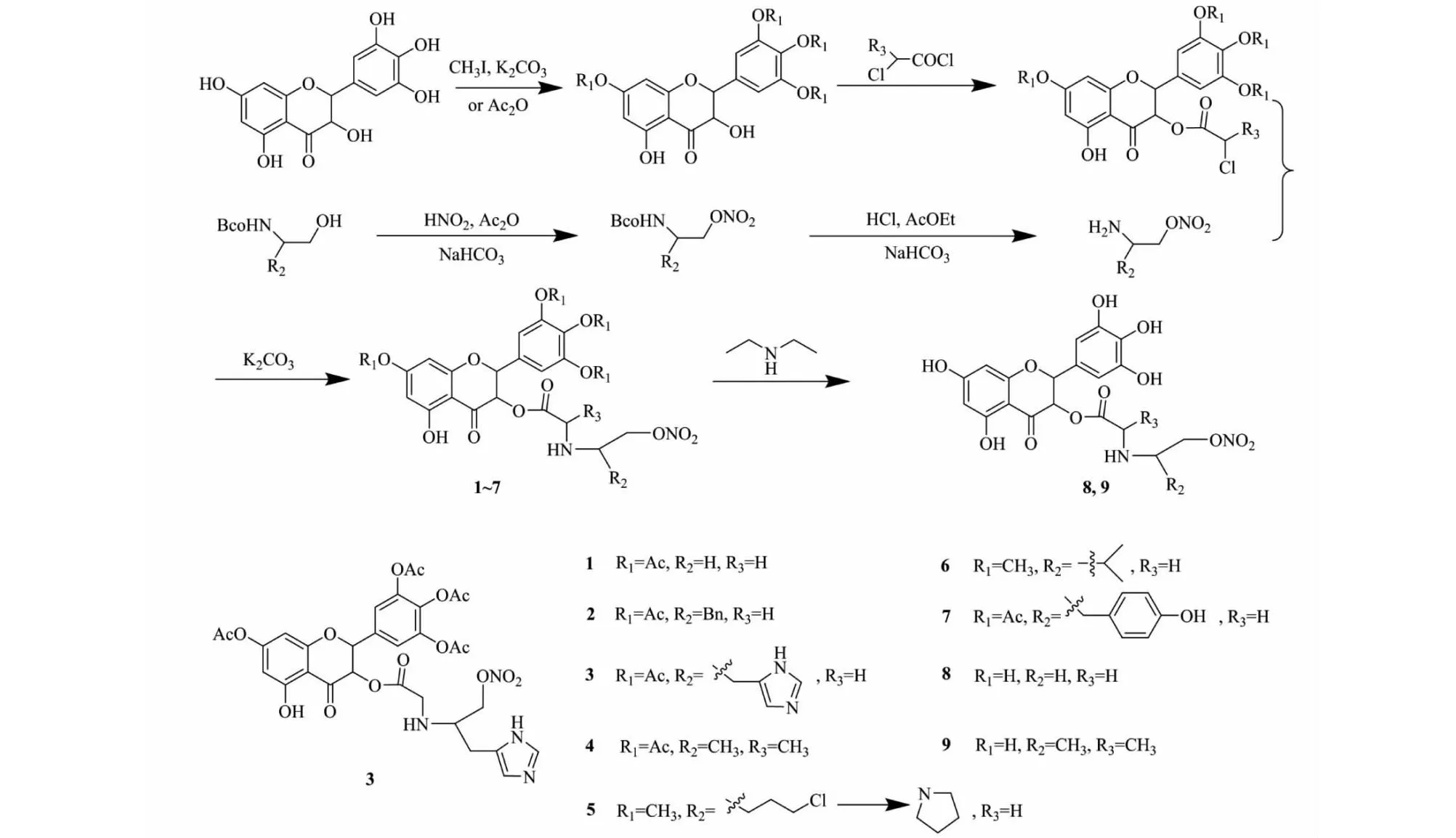
图2 二氢杨梅素衍生物1~9的合成路线Fig.2 Synthetic route of dihydromyricetin derivatives 1-9
1.1.2 7-OH烷基化或磷酰化修饰及抑制新冠病毒3CLpro表达
随着新冠病毒(SARS-CoV-2)引起的新冠肺炎(COVID-19)大流行,科研工作者努力寻找相关治疗药物。Su等[4]将DHM与硫酸二甲酯反应生成化合物10,与磷酸类物质反应生成化合物11,实验表明化合物10、11(见图3)对SARS-CoV-2抑制活性高于DHM,且对SARS-CoV-2 3CLpro的抑制活性明显强于DHM。针对SARS-CoV-2 3CLpro,化合物10、11的IC50值分别为0.26±0.02、1.84±0.22 μmol/L,对SARS-CoV-2细胞,化合物10、11的EC50值为11.50±4.57、9.03±1.36 μmol/L。化合物10表现出良好的抑制SARS-CoV-2 3CLpro活性[4],但由于其亲脂性较低,较难通过细胞膜,在SARS-CoV-2 细胞活性实验中结果并不如意。构效关系表明,改变7位羟基成酯基团大小且保留连苯三酚结构可以不同程度地抑制SARS-CoV-2 3CLpro。
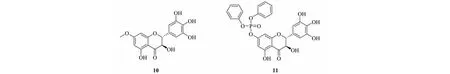
图3 二氢杨梅素衍生物10、11的化学结构Fig.3 Structure of dihydromyricetin derivatives 10 and 11
1.1.3 7-OH烷基化修饰及抑制艾滋病病毒复制
研究报道,一些类黄酮化合物已经被证明具有抗艾滋病病毒活性,表明黄酮对HIV-1整合酶有抑制作用,说明黄酮类化合物具有潜在抑制HIV-1活性[25]。Zhang等[26]通过先保护DHM部分羟基,应用威廉姆森醚合成法在C-7位羟基上引入β-溴乙基,然后与三氮唑类化合物发生亲核反应,最后三氮唑类化合物上的羧基发生酯化反应合成了化合物12~21(见图4),并对其进行了抗HIV-1活性测试,剂量为0.30 μg/mL,化合物12、13、14、16、18和19对HIV-1抑制效果接近80%,表明衍生物中游离羟基数量对抗HIV-1活性无明显影响。
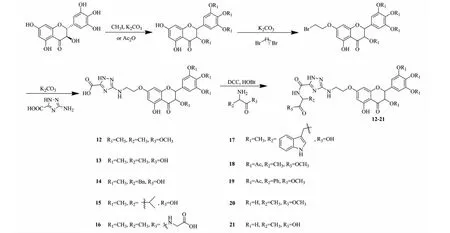
图4 二氢杨梅素活性衍生物12~21的合成路线Fig.4 Synthetic route of dihydromyricetin active derivatives 12-21
1.2 DHM结构修饰与抗肿瘤活性研究
1.2.1 3-OH位酰化修饰及逆转多药耐药人乳腺癌细胞株
Wong等[27]先将5个酚羟基甲基化,再对C-3位羟基进行酯化修饰,合成了5,7,3′,4′,5′-五甲氧基DHM衍生物22~33(见图5),并对这些衍生物逆转P-糖蛋白介导的多药耐药人乳腺癌细胞株的抑制活性进行了评价,结果表明仅有部分化合物表现出良好的活性。紫杉醇能有效抑制人乳腺癌细胞株(IC50为1.6±0.3 nmol/L),而在治疗过程中容易产生耐药性,紫杉醇对多药耐药人乳腺癌细胞株IC50为144.6±9.4 nmol/L。其中化合物30逆转活性最突出,在紫杉醇中加入1.0 μmol/L的化合物30后,对多药耐药人乳腺癌细胞株IC50为9.4±1.6 nmol/L。构效关系分析发现[28]:增长C-3位成酯的长度可增加衍生物的逆转活性,尤其是引入N原子后的衍生物能明显抑制P-糖蛋白,从而提高逆转活性。甲基化DHM衍生物对多药耐药肿瘤细胞有不错的逆转能力,有望成为逆转多药耐药肿瘤细胞的候选药物。
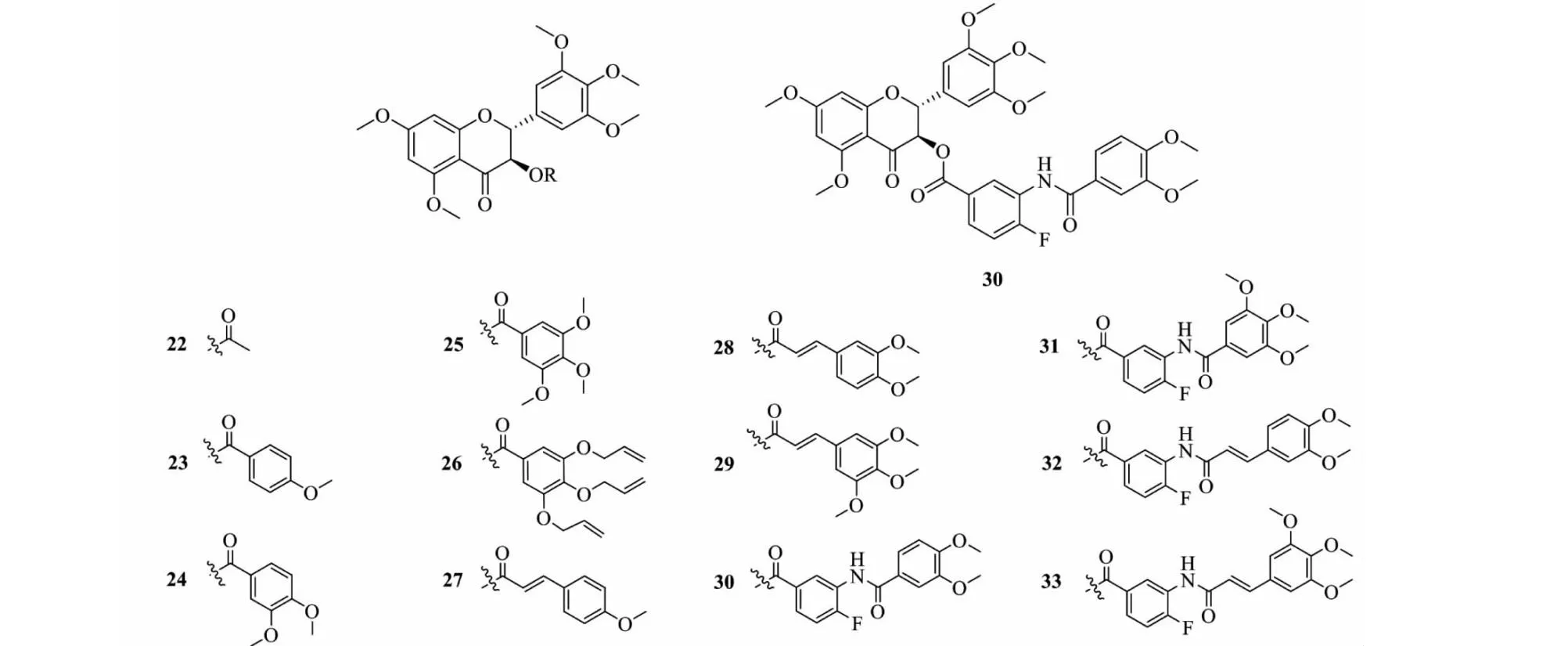
图5 二氢杨梅素衍生物22~33的结构Fig.5 Structure of dihydromyricetin derivatives 22-33
1.2.2 C-8位氨化修饰及抑制骨巨细胞瘤细胞增殖
针对骨巨细胞瘤细胞,二膦酸类化合物是一类有效抗异动力和抗痛觉过敏药物,同时对参与肿瘤形成的基质金属酶和含半胱氨酸的天门冬氨酸特异蛋白酶家族具有双靶向抑制作用,还能有效的抑制骨转移[29]。利用拼接原理把DHM和二膦酸类化合物拼接起来,可能成为新的抗骨巨细胞瘤候选药物。Zhang等[30]用甲基化DHM与二膦酸类化合物连接得化合物34~38(见图6),对骨巨细胞瘤细胞显示出显著的抑制效果。化合物34~38在200 nmol/L剂量下抑制率均优于阿仑膦酸钠。构效关系表明,DHM与二膦酸类化合物拼接效果显著,且游离羟基数量并不明显影响衍生物对骨巨细胞瘤细胞抑制活性。
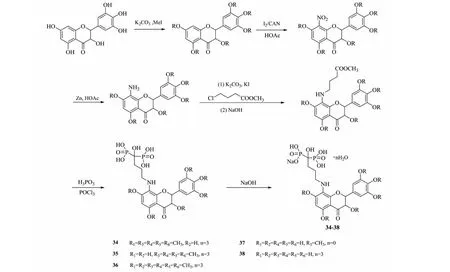
图6 二氢杨梅素活性衍生物34~38的合成路线Fig.6 Synthetic route of dihydromyricetin active derivatives 34-38
1.2.3 7-OH和C-8位环化修饰及抑制小鼠肝癌细胞增殖
Zhang等[31]基于以上对DHM结构修饰研究基础,首先将DHM转变为四甲基或四乙酰基DHM,再在C-8位引入硝基,还原,然后在7-OH引入酰基,最后利用羰基与氨基反应形成噁唑环,得到化合物39~47(见图7)。在小鼠肝癌(H22)模型实验中所得化合物显示出较强活性,在20 mg/(kg·d)剂量下化合物39、41、44、45抑制效果优于环磷酰胺,而化合物40、42、43、46、47抑制效果接近环磷酰胺,同时,实验表明衍生物中增加F原子对活性无明显影响。
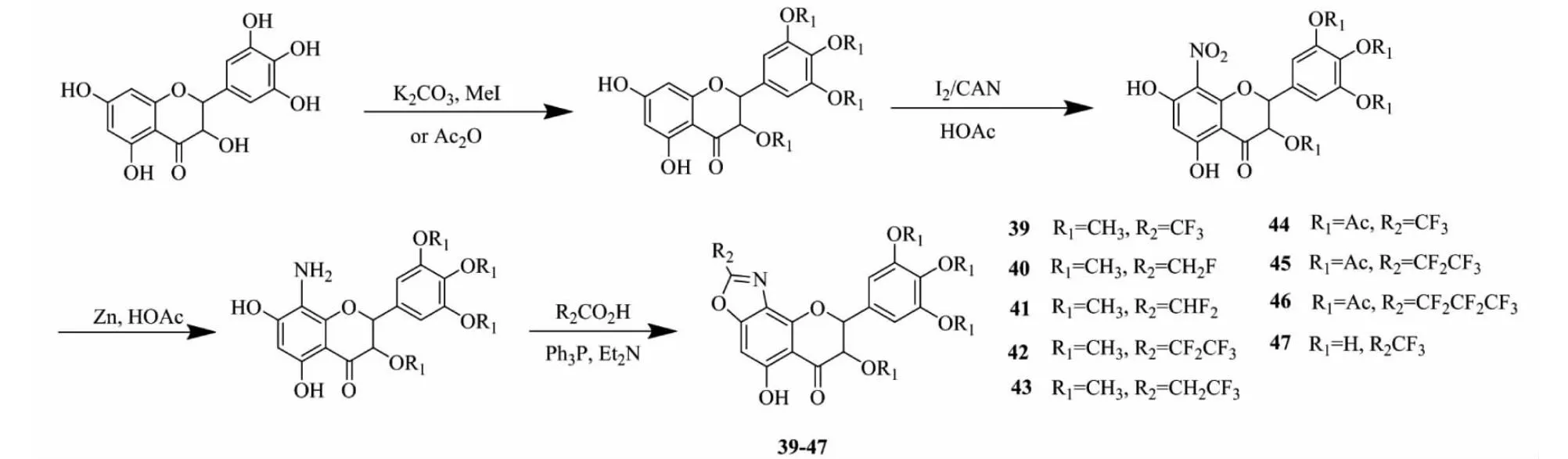
图7 二氢杨梅素活性衍生物39~47的合成路线Fig.7 Synthetic route of dihydromyricetin active derivatives 39-47
1.2.4 多位点修饰及广谱抗肿瘤增殖
Zhang等[32]在DHM部分羟基保护后,通过在C-8位引入硝基、还原,再通过亲核反应增长碳链,最后通过醚化反应与环磷酰胺化合物连接合成了化合物48~55(见图8)。修饰后产物对HL60、SGC-S03、MCF-7、HepG2、HeLa等5种肿瘤细胞进行体外实验。化合物48~55对5种常见肿瘤细胞抑制活性均优于阳性对照药5-氟尿嘧啶,其中化合物48、54、55抑制肿瘤细胞效果最好。化合物48对HL60细胞、SGC-S03细胞的IC50值分别为0.89、13.51 μg/mL;化合物54对HL60细胞、MCF-7细胞、HepG2细胞的IC50值分别为0.71、1.87、24.41 μg/mL;化合物55对HL60细胞、HeLa细胞的IC50值分别为0.57、4.81 μg/mL。表明DHM与环磷酰胺形成孪药,可以明显提高DHM的抗肿瘤活性。
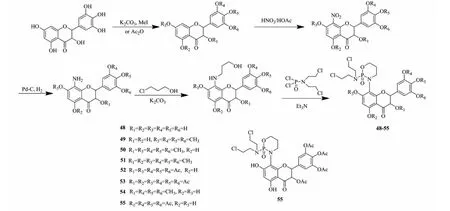
图8 二氢杨梅素衍生物48~55的合成路线Fig.8 Synthetic route of dihydromyricetin derivatives 48-55
Shi等[33]在甲基化或乙酰化DHM基础上引入卤素原子,目的是增大脂溶性,靶向性及细胞通透性。通过改变卤素原子位置,甲基或乙酰基数量或位置,合成了一系列含卤素的DHM衍生物56~63(见图9),DHM与硝酸铈铵反应在C-8位直接引入硝基生成化合物64(见图9)。就抑制HL-60、SGC-7901、SW-79、HT-29细胞而言,大部分衍生物都比临床应用的5-氟尿嘧啶活性强。化合物56、62分别对HL-60细胞的抑制活性(2.97、2.27 μmol/L)约是5-氟尿嘧啶的5倍(13.02 μmol/L);化合物60对HT-29细胞的抑制活性(1.87 μmol/L)也约为5-氟尿嘧啶的5倍(9.33 μmol/L);化合物56~63对SGC-7901、SW-79细胞具有中等抑制活性,约是5-氟尿嘧啶的2倍。构效分析表明:在DHM部分羟基保护后,在A环引入卤素原子会明显增强抗肿瘤活性。
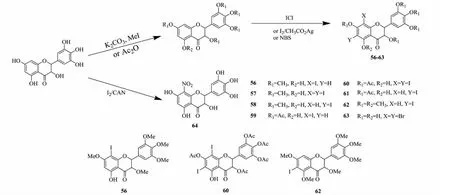
图9 二氢杨梅素衍生物56~64的合成路线Fig.9 Synthetic route of dihydromyricetin derivatives 56-64
Xu等[34]把DHM与庚酰氯发生反应生成化合物65(见图10);与对羟基香豆酸和咖啡酸发生酯化反应生成化合物66和67(见图10)。在多种常见肿瘤细胞的体外实验中,化合物65对MCF-7细胞的IC50值为21.57±0.21 μmol/L,与阳性对照药物10-羟基喜树碱效果相当;化合物67对人白血病细胞的IC50值为23.19±1.47 μmol/L,比10-羟基喜树碱效果稍好;在正常细胞体外实验中,化合物66对正常细胞无明显凋亡,10-羟基喜树碱对正常细胞IC50值为6.7±1.55 μmol/L,表明DHM的多羟基酯化产物仍然具有良好的安全性,且抗肿瘤活性有一定的提升。
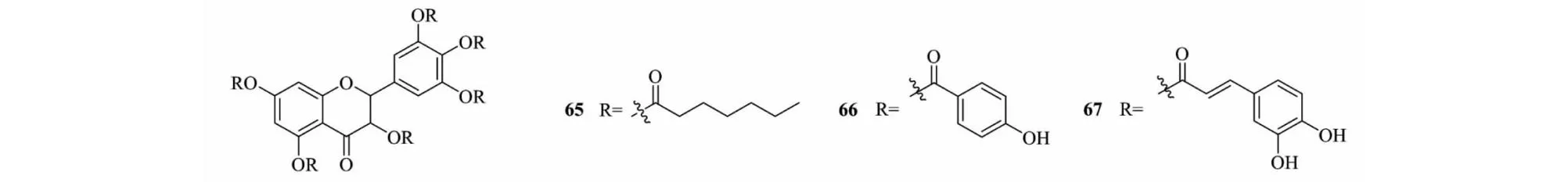
图10 二氢杨梅素衍生物65~67的化学结构Fig.10 Chemical structure of dihydromyricetin derivatives 65-67
1.3 DHM结构修饰及抗菌活性研究
DHM可以通过破坏细胞壁,从而达到抑制细菌生长[35]。科研人员对DHM抗菌修饰做了大量研究,开发了一系列有意义的DHM衍生物。
1.3.1 7-OH或C-8位修饰
Shi等[36]通过多步反应在DHM C-8位引入三唑磺酰基类化合物,合成化合物68~75(见图11)。并对金黄色葡萄球菌、福氏志贺菌、奇异变形杆菌、铜绿假单胞菌、大肠杆菌、乙型副伤寒沙门氏菌、肺炎克雷伯菌、枯草芽孢杆菌和副溶血性弧菌等9种细菌进行了体外实验,结果表明化合物68~75对这9种常见细菌大部分最低抑菌活性比DHM提升了近 100倍(见图12)。化合物74和75对多种细菌都表现出较强抑菌效果,对比其他衍生物,其结构特点是5个羟基均去除了保护,由此表明5个羟基在抑菌过程中发挥不可缺少作用。在针对抗菌活性的结构修饰过程中,保留多个酚羟基是个不错的选择。
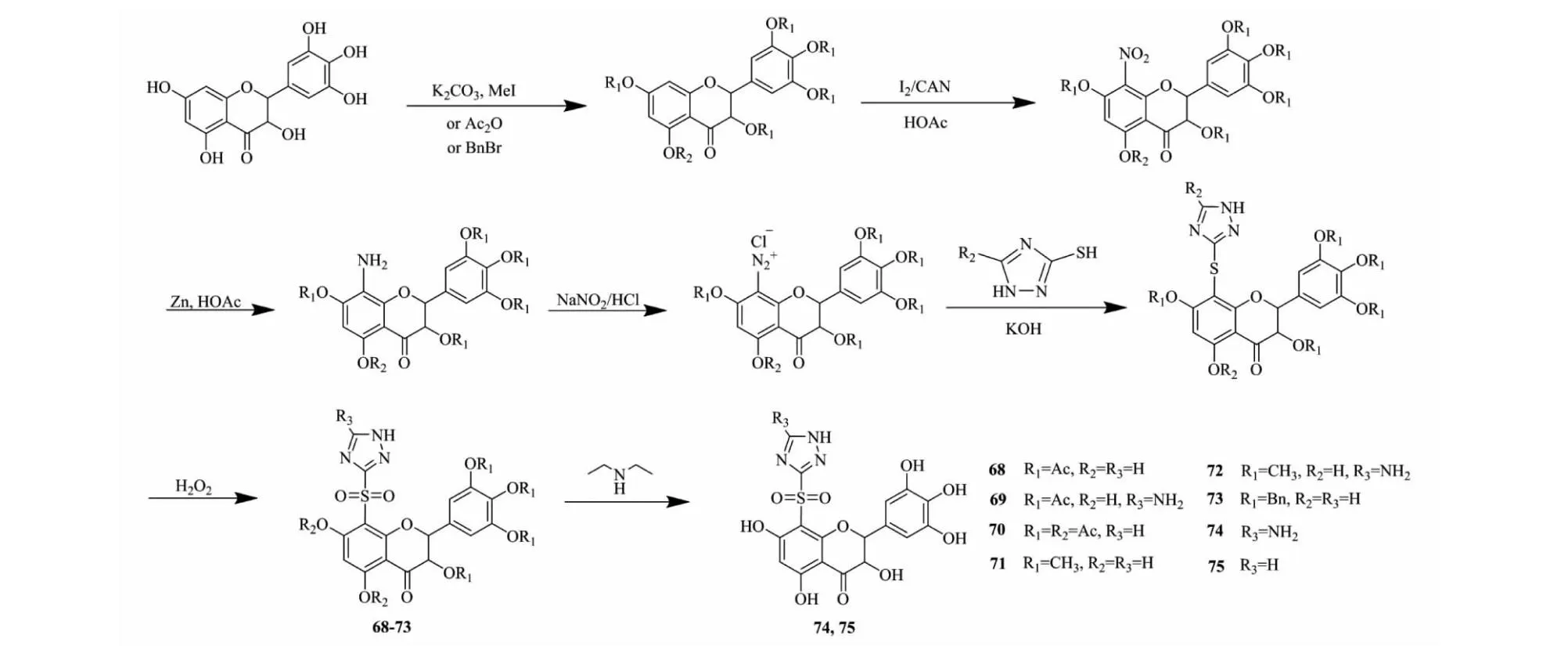
图11 二氢杨梅素活性衍生物68~75的合成路线Fig.11 Synthetic route of dihydromyricetin active derivatives 68-75
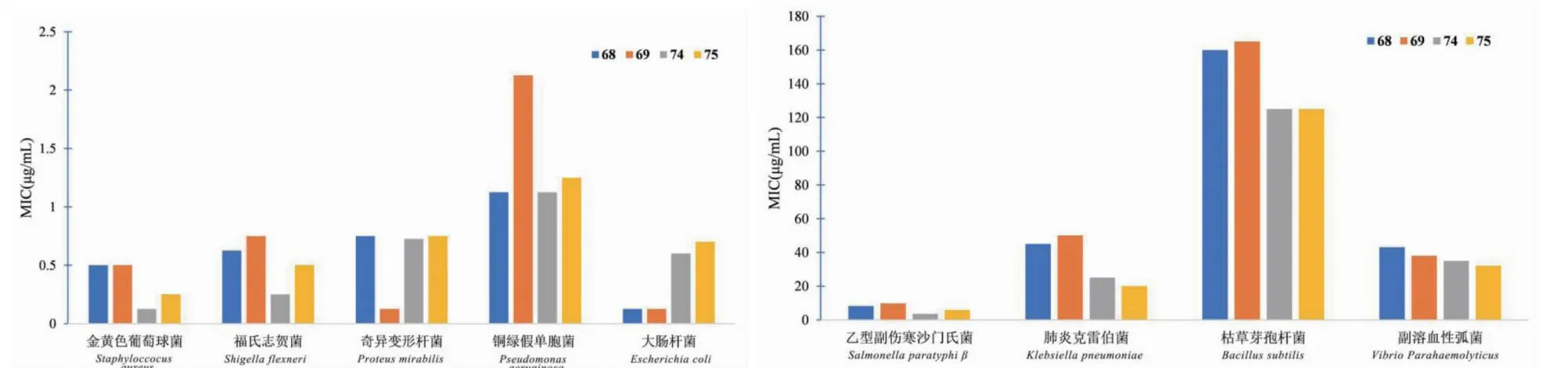
图12 二氢杨梅素衍生物68、69、74和75的最小抑菌浓度Fig.12 MIC of dihydromyricetin derivatives 68,69,74 and 75
Xiao等[37]首次以DNA旋转酶和抑制外排泵为设计方向,设计并合成了96个多靶点黄酮-喹啉酮类化合物,其中有6个是DHM衍生物即化合物76~81(见图13)。并对表皮葡萄球菌、肺炎克雷伯菌和新型隐球菌做了体外抑菌实验,结果表明化合物78和81不仅显示出良好的抑菌活性,而且具有对DNA旋转酶和外排泵双重抑制作用,说明这类衍生物具有多靶点抑菌活性。化合物78的抑菌效果超过阳性对照药,对表皮葡萄球菌的MIC50值为0.73 μg/mL,阳性对照药卡拉霉素MIC50值为1.1 μg/mL;对肺炎克雷伯菌的MIC50值为0.38 μg/mL,阳性对照药青霉素G MIC50值为0.62 μg/mL;对新型隐球菌的MIC50值为0.91 μg/mL,阳性对照药酮康唑MIC50值为1.3 μg/mL。DHM的喹啉酮类衍生物有很强的抗菌效果,MIC50接近或超过阳性对照药,表明喹啉酮类是一类很好抗菌活性基团,化合物78具备发展成新药的潜力。
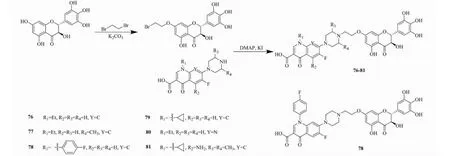
图13 二氢杨梅素衍生物76~81的合成路线Fig.13 Synthetic route of dihydromyricetin derivatives 76-81
1.3.2 多羟基酰化修饰
Yan等[38]把不同结构的羧酸与DHM酯化分别得到化合物82~86(见图14),并对大肠杆菌、金黄色葡萄球菌、酿酒酵母和黑曲霉等四种细菌进行了体外抑菌实验,实验结果显示化合物82和85对大肠杆菌抑制效果一般;化合物85和86对金黄色葡萄球菌有中等抑制效果,MIC50均为0.062 5 g/L;化合物84对酿酒酵母抑制效果不显著;这五种化合物对黑曲霉均无明显抑制效果。
Matsumoto等[39]研究了黄芩中主要抗真菌物质是DHM,并合成了甲基化DHM化合物87、90~95(见图14),化合物88和89(见图14)是从植物中分离得到,他们试图寻找其构效关系。通过开展草本枝孢菌活性实验,发现化合物87、88、90和92的抗真菌活性是DHM的2~4倍,表明化合物的立体结构、官能团的位置对抗真菌活性有较大的影响。
1.4 DHM结构修饰及抗氧化活性研究
DHM酯类衍生物可以提高其脂溶性和稳定性。Li等[40]合成了DHM十二酸酯(化合物98,见图15),实验表明,在相同的浓度下,随着酯化度逐步增多,清除自由基能力逐步减少;通过量子化学计算分析可知,DHM结构中的6个羟基发生酯化反应的活性顺序为 3-OH>4′-OH>5′-OH>5-OH>3′-OH>7-OH。通过分子脱氢后的生成热与分子总生成热之差(△HOF),抗氧化能力的强弱为4′-OH≈5′-OH>3′-OH>7-OH>5-OH>3-OH。表明 DHM 酯化衍生物设计时选择3-OH并保留其他酚羟基,不仅能最大限度保留抗氧化能力,而且还能提高脂溶性。
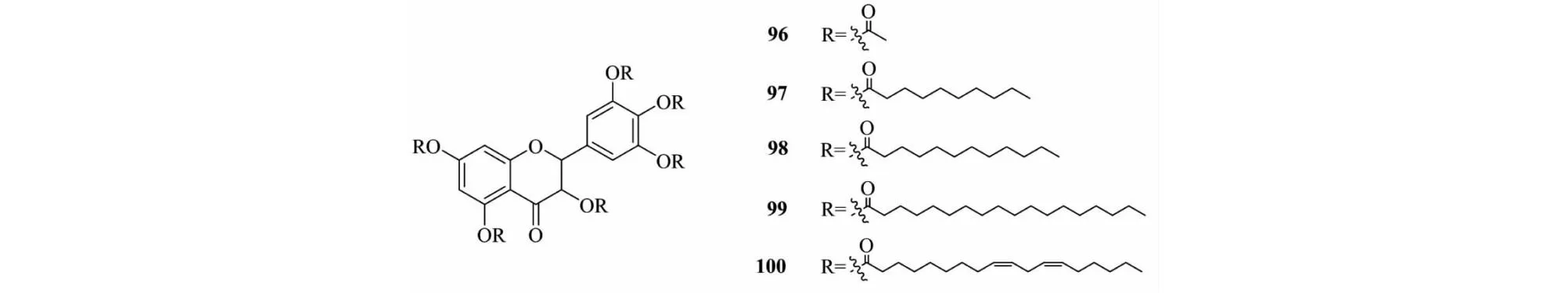
图15 二氢杨梅素衍生物96~100的化学结构Fig.15 Chemical structure of dihydromyricetin derivatives 96-100
Guo等[41]将乙酸酐和DHM按不同比例进行反应(化合物96,见图14),得DHM单酯化物与多酯化物(图15),多酯化衍生物脂溶性大于单酯化衍生物,但DHM过量酯化会降低其抗氧化活性,而且热稳定性也会降低,因此酯化程度以中等适宜。
Wu等[42]合成了DHM癸酸酯(化合物97,见图15),并比较了不同酯化度的抗氧化活性,结果表明酯化度为 3 的产品在猪油中的抗氧化性比其他酯化度DHM癸酸酯较好。
Zhang等[43]合成了DHM硬脂酸酯(化合物99,见图15),抗氧化实验表明:0.05%的DHM硬脂酸酯与0.02%叔丁基对苯二酚(TBHQ)抗氧化作用相当。
Meng等[44]研究了火麻油的抗氧化能力,先将亚油酸与PCl3反应成亚麻酰氯,再与DHM反应生成DHM亚油酸酯(化合物100,见图15)。实验表明,火麻油不加抗氧化剂室温保存不足2个月,添加0.05%DHM后火麻油室温保存延长至6个月,添加0.05%DHM亚油酸酯,火麻油室温保存则达到了20个月,DHM亚油酸酯的抗氧化性显著增加。
1.5 DHM结构修饰及调节血糖研究
NO是重要的信使物质,与糖尿病人动脉粥样硬化并发症的发展有关,影响胰岛素介导的葡萄糖代谢,有望成为抗高血压与抗糖尿病并发症靶向物质[45]。1,2,5-噁二唑-2-氧化物是一类NO供体,具有抑制血小板聚集和血管扩张活性,能与多种药物拼接来增强药理活性[46]。Shi 等[47]在DHM部分羟基乙酰化后与1,2,5-噁二唑-2-氧化物连接,合成了化合物101~110(见图16)。并研究了该类衍生物对大鼠血清葡萄糖和胆固醇的影响:治疗前血清葡萄糖和胆固醇含量分别平均在18.0 mmol/L和7.0 mmol/L;经一线降糖药优降糖20 mg/kg治疗后,血清葡萄糖含量降至4.61±3.440 mmol/L,胆固醇含量降至2.72±0.14 mmol/L,也在同等剂量20 mg/kg下,衍生物101、102、104、107、108治疗后血清葡萄糖含量降至3.0~5.0 mmol/L,胆固醇含量降至2.0~4.0 mmol/L,表明化合物101、102、104、107和108具有良好的降血糖和降胆固醇能力。
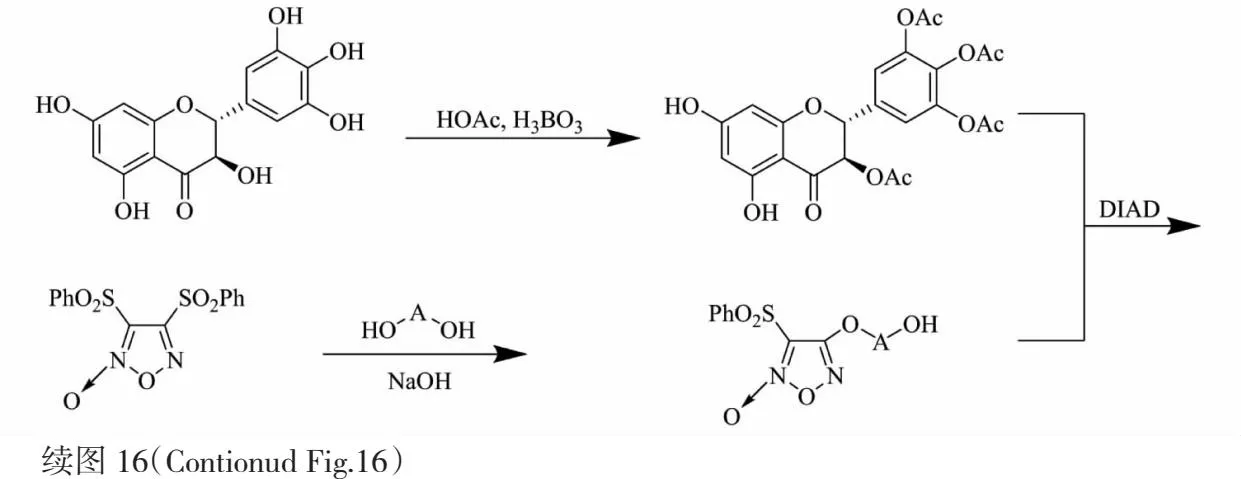
图16 二氢杨梅素活性衍生物101~110的合成路线Fig.16 Synthetic route of dihydromyricetin active derivatives 101-110
1.6 DHM结构修饰及神经保护研究
Liang等[48]把DHM与哌啶制备成化合物111(见图17),发现化合物111对阿尔茨海默病以及某些退行性疾病有良好的治疗效果。又以2,4,6-三羟基苯乙酮为初始原料经过4步反应全合成DHM,然后把DHM与四氢吡咯反应生成DHM四氢吡咯复合物[49](化合物112,见图18),发现化合物112对神经系统功能障碍疾病具有特殊疗效,也可用于治疗苯二氮唑类成瘾性。与DHM相比较,化合物112的药效和生物利用度得到很大提升,对免疫细胞A型受体GABAARs的作用效果是DHM的1 000倍,其浓度为0.1 nmol/L以上时具有显著效果且呈浓度依赖性,同时表现出良好的安全性,在对大鼠的短期用药和长期评价中,无明显毒副作用。化合物112对神经系统功能障碍疾病有优良的生物活性和良好的生物安全性,相信在不久的将来会成为治疗神经类疾病的原创药。
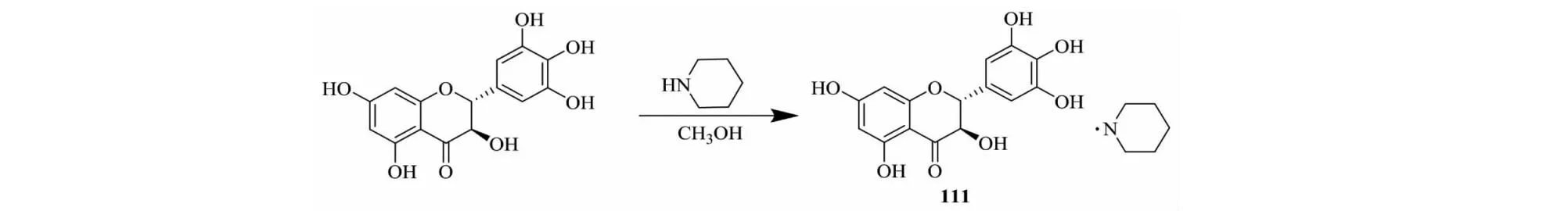
图17 二氢杨梅素衍生物111的合成路线Fig.17 Synthetic route of dihydromyricetin derivatives 111
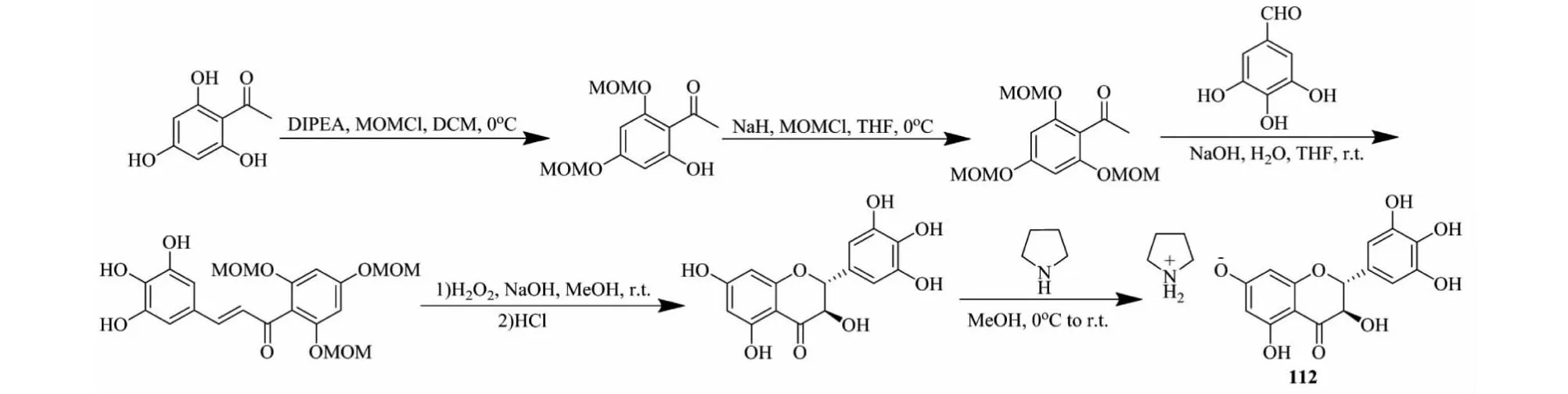
图18 二氢杨梅素活性衍生物112的全合成路线Fig.18 Total synthetic route of dihydromyricetin active derivatives 112
1.7 DHM半合成其他天然产物
DHM由于在显齿蛇葡萄中中大量存在,容易获取且分离提取手段趋向成熟,常被科研工作者半合成其他较难获取的天然产物。高温高压氧化[50]、电解脱氢[51]、氢氧化钠[52]的方法半合成杨梅素(化合物113,见图19)。
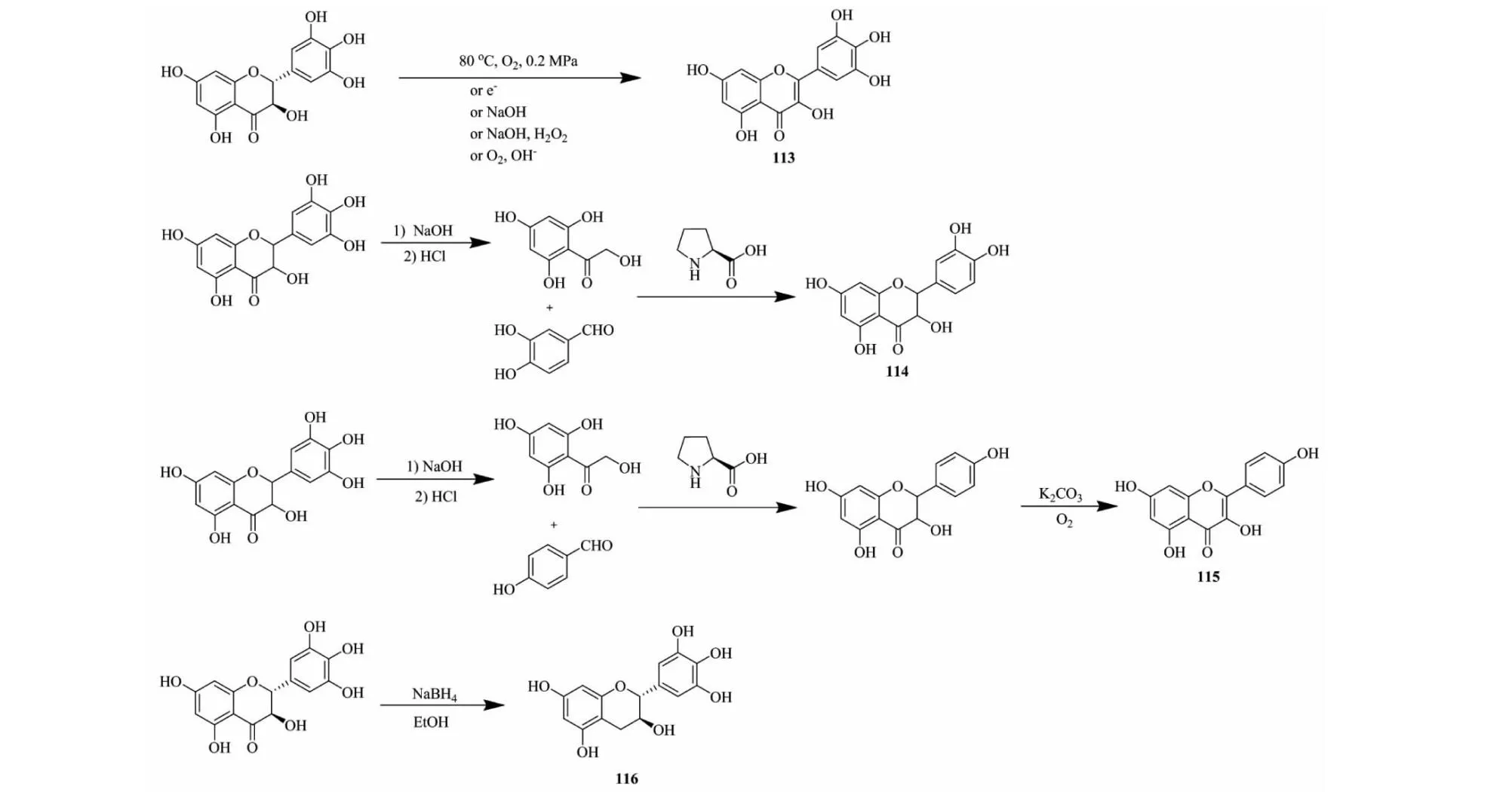
图19 二氢杨梅素衍生物113~116的合成路线Fig.19 Synthetic route of dihydromyricetin derivatives 113-116
Xiao等[53]先使DHM在15%NaOH溶液中水解成羟基苯乙酮中间体,在脯氨酸催化作用下与3,4-二羟基苯甲醛发生闭环反应合成出花旗松素(化合物114,见图19)。用同样方法将4-羟基苯甲醛反应合成出二氢山柰酚,再经氧化成山柰酚[54](化合物115,见图19)。
Xiao等[55]在NaBH4等作用下,利用DHM半合成没食子儿茶素(化合物116,见图19)。
2 金属化学修饰及其相关生物活性
金属配合物进入人体,与人体中细菌、病毒或肿瘤细胞作用,促使机体各系统恢复正常代谢[56]。DHM中由于羟基与羰基共存,同时具有特殊的空间构型,可以与金属离子形成配合物,金属配合物与活性基团作用可以明显增强相应的药理功效[57]。科研工作者做了大量工作合成了二氢杨梅素的配合物(Fe[58]、Ga[59]、Zn[60]、Cu[61]、Ni[62]、Mn[63]、Se[64]等,见表1),与DHM相比,以上配合物不同程度地提高了其抗氧化能力和清除自由基能力。

表1 二氢杨梅素配合物117~125的生物活性
Guo等[65]制备了金纳米颗粒DHM-AuCl4(化合物124,见表1),应用于组织或肿瘤成像、生物标记、生物传感器设备、光热疗法和电化学免疫分析等。Ameen等[66]合成了银纳米颗粒DHM-AgNPs(化合物125,见表1),并测试了其抗真菌活性:能明显抑制烟曲霉、内生菌和假丝酵母菌等生长,具有开发成抗真菌药物的潜力。
3 构效关系总结
DHM是显齿蛇葡萄的主要活性成分,因其广泛的药理活性而受到广泛关注。由于DHM脂溶性差及生物利用度低,很大程度上限制了其应用。运用化学方法对DHM进行结构优化,修饰结果表明,保留其B环连三酚结构有助于提高其抗新冠病毒活性;引入甲氧基或增长碳链有利于逆转多药耐药活性;通过拼接原理将活性基团与DHM连接,效果往往会比单一组分效果更好;含有多羟基的DHM衍生物较羟基全保护的衍生物抗菌活性明显增加;与胺类成盐的DHM衍生物很有可能成为治疗神经类疾病的原创药,DHM的结构修饰及其构效关系总结如下(见图20)。
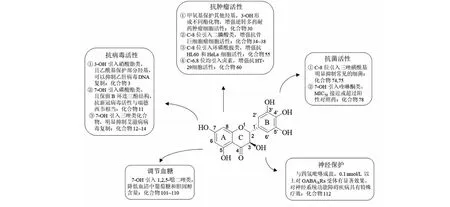
图20 二氢杨梅素结构修饰构效关系图Fig.20 Structure-activity relationship diagram of structural modification of dihydromyricetin
4 结语与展望
天然产物成功的结构修饰需要从合成可行性、生物活性及理化性质等多方面进行评价,如DHM结构上引入一个甲基,就可以明显抑制新冠病毒[15]。在以后的结构修饰过程中,修饰位点可以注重:①在二氢杨梅素A环上的修饰,运用Friedel-Crafts或Mannich反应在C-6或8位引入不同基团,再与现有药物拼接形成孪药;②可以采用经典修饰方法,在不同羟基上发生醚化反应或酯化反应,但需格外注意修饰后产物的构型改变;③还可以涉及未探讨过的只对DHM 5-OH修饰,而保留其他羟基,以期发现新的生物活性。DHM结构修饰难点:①在保护和去保护羟基反应中,往往难以达到指定羟基保护或去保护;②反应与分离纯化过程中,DHM易氧化成杨梅素或转变成查尔酮,导致产物复杂且难以分离。DHM多样的药理活性,吸引着众多科研工作者通过化学修饰来提高药理活性和了解其潜在的药效基团,DHM衍生物必将会给新药研发带来新希望。