泽泻提取物改善游离脂肪酸诱导的HepG2 脂肪变性细胞模型的脂质代谢及氧化应激异常
谢 燕,李贵平,段月阳,李 良,吕耀中,温建辉,曹 亮,李 旭,杨 昊,4*,肖 伟,4,王振中,3*
1.南京中医药大学,江苏 南京 210023
2.中药制药过程控制与智能制造技术全国重点实验室,江苏 连云港 222001
3.江苏康缘药业股份有限公司,江苏 连云港 222001
4.上海中医药大学中药研究所,上海 201203
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一种以肝细胞内脂质过度沉积为主要病理特征的代谢紊乱性疾病[1-2]。NAFLD 的高危因素包括不良生活习惯、肥胖、糖尿病和不合理膳食结构等[3]。近几十年来随着亚洲地区经济的快速增长和城市化推动,导致其患病率随着饮食和生活方式的变化不断增加。根据统计,我国NAFLD的成人患病率为29%,为4 年前患病率的2 倍[4]。NAFLD 的晚期形式为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),并可进一步发展为肝纤维化、肝硬化甚至肝细胞癌。目前NAFLD 的治疗手段仅限于生活方式的改变,临床尚未有获批的上市治疗药物和方法[5-6]。
NAFLD 是一种由胰岛素抵抗、脂毒性和氧化应激等多种因素共同导致的疾病,对其所涉及的机制尚不明确[7]。过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)是调节糖脂代谢和能量代谢的关键受体[8],大量研究发现其与NAFLD 疾病进展相关,NAFLD 患者肝脏中PPARα 蛋白表达水平和活性下降,下降程度与疾病严重程度和内脏脂肪蓄积量显著正相关[9],肝脏PPARα 特异性敲除的模型小鼠在高脂诱导后肝脏炎症和血清中总胆固醇(total cholesterol,TC)含量较对照组小鼠明显增加[10]。双重PPARα/γ 激动剂Saroglitazar 在NAFLD/NASH 受试者治疗中显示可减少肝细胞脂肪变性,改善胰岛素抵抗和肝酶水平异常,从而减少肝损伤[11]。PPARα 或是NAFLD 治疗的潜在靶点。
当前临床上越来越多地将中医药作为补充及替代疗法对NAFLD 进行干预[12-13]。泽泻作为临床常用药,在传统中医中有着悠久的应用历史,其性寒味甘,具有利水渗湿、化浊调脂和去痰饮湿热的作用[14]。现代临床研究表明,其对慢性代谢性疾病如高血脂、糖尿病、脂肪肝等具有一定的疗效[15-17],泽泻的三萜类活性成分如泽泻A-24-乙酸酯和泽泻B-23-乙酸酯也被发现具有抗NAFLD 活性,其作用机制可能部分与脂联素或核受体法尼醇X 受体(farnesoid X receptor,FXR)的激活有关[18-19]。本课题组前期在泽泻药材中调血脂活性部位的筛选研究中发现,泽泻醇A、泽泻醇A-23-乙酸酯和泽泻醇A-24-乙酸酯是泽泻发挥调血脂作用的主要活性成分。在此基础上,经过一系列的工艺考察和优化,得到了以泽泻醇A、泽泻醇A-23-乙酸酯和泽泻醇A-24-乙酸酯为主要成分的泽泻提取物(Alisma orientaleextract,AE)[20]。本研究以游离脂肪酸(free fatty acid,FFA)诱导建立HepG2 脂肪变性细胞模型,考察AE 及其3 种主要单体成分对HepG2 脂肪变性细胞模型的改善作用及作用机制,以期为相关新药开发奠定基础。
1 材料
1.1 细胞株
HepG2 细胞购自浙江美森细胞有限公司。
1.2 药材
泽泻由江苏康缘药业股份有限公司提供,经连云港康济大药房连锁有限公司吴舟执业药师鉴定为泽泻科植物泽泻A.orientalis(Sam.) Juzep.的干燥块茎。
1.3 药品与试剂
泽泻醇A(质量分数99.22%,批号149027)、泽泻醇A-24-乙酸酯(质量分数≥98%,批号150961)购自美国MCE 公司;泽泻醇A-23-乙酸酯(质量分数≥98%,批号CF9236)、细胞色素P450 酶7A1(cytochrome P450 enzyme 7A1,CYP7A1)抗体(批号AC7948)购自美国Biorbyt 公司;胎牛血清(批号2059458CP)、0.25%胰酶(批号2465621)、DMEM高糖培养基(批号20220928)购自美国Gibco 公司;即用型PBS 片剂(批号J103KA7999)购自生工生物工程(上海)股份有限公司;油酸钠(批号921V038)、棕榈酸钠(批号924V021)、牛血清白蛋白(bovine serum albumin,BSA,批号1122G022)、油红O 溶液(批号SLCK1135)购自美国Sigma 公司;增强型CCK-8 试剂盒(批号12142220230519)、增强型BCA 蛋白检测试剂盒(批号20221101)、活性(reactive oxygen species,ROS)检测试剂盒(批号060722220624)购自上海碧云天生物技术有限公司;三酰甘油(triglyceride,TG)检测试剂盒(批号20211112)、TC 检测试剂盒(批号20211112)、总谷胱甘肽(glutathione,GSH)检测试剂盒(批号20230918)购自南京建成生物有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号1026786-4)、丙二醛(malondialdehyde,MDA)试剂盒(批号1032673-1)、血红素加氧酶-1(heme oxygenase-1,HO-1)抗体(批号1011567-2)、重组酰基辅酶A 氧化酶1(acyl coenzyme A oxidase 1,ACOX1)抗体(批号1032699-13)、PPARα 抗体(批号1012132-1)购自艾博抗(上海)贸易有限公司;PPAR 共激活因子-1α(peroxisome proliferatoractivated receptor gamma coactivator-1α,PGC-1α)抗体(批号5)、肉碱棕榈酰转移酶1A(carnitine palmitoyl transferase 1A,CPT1A)抗体(批号1)、HRP 标记的山羊抗兔IgG 抗体(批号30)购自美国CST 公司;核因子红细胞2 相关因子2(nuclear factor erythrocyte 2-associated factor 2,Nrf2)抗体(批号YD3883204)购自美国Invitrogen 公司。
1.4 仪器
MS1003S 型分析天平[梅特勒-托利多仪器(上海)有限公司];371 型二氧化碳培养箱(美国Thermo Fisher Scientific 公司);Flex station 3 型多功能酶标仪[美谷分子仪器(上海)有限公司];SCIENTZ-ⅡD型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);Power PacTM HC 型电泳仪、Trans-blot SD型半干转膜仪、Universal HoodII 型凝胶成像发光系统(美国Bio-Rad 公司);5810R 型高速冷冻离心机(德国Eppendorf 公司);IX73 倒置荧光显微镜(日本Olympus 公司)。
2 方法
2.1 AE 的制备
将泽泻干燥块茎粉碎,加入80%乙醇,加热回流1.5 h 萃取2 次,滤过,将提取物减压浓缩后加入60%乙醇-浓硫酸混合物并回流溶液,将溶液冷却至4 ℃,24 h 后加入NaOH 调节pH 值至5~6,加入去离子水制成含乙醇量40%的溶液,用DM130 大孔吸附树脂填充色谱柱,45%~55%乙醇洗脱,收集洗脱液后浓缩干燥,将样品溶于石油醚-醋酸乙酯溶剂,浓缩并在70%下真空干燥72 h,即得AE 粉末。采用配备二极管阵列检测器的反相高效液相色谱外标法对AE 的3 种主要成分含量进行测定。监测仪的波长为235 nm,体积流量为1.0 mL/min,柱温为30 ℃。
2.2 细胞培养
HepG2 细胞用含10%胎牛血清及1%青霉素-链霉素溶液的高糖DMEM 培养基,在37 ℃、5% CO2条件下培养。
2.3 HepG2 脂肪变性细胞模型建立
取对数生长期的HepG2 细胞,以2×105/孔接种于6 孔板,细胞贴壁后,加入不同浓度的FFA(油酸-棕榈酸2∶1)造模剂1 mL,对照组加入1 mL DMEM 完全培养基继续培养,37 ℃培养箱孵育24 h后,油红染色评估细胞内脂质蓄积量。
2.4 CCK-8 法检测FFA、AE 及其主要单体成分对HepG2 细胞活力的影响
取对数生长期的HepG2 细胞,以1×104/孔接种于96 孔板,细胞贴壁后加入含FFA(0.25、0.50、0.75、1.00、1.25、1.50 mmol/L)、AE(0.781、1.563、3.125、6.250、12.500、50.000、100.000 mg/L)、泽泻醇A(0.781、1.563、3.125、6.250、12.500、50.000、100.000 μmol/L)、泽泻醇A-23-乙酸酯(0.781、1.563、3.125、6.250、12.500、50.000、100.000 μmol/L)、泽泻醇A-24-乙酸酯(0.781、1.563、3.125、6.250、12.500、50.000、100.000 μmol/L)的DMEM 完全培养基,另设置对照组(不含药物)和空白组(不接种细胞不含药物)。每组3 个复孔,孵育24 h,每孔加入10 μL 的CCK8 试剂,孵育2 h 后于450 nm 处检测吸光度(A)值,计算细胞存活率。
细胞存活率=(A给药-A空白)/(A对照-A空白)
2.5 细胞内TC、TG 含量测定
按“2.3”项方法诱导HepG2 脂肪变性细胞模型。在诱导同时加入AE(25.00、12.50、6.25 mg/L)、泽泻醇A(50.0、25.0、12.5 μmol/L)、泽泻醇A-23-乙酸酯(25.00、12.50、6.25 μmol/L)、泽泻醇A-24-乙酸酯(50.0、25.0、12.5 μmol/L)对细胞进行干预,另设置不含药物的对照组,孵育24 h 后,按照试剂盒说明书检测各组细胞内TC、TG 含量。
2.6 细胞油红O 染色
按照“2.5”项方法对细胞进行给药,孵育完成后,弃去培养基,用冷PBS 清洗2 次;弃去PBS,加入4%多聚甲醛,室温固定30 min;弃去多聚甲醛,用ddH2O 润洗3 次,加入60%异丙醇静置1~2 min;弃去异丙醇,每孔加入2 mL 油红工作液,避光染色20 min;弃去染液,ddH2O 清洗至水颜色变透明。加入少量ddH2O 后置于倒置显微镜下拍照,随机选取3 个视野,用Image J 软件对脂滴面积进行统计。
2.7 细胞内ROS 水平测定
按照“2.5”项方法对细胞进行处理,孵育完成后,弃去培养基,PBS 洗涤3 次,每孔加入1ml DCFH-DA 探针溶液,37 ℃避光孵育20 min,无血清DMEM 培养基洗涤3 次,荧光显微镜下观察染色情况并拍照,随机选取5 个视野,用Image J 软件对荧光强度进行统计。
2.8 细胞内MDA、GSH 含量及SOD 活性测定
按照“2.5”项方法对细胞进行给药,孵育完成后,按照试剂盒说明书对细胞内MDA、GSH 含量及SOD 活性进行检测。
2.9 Western blotting 检测PPARα、PGC-1α、CPT1α、ACOX1 及CYP7A1 蛋白表达
按照“2.5”项方法对细胞进行给药,孵育完成后,冷PBS 洗2 次,弃去PBS,每孔加入RIPA 裂解液100 μL,冰上裂解20 min,收集细胞总蛋白,4 ℃、14 000 r/min 离心10 min,取上清,用BCA试剂盒进行蛋白定量。蛋白样品经4%~20%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,TBST 洗涤3 次,5%脱脂牛奶封闭2 h,分别加入β-Tubulin(1∶1 000)、PPARα(1∶1 000)、PGC-1α(1∶1 000)、CPT1α(1∶1 000)、ACOX1(1∶1 000)、CYP7A1(1∶1 000)、Nrf2(1∶1 000)及HO-1(1∶1 000)抗体,4 ℃孵育过夜,TBST 洗涤3 次,二抗(1∶10 000)室温孵育2 h,TBST 洗涤3 次,加入ECL 显影液,于Chemi Doc XRS 系统显影并拍照,Image J 软件统计灰度值。
2.10 统计学分析
数据以±s表示,采用GraphPad Prism 软件对数据进行分析,组间差异选择单因素方差分析。
3 结果
3.1 AE 的质控
如图1 所示,经测定AE 粉末中泽泻醇A、泽泻醇A-24-乙酸酯和泽泻醇A-23-乙酸酯3 种活性化合物的总质量分数为85.83%。

图1 AE (A) 及对照品溶液 (B) 的HPLC 图谱Fig.1 HPLC of AE (A) and reference substances solution(B)
3.2 不同剂量FFA 对HepG2 细胞脂质蓄积的影响
如图2 所示,对照组几乎观察不到明显的红色脂滴,随着造模剂浓度从0.5 mmol/L 升高至1.5 mmol/L,红色脂滴的数量逐渐增加,且融合形成大滴脂滴。利用Image J 软件进行定量分析并通过GraphPad 软件进行组间差异比较后发现,与对照组比较,各剂量FFA 诱导后的脂滴量均具有显著差异(P<0.01、0.001)。

图2 不同剂量FFA 对HepG2 细胞脂质蓄积的影响 (±s , n = 3)Fig.2 Effects of different doses of FFA on lipid accumulation in HepG2 cells (±s , n = 3)
3.3 FFA、AE 及其单体化合物对HepG2 细胞活力的影响
如图3 所示,与对照组比较,FFA、AE、泽泻醇A、泽泻醇A-23-乙酸酯和泽泻醇A-24-乙酸酯分别在0.75 mmol/L、25 mg/L、50 μmol/L、25 μmol/L和50 μmol/L 及以下浓度对细胞活力无明显影响,结合“3.2”项的实验结果,选择0.75mmol/L 的FFA作为造模剂量,AE(25.00、12.50、6.25mg/L)、泽泻醇A(50、25、12.50 μmol/L)、泽泻醇A-23-乙酸酯(25.00、12.50、6.25μmol/L)和泽泻醇A-24-乙酸酯(50.0、25.0、12.5 μmol/L)作为给药剂量进行后续实验。

图3 FFA、AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞存活率的影响 (±s, n = 3)Fig.3 Effects of FFA, AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on survival rate of HepG2 cells (±s, n = 3)
3.4 AE 及其单体化合物对HepG2 细胞内TC、TG含量的影响
如图4 所示,与对照组比较,模型组细胞内TC、TG 水平均显著升高(P<0.001);与模型组比较,AE(25 mg/L)、泽泻醇A(50、25 μmol/L)、泽泻醇A-23-乙酸酯(25.0、12.5 μmol/L)和泽泻醇A-24-乙酸酯(50 μmol/L)给药组细胞内TC 水平均显著降低(P<0.05、0.01、0.001),AE(25 mg/L)、泽泻醇A(50、25 μmol/L)和泽泻醇A-23-乙酸酯(25 μmol/L)给药组细胞内TG 水平显著降低(P<0.05、0.001)。

图4 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞内TC、TG 含量的影响 (±s , n = 3)Fig.4 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on TC and TG contents in HepG2 cells (±s , n = 3)
3.5 AE 及其单体化合物对HepG2 细胞脂质蓄积的影响
如图5 所示,与对照组比较,模型组HepG2 细胞中出现大量红色脂滴(P<0.001),表明模型构建成功。与模型组比较,各给药组细胞内红色脂滴含量均降低,且AE(25 mg/L)、泽泻醇A(50、25 μmol/L)和泽泻醇A-23-乙酸酯(25.0、12.5 μmol/L)给药组细胞中脂滴含量与模型组存在显著性差异(P<0.01、0.001)。结合“3.4”项结果,后续实验选用给药剂量为AE(25 mg/L)、泽泻醇A(25 μmol/L)、泽泻醇A-23-乙酸酯(12.5 μmol/L)及泽泻醇A-24-乙酸酯(50 μmol/L)。

图5 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞脂滴蓄积的影响 (±s, n = 3)Fig.5 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on lipid accumulation in HepG2 cells (±s , n = 3)
3.6 AE 及其单体化合物对HepG2 细胞内ROS 水平的影响
如图6 所示,与对照组比较,模型组细胞中ROS水平显著升高(P<0.001);与模型组比较,AE、泽泻醇A 及泽泻醇A-24-乙酸酯给药组细胞内ROS 水平显著降低(P<0.05、0.001),泽泻醇A-23-乙酸酯给药组细胞内ROS 水平也出现降低,但与模型组相比无统计学意义。
图6 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞内ROS 水平的影响 (±s, n = 3)Fig.6 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on ROS level in HepG2 cells (±s, n = 3)
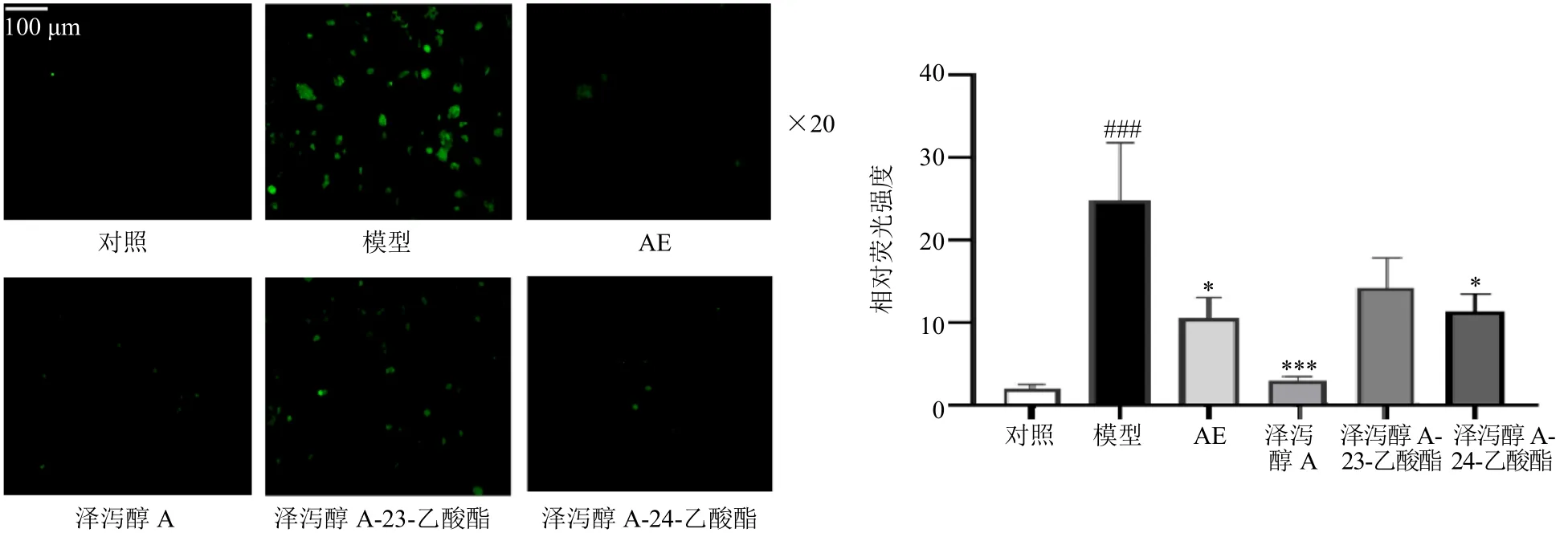
图6 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞内ROS 水平的影响 (±s, n = 3)Fig.6 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on ROS level in HepG2 cells (±s, n = 3)
3.7 AE 及其单体化合物对HepG2 细胞内MDA、GSH 水平及SOD 活性的影响
如图7 所示,与对照组比较,模型组细胞内MDA 水平显著升高(P<0.001),SOD 活性及GSH水平均显著降低(P<0.01、0.001);与模型组比较,各给药组细胞内MDA 水平均显著下降(P<0.001),AE、泽泻醇A 给药组细胞内SOD 活性均显著升高(P<0.05),AE、泽泻醇A 及泽泻醇A-24-乙酸酯给药组细胞内GSH 水平显著升高(P<0.05、0.01)。
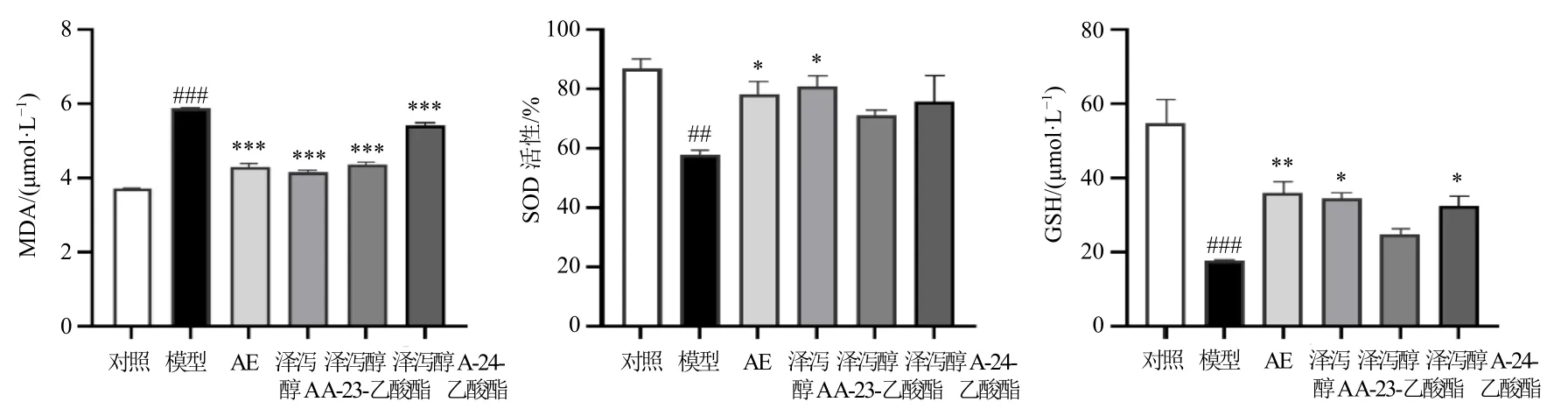
图7 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞内MDA、GSH 水平及SOD 活性的影响(±s, n = 3)Fig.7 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on MDA, GSH levels and SOD activity in HepG2 cells(±s, n = 3)
3.8 AE 及其单体化合物对细胞内脂质氧化及胆固醇代谢相关蛋白表达的影响
如图8 所示,与对照组比较,模型组细胞中PPARα、PGC-1α、CPT1A 及ACOX1 蛋白表达水平均显著降低(P<0.05、0.01、0.001);与模型组比较,AE、泽泻醇A 及泽泻醇A-23-乙酸酯给药组细胞中PPARα、PGC-1α 及ACOX1 蛋白表达水平均显著升高(P<0.05、0.01),泽泻醇A 及泽泻醇A-23-乙酸酯给药组细胞中CPT1A 蛋白表达水平均显著升高(P<0.05、0.01),AE、泽泻醇A 及泽泻醇A-24-乙酸酯给药组细胞中CYP7A1 蛋白表达水平显著升高(P<0.05、0.01)。

图8 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞中PGC-1α、PPARα、CPT1A、ACOX1及CYP7A1 蛋白表达的影响 (±s , n = 3)Fig.8 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on PGC-1α, PPARα, CPT1A, ACOX1 and CYP7A1 protein expressions in HepG2 cells (±s , n = 3)
3.9 AE 及其单体化合物对细胞内氧化应激相关通路Nrf2/HO-1 蛋白表达的影响
如图9 所示,与对照组比较,模型组细胞中Nrf2、HO-1 蛋白表达水平均显著降低(P<0.05、0.01);与模型组比较,各给药组细胞中Nrf2、HO-1蛋白表达水平均呈上升趋势,其中AE 及泽泻醇A给药组Nrf2 和HO-1 蛋白表达均显著上调(P<0.05、0.01)。

图9 AE、泽泻醇A、泽泻醇A-23-乙酸酯、泽泻醇A-24-乙酸酯对HepG2 细胞中Nrf2/HO-1 蛋白表达的影响(±s, n = 3)Fig.9 Effects of AE, alisol A, alisol A-23-acetate, alisol A-24-acetate on Nrf2/HO-1 protein expressions in HepG2 cells(±s, n = 3)
4 讨论
NAFLD 是一种由脂质代谢失衡、胰岛素抵抗和氧化应激异常等多因素相结合导致的复杂性肝病,现已成为慢性肝病的主要原因[21]。现代研究发现泽泻提取物能改善NAFLD 的中医病机,有效调节肝脏的糖脂代谢,控制氧化应激、炎症和纤维化等肝损伤[22-23]。本研究中使用的AE 的主要单体成分为泽泻醇A、泽泻醇A-23-乙酸酯和泽泻醇A-24-乙酸酯。泽泻醇A 可通过提高脂蛋白脂酶活性从而降低高脂血症患者血浆中TG、TC 水平[24]。泽泻醇A-23-乙酸酯能刺激将TC 转化为胆汁酸的关键蛋白CYP7A1 的转录,有助于改善高脂血症和肝脏脂肪变性[25]。泽泻醇A-24-乙酸酯降低了NASH 小鼠模型肝组织中ROS 水平,通过刺激小鼠肝脏和人肝星状细胞的自噬,从而抑制氧化应激来改善NASH[19]。以上研究结果进一步证明了AE 中的泽泻醇A 及其衍生物可能是发挥抗NAFLD 作用的主要活性成分。FFA 是由棕榈酸和油酸组成的一种常用的肝脂肪变性造模剂,利用过量的棕榈酸或FFA 刺激HepG2 细胞后,细胞脂毒性增加,细胞脂质氧化相关蛋白PPARα 及ACOX1 等表达水平降低,HepG2细胞会出现严重的脂质蓄积并通常伴随着显著的氧化应激异常[26-28]。因此本实验通过0.75 mmol/L FFA诱导来构建稳定的HepG2 脂肪变性细胞模型,用于评价AE 及其主要单体化合物的药效和作用机制。
肝脏作为重要的代谢器官,在脂质的消化、吸收、运输、代谢和合成中起着不可或缺的作用[29]。在生理条件下,肝脏摄取的脂肪酸通常被转运至线粒体或过氧化物酶体进行β 氧化为机体供能,仅一小部分脂肪酸转化为TG。因此肝脏的TG 储存量通常极少[30]。同时,肝脏可通过CYP7A1 等关键酶将TC 转化为胆汁酸,防止TC 及毒性代谢物的累积,维持体内的脂质代谢平衡[31]。当机体长期处于高脂质水平下时,肝脏脂质代谢平衡失调,氧化途径受损,TG、TC 在肝细胞内大量蓄积,从而导致NAFLD的发生[32]。本研究发现,利用造模剂FFA 刺激HepG2 细胞后,细胞内出现大量脂滴,TC、TG 含量显著上升。与模型组相比,AE、泽泻醇A、泽泻醇A-23-乙酸酯和泽泻醇A-24-乙酸酯可不同程度地抑制细胞内脂滴数量,并明显降低TC、TG 水平,表明AE 可以改善FFA 造成HepG2 脂肪变细胞模型的脂质蓄积。
PPARs,是配体激活转录因子的核受体超家族,由3 种亚型组成,其中PPARα 主要存在于肝脏中,可在共激活因子PGC1α 协同下调节胆固醇和脂肪酸代谢[33]。PPARα 可以减少肝脏中富含TG 的脂质胆固醇以及TG 的积累,通过影响下游脂肪酸氧化基因和胆固醇代谢基等,调节脂肪酸运输,促进β-氧化和胆固醇分解[34]。脂肪酸β-氧化主要发生于线粒体,肝细胞脂肪酸活化成脂酰辅酶A 后通过CPT1A 转运至线粒体中进行氧化[35],是体内脂肪酸氧化的主要方式之一,由于线粒体缺乏氧化极长链脂肪酸的能力,这些脂肪酸会优先通过过氧化物酶体 β-氧化进行代谢,此途径中的限速酶是ACOX1[36]。此外,已有研究证实NAFLD 患者血清中的TC 比率与其病理评分显著正相关,将胆固醇转化为胆汁酸,可以防止胆固醇及其毒性代谢物的积累,是肝细胞中胆固醇清除的重要途径,而PPARα参与胆固醇代谢过程中的关键酶CYP7A1的调节[37]。本研究发现,与模型组比较,AE 及其单体成分给药组细胞内PPARα、PGC1α、CPT1A、ACOX1及CYP7A1 蛋白表达上调,提示AE 可能通过影响PPARα 通路改善HepG2 脂肪变性细胞的脂质代谢失衡。
当过量FFA 诱导HepG2 细胞发生脂肪变性时,肝细胞内脂滴蓄积,脂质β 氧化增加了呼吸链电子,导致过量ROS 生成[38-39]。过量ROS 会诱导DNA 氧化损伤和各种细胞毒性相关蛋白的异常表达,毒性代谢产物MDA 大量蓄积,抗氧化因子SOD 和GSH活性降低,从而造成肝细胞线粒体功能损伤,进一步加重肝细胞脂肪变性[40-41]。本研究发现AE、泽泻醇A和泽泻醇A-24-乙酸酯具有良好的抗氧化能力,显著降低ROS 和MDA 的水平,同时提高SOD 活性和GSH 水平,提示AE 通过提高抗氧化水平抑制FFA 引起的氧化应激异常,从而缓解脂肪变性。
细胞氧化应激的主调控蛋白为Nrf2,生理条件下,其与Kelch 样环氧氯丙烷相关蛋白(Kelch-like epichlorohydrin-related proteins,Keap1)结合,在胞质中处于非活性状态。当细胞被ROS 刺激后,Nrf2从聚合体解偶联并转运到细胞核,与Maf 蛋白形成异二聚体后与核内抗氧化反应元件(antioxidant reaction elements,AREs)结合,启动后续转录过程,激活下游靶基因,抗氧化应激,减少肝损伤[27,42]。为了确定Nrf2 是否参与了AE 改善HepG2 脂肪变性细胞模型氧化应激异常,本研究检测了Nrf2/HO-1 通路的蛋白表达情况,结果表明AE 及其单体化合物中的泽泻醇A 显著恢复了由于过量FFA 导致的Nrf2/HO-1 蛋白表达的病理性降低,这表明AE 可能通过激活Nrf2/HO-1 通路来改善氧化应激异常,泽泻醇A 和泽泻醇A-24-乙酸酯可能是AE 发挥抗氧化能力的主要活性成分。已有研究表明PPARα 激动剂可以通过上调PPARα 蛋白表达刺激Nrf2 易位到细胞核中,促进其与ARE 的结合以及AREs 下游抗氧化蛋白HO-1 的转录起始,从而减轻氧化应激损伤[43]。因此,推测AE 可能是通过调节PPARα 蛋白表达,从而激活Nrf2/HO-1 通路,相关机制值得进一步研究。
综上,AE 及其单体化合物可能通过调节PPARα 通路来促进脂肪酸氧化和胆固醇清除,减少肝细胞内的脂质蓄积,同时激活Nrf2/HO-1 通路,抑制氧化应激,最终改善HepG2 细胞脂肪变性。
利益冲突所有作者均声明不存在利益冲突

