动脉粥样硬化斑块内新生血管与斑块稳定性的相关性*
张一帆,李芳,李启玉,邵醒
1 贵州中医药大学 贵州贵阳 550022
2 贵州中医药大学第二附属医院 贵州贵阳 550002
动脉粥样硬化(atherosclerosis,As)是一种慢性炎性疾病,在多种因素的作用下,导致血管内膜通透性发生改变,且巨噬细胞源性和平滑肌细胞源性泡沫细胞形成和细胞外基质合成增加,经过演变后最终形成凸向管腔的占位性病变,即AS斑块[1]。目前研究已表明,斑块的稳定性与斑块内新生血管的形成密切相关[2],AS新生血管促进粥样硬化的发生发展,诱发斑块内出血、斑块破裂及其并发症的形成,是促进稳定型斑块向不稳定型斑块发展的重要机制。在AS的早期既有新生血管存在,生理状态下新生血管一般存在于管壁的外膜和中膜之间,不会向内膜延伸[3],但炎性反应、低氧环境、脂质水平及氧化应激等因素会刺激新生血管向内膜生长,从而影响新生血管的数量及斑块的稳定性[4]。本研究意在通过动物实验探讨AS斑块内新生血管和斑块稳定性的相关性。
实验材料与方法
1 实验动物
雄性新西兰白兔51只,体质量(1.952±0.033)kg,饲养于贵州中医药大学实验动物研究所。
2 材料
药品:胆固醇、猪胆盐、牛血清白蛋白(上海源叶生物,S11040,S30895,S90486),包括主要相关测定试剂盒、染色液、蓝化液等。主要仪器:-80℃冰箱(BDF-86V348,BIOBASE,上海汉诺仪器有限公司),微型离心机(德国eppendorf),低温高速冷冻离心机(德国eppendorf),电热恒温培养箱(DHP-9054,山东博科生物产业有限公司),电热鼓风干燥箱(DHG-9070A,恒科学仪器有限公司),热恒温培养箱(DHP-9054,山东博科生物),AL104电子天平(上海旦鼎国际贸易有限公司),其他:不同规格移液器、不同规格离心管等。
3 实验方法
3.1 实验动物分组、饲养及造模方法
3.1.1 实验分组 将50只雄性白兔安置入实验室后,逐一称重并记录,适应性喂养3d,随机选取12只白兔,作为空白对照组(n=12),并予普通饲料喂养;将剩余38只白兔予高脂饲料喂养,在喂养实验过程中,高脂饲料喂养的兔子因灌胃、腹泻等相关原因死亡10只,在第八周末,随机选取1只高脂饲料喂养的实验兔解剖为模型组,证明AS造模成功。遂将剩余27只高脂饲料喂养的AS实验兔随机分为:高脂饮食组(n=9)、中药复方组(n=9)、阿托伐他汀组(n=9)。空白对照组不予特殊干预,自由饮水、普通饲料喂养。
3.1.2 造模方法 AS造模采用高脂饮食联合免疫损伤的方法。实验兔子适应性喂养3d后,逐步添加高脂饲料(普通饲料 78.9%、胆固醇 1%、猪胆盐 0.1%、蛋黄 10%、猪油 10%)(在添加高脂饲料的过程中实验兔因腹泻死亡10只),耳缘静脉注射牛血清白蛋白,浓度 20%(10g/50mL),以 250mg/kg 的量注射,每周一次,连续三周。AS模型建立成功后,随机选取一只解剖为模型组,余兔子随机分为高脂饮食组(n=9)、中药复方组(n=9)、阿托伐他汀组(n=9)。
3.2 血液、动脉标本采集及保存方法
取血液标本:予10%水合氯醛(4mL/kg)经腹腔注射麻醉,通过角膜反射测试实验兔完全麻醉成功后,四肢、牙齿固定于解剖板上,将颈部、胸部、腹部剪刀备皮。从腹正中线,由浅入深后依次切开皮肤、肌肉,使腹腔及腹主动脉完全暴露(注意腹腔压力较大),取血5mL,立即分离血清,后存放于贵州中医药大学中心实验室-80℃冰箱中冷藏备用。
取动脉标本:同前麻醉成功且固定后,由胸骨柄由下往上,依次切开皮肤、肌肉等,沿着腋前线剪开充分暴露胸腔(操作要迅速),立即予分离出胸主动脉并用血管钳夹闭远端,找到斑块最明显处,用组织剪取下,将其放入 PBS 溶液,洗净残留血液,后用玻璃分针分离血管壁上的脂肪等多余组织,后放入4%多聚甲醛溶液、2.5%的戊二醛溶液固定,存放于 4℃的冰箱备用。取完标本后,将实验兔安乐死。
3.3 指标检测 检测所取腹主动脉血清标本中的TG、T-CHO、LDL-C、HDL-C的值。用PCR法检测组织标本中CD34的mRNA表达量。胸主动脉HE染色结果及CD34免疫组化结果。
4 统计学方法
采用SPSS 26.0统计软件分析数据,所有数据先进行正态性检验,符合正态分布,多组间比较采用单因素方差分析进行数据分析,以均数±标准差(±s)表示,P<0.05为差异具有统计学意义。
实验结果
1 空白组与高脂饮食组血脂比较情况
与空白组相比,高脂饮食组总胆固醇(T-CHO)、甘油三酯、(TG)高密度脂蛋白胆固醇(LDL-C)在4周、8周、12周时均升高明显,HDL-C降低明显(P<0.05)。见表1、表2、表3。
表1 第4周时高脂组与空白组生化指标比较(±s)

表1 第4周时高脂组与空白组生化指标比较(±s)
组别例数TG/mmol·L-1T-CHO/mmol·L-1LDL-C/mmol·L-1HDL-C/mmol·L-1空白对照组40.742±0.0205.316±0.5830.720±0.0321.176±0.075高脂饮食组31.430±0.03811)31.69±1.2681)4.193±0.2021)0.327±0.0321)
表2 第8周时高脂组与空白组生化指标比较(±s)

表2 第8周时高脂组与空白组生化指标比较(±s)
组别例数TG/mmol·L-1T-CHO/mmol·L-1LDL-C/mmol·L-1HDL-C/mmol·L-1空白对照组41.107±0.1036.514±0.3650.863±0.0930.946±0.084高脂饮食组31.426±0.1191)47.38±0.8511)4.645±0.2901)0.208±0.0241)
表3 第12周时高脂组与空白组生化指标比较(±s)

表3 第12周时高脂组与空白组生化指标比较(±s)
注:与空白对照组比较,1)P<0.05
组别例数TG/mmol·L-1T-CHO/mmol·L-1LDL-C/mmol·L-1HDL-C/mmol·L-1空白对照组41.281±0.1636.923±0.001.047±0.1170.563±0.096高脂饮食组34.120±0.1851)6.923±0.001)7.719±0.6351)0.125±0.0241)
2 模型组与高脂饮食组CD34的mRNA定量表达结果
与模型组相比,高脂饮食组CD34在4周、8周、12周时的表达量均>1,增长明显(P<0.05)。见表4。
表4 模型组与高脂饮食组4周、8周、12周时CD34相对表达量的比较(±s)

表4 模型组与高脂饮食组4周、8周、12周时CD34相对表达量的比较(±s)
注:相对表达量:CD34的表达量用采用相对表达量计算,以模型组表达量为1,各组的表达量为相对于在模型组中表达的倍数。在P<0.05 的情况下,相对表达量<1,说明目的基因在实验组中表达下调;>1 说明表达上调;模型组CD34表达量数据不符合正态分布,其与空白组比较属于组间比较,采用秩和检验。
组别例数4周8周12周模型组4 1.000±0.0001.000±0.0001.000±0.000高脂饮食组3 1.392±0.298 1.172±0.141 4.225±0.536
3 胸主动脉HE染色结果
4周、8周、12周空白对照组均未见AS病灶,为正常主动脉壁,内膜、中膜、外膜结构完整,动脉内壁光滑,无细胞增生,肌层厚度均匀,内膜下无泡沫细胞聚集,弹力纤维排列整齐,无断裂现象。高脂饮食组:4周时,动脉内膜改变,内膜下可见泡沫细胞聚集,内膜增厚,中膜和外膜结构完整,弹力纤维排列整齐,无断裂现象,为AS的脂纹期的病理改变;8周和12周时,动脉结构改变,内膜下可见大量泡沫细胞形成纤维斑块病变,大量泡沫细胞及胆固醇结晶形成AS期病灶。泡沫细胞极度膨大,呈圆形或者椭圆形,发生气球样改变,弹力纤维部分断裂,溶解,为AS的纤维斑块期。见图1、图2、图3、图4、图5、图6。
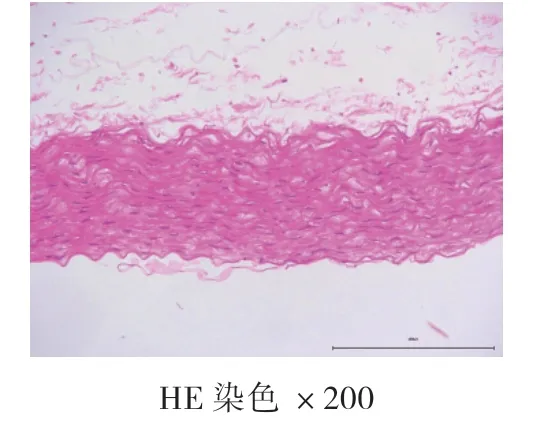
图1 空白对照组4周
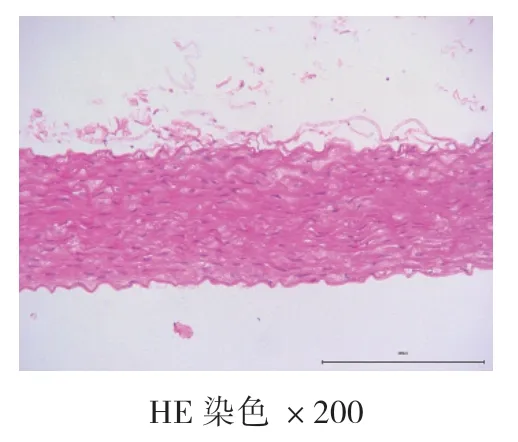
图2 空白对照组8周
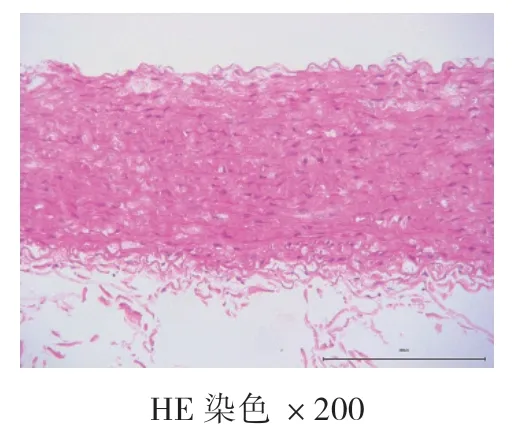
图3 空白对照组12周
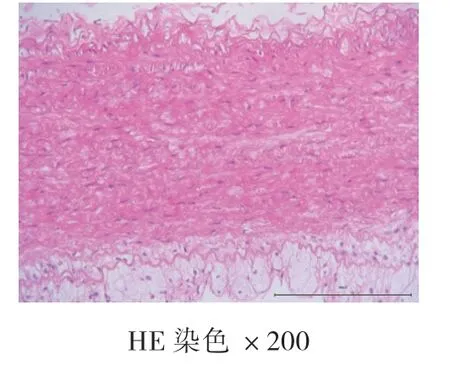
图4 高脂饮食组4周

图5 高脂饮食组8周
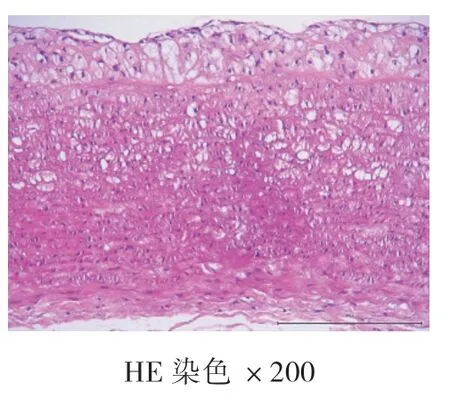
图6 高脂饮食组12周
4 胸主动脉CD34免疫组化结果
4周、8周、12周时空白对照组主动脉均为内膜光滑,未见新生血管标记,也未见斑块形成。4周、8周、12周时高脂饮食组均有内膜改变,CD34染色均呈阳性表达,且随时间的推移,阳性表达逐渐增强,内膜下可见大量蓝紫色细胞核聚集,为CD34标记的新生血管,证明高脂饮食造模成功的实验兔斑块内新生血管在不断生长。见图7、图8、图9、图10、图11、图12。
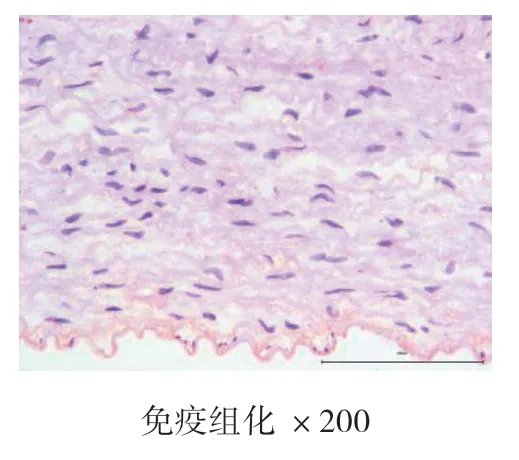
图7 空白对照组4周
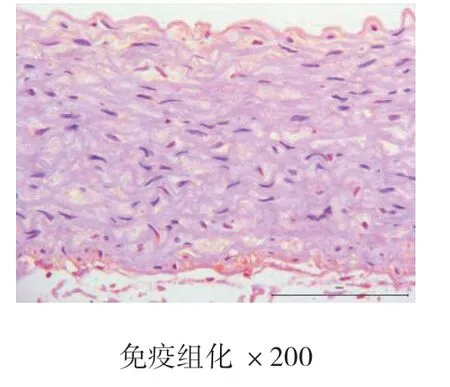
图8 空白对照组8周
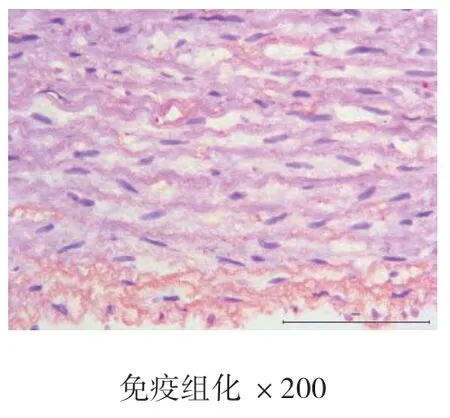
图9 空白对照组12周
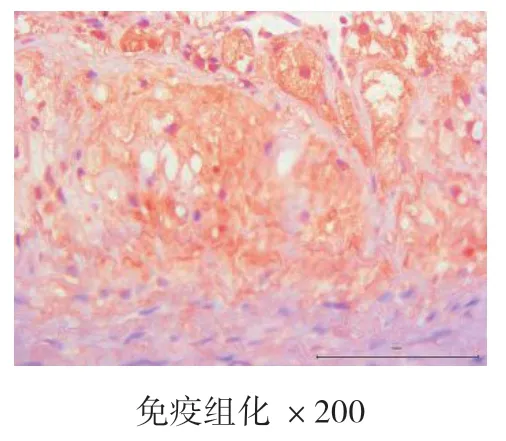
图10 高脂饮食组4周
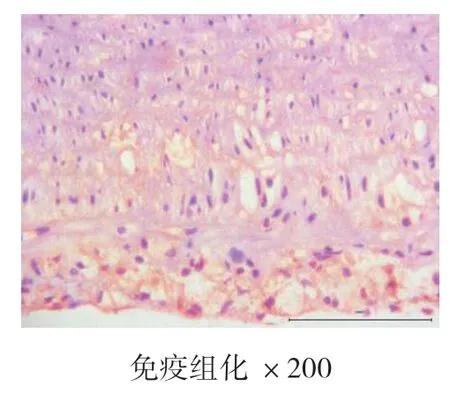
图11 高脂饮食组8周
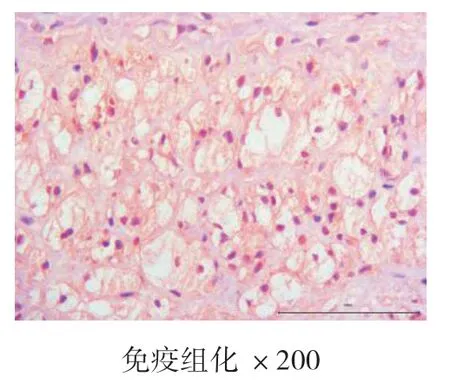
图12 高脂饮食组12周
讨 论
AS斑块内新生血管是指原有的毛细血管通过血管内皮细胞的增殖与迁移,从已存在的血管中以芽生或非芽生的形式生成新的毛细血管的过程[5],在AS的早期既有新生血管存在,斑块内新生血管管腔结构尚不成熟,发育不完善,仅由内皮细胞组成,无结缔组织支撑,多数新生血管管腔明显扩张,脆性大,容易发生破裂出血,使斑块体积增大,加重血管腔的狭窄程度[6-7]。滋养血管继续延伸扩大使斑块内出血的可能性增加。另一方面,AS斑块内新生血管的形成为炎性细胞进入斑块的提供通道,炎性细胞激活斑块肩部的巨噬细胞,促使它们分泌MMP或胶原酶,消化对斑块稳定性有保护作用的纤维帽,纤维帽更加薄弱。从而导致斑块出现裂隙、破裂随之血小板黏附、聚集、血栓形成引起急性冠脉综合征[8]。同时炎性细胞及其炎性产物使AS斑块脂质中心的扩大,纤维组织完整性被破坏,胞外基质降解,这些都增加了斑块破裂的可能。也有研究证实:斑块内新生血管的检出率随着AS病变的进展而逐渐增加[9]。并且病理分析显示这类新生血管周围常伴有新鲜出血或含铁血黄素沉积,表面病灶局部常有出血吸收的发生[10]。因此新生血管和AS斑块稳定密切相关,斑块内血管新生是粥样斑块发展进程中的重要伴随现象,斑块不稳定与斑块内新生血管破裂出血有关,抑制斑块内血管新生可以增强斑块的稳定性[11]。斑块内新生血管和低氧环境、炎性反应、血管生长因子、脂质代谢、吸烟等因素相关[12]。研究表明,脂质代谢中HDL-C及LDL-C异常会影响斑块内血管的生成[13],低氧环境下,HDL-C诱导斑块内新生血管生成;在正常氧浓度时,LDL-C促进斑块内新生血管生成。低氧环境时,HDL-C可增强缺氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)通路,维持了HIF-1α的稳定性,HIF-1α通过VEGF、一氧化氮和活性氧3种途径引起内皮细胞发生改变,诱导新生血管生成,促进了AS 的发展[14-15];正常氧浓度时,氧化型低密度脂蛋白在巨噬细胞中增加 HIF-1 和 VEGF 的表达,诱导血管内皮细胞增值,促进新生血管形成[16]。目前在研究新生血管时,常用的血管内皮标志物有CD34、CD31、CD105、CD146和vWF等。与其他血管内皮标志物比较,CD34的特异性及敏感性更高,便于观察。新生血管内皮细胞标志物CD34是一种高度糖基化I型跨膜蛋白,分子量为105-120KD,由阶段特异性白细胞分化,选择性地在人类造血干细胞、祖细胞和血管内皮细胞表面表达。研究表明[17],CD34为细胞间黏附及信号传导提供了条件,促使内皮细胞分裂。新生的细胞在CD34的参与下向血管外迁移黏附,构建成新生血管的骨架。CD34在新生血管内皮中的表达量远远大于非新生血管内皮中的表达量,利用CD34抗体进行免疫组化染色可以测量微血管密度,因此本实验将CD34作为AS斑块内新生血管的标志物标记新生血管的表达量。
本实验结果表明,在4周、8周、12周时,血脂检测结果显示,高脂饮食组与空白组相比,T-CHO、TG、LDL-C升高明显,HDL-C降低明显(P<0.05);与模型组对比,CD34的mRNA定量表达结果,高脂饮食组CD34的表达量>1,且增长明显(P<0.05);胸主动脉HE染色结果显示,空白对照组均未见AS病灶,为正常主动脉壁,内膜、中膜、外膜结构完整,动脉内壁光滑,无细胞增生,肌层厚度均匀,内膜下无泡沫细胞聚集,弹力纤维排列整齐,无断裂现象。高脂饮食组在4周时,动脉内膜改变,内膜下可见泡沫细胞聚集,内膜增厚,中膜和外膜结构完整,弹力纤维排列整齐,无断裂现象,为AS的脂纹期的病理改变。8周和12周时,动脉结构改变,内膜下可见大量泡沫细胞形成纤维斑块病变,大量泡沫细胞及胆固醇结晶形成AS期病灶,泡沫细胞极度膨大,呈圆形或者椭圆形,发生气球样改变,弹力纤维部分断裂,溶解,为AS的纤维斑块期,也说明AS家兔模型基本复制成功;免疫组化结果显示,在4周、8周、12周时,空白组主动脉均内膜光滑,无斑块形成,未见新生血管标记。高脂饮食组4周、8周、12周时均有内膜改变,CD34染色呈阳性表达,且随时间的推移,阳性表达逐渐增强,内膜下可见大量蓝紫色细胞核聚集,为CD34标记的新生血管,高脂饮食组的实验兔斑块内新生血管在不断生长。
综上所述,本实验成功地复制了AS家兔模型,空白对照组动脉结构完整,未检测出AS病灶,免疫组化未见标记新生血管的CD34染色表达;高脂饮食组随着AS病理病程的进展,所检出新生血管的量在逐步增加,新生血管内皮细胞标志物CD34阳性表达逐渐增强,证实了脂质代谢紊乱,LDL-C、HDL-C水平与斑块内新生血管相关,新生血管为AS进展过程中重要的伴随现象,AS斑块不稳定性与斑块内新生血管密切相关,且呈正相关性。

