miR-146a通过调节IPr1基因对结核分枝杆菌感染的AEC Ⅱ型细胞活性作用机制*
许明昭 林清香 寇昌伟 汪求真
(山东省公共卫生临床中心结核科,山东 济南 250100)
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染引起的。Mtb为细长略带弯曲的杆菌,大小1~4×0.4 μm,主要感染肺部以及淋巴系统,主要原因是由于肺部环境利于Mtb生存,也可感染机体其他器官,如脑、关节、中枢神经等[1]。Mtb分为牛型、鸟型、人型等,人型和牛型Mtb的基因具有99.95%同源性,很容易交叉感染而致病。由于Mtb的致病机理十分复杂,尤其是近年来多耐药结核菌的出现,给结核病的防治带来很大的困难。因此,只有从感染机制和发病机理上进行深入研究,才能为结核病的检测和防控提供有效的途径。肺泡Ⅱ型上皮细胞(Type 2 alveolar epithelial cells,AEC Ⅱ)是“物理屏障”,同肺泡巨噬细胞一起在机体对抗Mtb感染中发挥着重要的免疫调控功能,微小RNA(microRNA,miRNA)作为一种内源性具有调控功能的非编码RNA,在机体发育、生理和病理发生过程中有着重要的调控功能[2]。miRNA可以影响宿主抵抗Mtb的感染过程,其异常表达也与结核病的发生密切相关。2005年已有相关人员在结核超易感基因座1(Super susceptibility to tubercu-losis 1,sst1)中发现了胞内病原体抗性基因1(Intracel-lular pathogen resistance 1,Ipr1),又称SP110,同时证实了Ipr1可通过调控巨噬细胞抵抗Mtb的感染[3]。但目前鲜有miR-146a对Ipr1治疗肺结核的具体作用机制研究。因此,本研究旨在探讨miR-146a通过调节IPr1基因观察对Mtb感染的AECⅡ型细胞活性作用。
1 材料与方法
1.1 细胞株来源 AECⅡ细胞购自上海泽叶生物科技有限公司。Mtb标准株(H37Rv)由北京结核病胸部肿瘤研究所提供。
1.2 主要试剂与仪器 流式细胞仪(上海三崴医疗设备公司,型号:FACSVia);miR-146a、Ipr1引物序列(赫澎生物科技公司,上海);PCR仪(济南来宝医疗器械公司,型号:Lebqen-96型);CCK8溶液(北京百奥莱博生物科技有限公司)。
1.3 H37Rv株感染AECⅡ细胞模型的建立 参照文献[4]建立模型:选取H37Rv株,于37 ℃恒温培养,直至培养基由红变黄,H37Rv浓度为l×l06ccu/mL。将生长状态良好的人AECⅡ细胞以1×105个/mL接种于60 mm细胞培养皿中,于37 ℃、5% CO2培养48 h,待细胞融合度达75%左右时,利用H37Rv株感染细胞24 h,感染复数(MOI)为10。利用DIO对H37Rv细胞膜进行荧光染色,然后利用免疫荧光技术鉴定人AECⅡ细胞的感染状况。
1.4 细胞转染及分组 将细胞分为结核组(感染Mtb)、 NC组(转染miR-146a NC)、转染组(模型+转染miR-146a)。PBS清洗NC组与转染组细胞,胰酶消化后离心,将细胞接种于6孔板中,待细胞融合至75%时,将Lipofeetamine 2000按3 μL/L稀释,孵育20 min后,无血清培养基分别将miR-146a mimics和miR-146a NC按50 μmoL/L稀释,孵育5 min后,与Lipofectamine 2000等体积混匀,分别加入两组细胞中继续培养,12 h后将无血清培养基更换为完全培养基,继续培养48 h。
1.5 检测指标
1.5.1 RT-PCR检测miR-146a、Ipr1基因表达 取各组细胞,胰蛋白酶消化后提取细胞悬液,冲洗,放于无菌试管中。TRIzol法提取总RNA,Primer 5.0 软件设计合成引物。 将逆转后所得的cDNA进行荧光反应实验。所有反应严格按照反应的条件进行扩增,PCR 反应条件: 95 ℃ 30 s、 95 ℃ 5 s 、60 ℃ 15 s、72 ℃ 15 s。取PCR产物(20 μL)进行电泳分析(琼脂糖凝胶1.5%),以β-actin为内参,共40个循环,取得到的平均值后得到Ct值,计算方法用2-△△Ct法进行分析,引物序列见表1。

表1 引物序列
1.5.2 CCK8检测细胞增殖 取各组细胞,离心5 min,1 250 r/min,制成细胞悬液,接种于96孔板中(1×104个细胞)。分别于细胞贴壁后24、48、72 h加入CCK-8试剂,避光孵育3 h。酶标仪检测450 nm处OD值。
1.5.3 流式细胞仪检测细胞凋亡 取各组细胞接种于6孔板中,胰酶消化,配成密度为1×105/mL 的细胞液,PBS清洗,换用ECM培养基培养24 h,离心5 min(1 250 r/min),弃上清,混入500 μL Binding Buffer(结合缓冲液) 重悬,加入 5 μL Annexin V-FITC混匀、10 μL PI混匀,常规孵育15 min后,进行流式细胞仪检测。
1.5.4 双荧光素酶报告 将融合至80%的Mtb感染的AECⅡ细胞接种于6孔板中,按照LipofectamineTM2000说明将Ipr1-3′-UTR-WT、Ipr1-3′-UTR-MUT质粒转染miR-146a(NC组),miR-146a lifescience(miR-146a组)共转染至细胞,按照说明检测。

2 结果
2.1 Mtb感染AECⅡ细胞模型的建立 本研究采用荧光法检验Mtb在细胞中的分布情况。激光共聚焦显示,DIO荧光染色的Mtb在感染人AECⅡ细胞12 h内会进入细胞质基质中,并围绕细胞核分布(图1),表明Mtb感染模型建立成功。

图1 荧光染色(200×)
2.2 AECⅡ细胞中miR-146a、Ipr1基因表达 结核组与NC组AECⅡ细胞中miR-146a、Ipr1基因表达比较无差异(P>0.05);与NC组相比,转染组AECⅡ细胞中miR-146a、Ipr1基因表达水平升高(P<0.05)。见表2。

表2 各组AECⅡ细胞miR-146a、Ipr1基因表达比较
2.3 AECⅡ细胞增殖情况 结核组与NC组AECⅡ细胞在不同时间点的OD值比较均无差异(P>0.05);与NC组相比,转染组AECⅡ细胞在不同时间点的OD值均升高(P<0.05)。见表3。

表3 各组AECⅡ细胞OD值比较
2.4 AECⅡ细胞凋亡情况 结核组AECⅡ细胞凋亡率(56.24±6.31)%与NC组AECⅡ细胞凋亡率(55.06±6.17)%相比无差异(t=0.050,P=0.961);与NC组相比,转染组AECⅡ细胞凋亡率(18.15±1.73)%显著降低(t=14.110,P<0.001)。见图2。
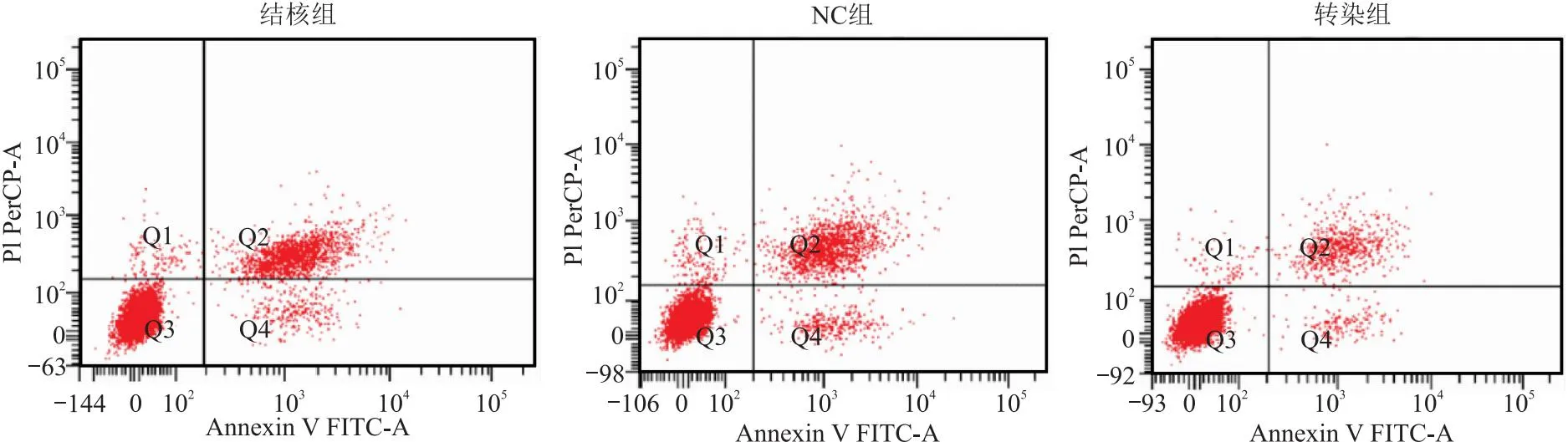
图2 各组 AECⅡ细胞凋亡情况
2.5 双荧光素酶报告 双荧光素酶报告结果显示,转染miR-146a后野生型Mtb感染的AECⅡ细胞中Ipr1活性升高(P<0.05),突变型Mtb感染的AECⅡ细胞中Ipr1活性无明显变化(P>0.05),表明Ipr1是miR-146a的靶基因,见表4。
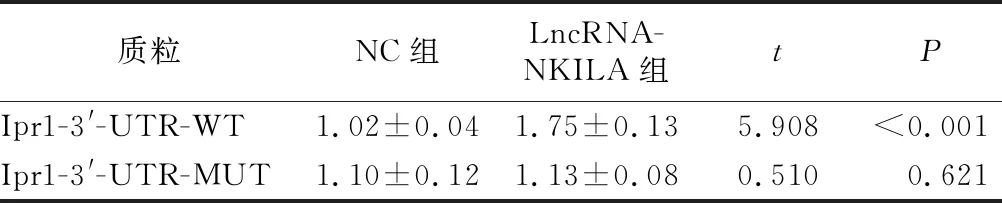
表4 双荧光素酶报告
3 讨论
相关报道显示[5],在世界范围内,每年新增肺结核患者近1 000万人,其中有近200万人死于该病。目前,我国肺结核年发病人数约为130万,位居全球第2位,并且在以畜牧业为主的我国西部地区和农村,感染和发病情况更为严重[6]。有关研究发现[7],miRNA对肺结核的治疗具有一定作用。
miRNA作为一种具有调控功能的内源性非编码RNA,在机体的发育、生理和病理发生过程中有着重要的调控功能。然而,在细菌感染miRNA的作用是比较少探索区域,但最近的发现细菌感染有许多miRNA参与调节或扰乱机体的免疫应答[8]。研究证实[9]miRNA在Mtb感染宿主细胞的免疫应答中发挥着重要的调控作用,如Mtb强毒株活菌或其脂甘露聚糖感染人巨噬细胞,导致miR-125b的高表达和miR-155的低表达,抑制了丝裂原活化蛋白激酶2的活化,从而抑制了巨噬细胞TNF的合成,破坏了宿主免疫系统,增加了其感染潜力,这一过程也受到miRNA的调控。miR-146a是近年来研究比较前沿和广泛的miRNA。miR-146a主要作为一种抑制炎症的因子参与免疫调节。miR-146a是结核病患者中低表达的miRNA之一,通过抑制细胞因子TNF-α等的产生来发挥可能的抗结核免疫作用[10]。本研究发现miR-146a在Mtb感染的AECⅡ细胞中低表达,miRNA腺病毒过表达载体是miRNA过表达研究的常用技术之一,为了深入研究miR-146a在AECⅡ细胞抗Mtb的免疫调控作用,构建了miR-146a的腺病毒过表达载体,利用miR-146a转染至Mtb毒株感染AECⅡ细胞模型中,发现miR-146a在Mtb感染的AECⅡ细胞中低表达,在经过转染后,AECⅡ细胞增殖增加,凋亡减少,表明其参与了AECⅡ细胞抗Mtb感染过程。程龙等[11]研究发现,AECⅡ细胞抗Mtb感染过程中,miR-146a负调控TLRs信号通路中MyD88、TRAF6、NF-κB和IL-6等来调控AECⅡ细胞对Mtb的感染过程。陈辉国等[12]研究发现,在肺癌中,miR-146a可调控肺癌细胞的增殖与凋亡。本研究与上述研究结果相似,因此认为转染高表达的miR-146a可调控AECⅡ细胞的活性,从而达到抗Mtb的作用。
Ipr1基因是新近发现的与小鼠结核病易感性相关的基因,在转基因动物水平及体外细胞水平观察到该基因的表达可以增强巨噬细胞抗分枝杆菌等胞内病原体的能力[13-14]。Ipr1基因含有 SP100 基序、染色质结合域、核定位信号及细胞核激素受体结合域,并发现其表达受干扰素的调节,因此推测Ipr1基因编码蛋白可能通过参与干扰素信号途径、核激素受体途径等诱导的巨噬细胞活化、基因表达及细胞死亡[15-16]。另有研究证实[17],Ipr1 通过多种机制介导巨噬细胞抗结核。正常情况下,巨噬细胞中Ipr1 低水平表达,Mtb或其他因子诱导Ipr1表达上调。Ipr1与内质网分子伴侣相互作用介导细胞凋亡途径,导致细胞凋亡;另一方面,Ipr调控与免疫和细胞凋亡相关的miRNA表达,也能导致细胞凋亡、Mtb清除[18-19]。本研究发现,Ipr1在Mtb感染的AECⅡ细胞中为低表达,在经过转染高表达的miR-146a后,Ipr1水平升高,同时增殖增加,凋亡减少。吴勇延等[20]研究已经证实,Ipr1调控与免疫和细胞凋亡相关的miRNA表达,如miR-146a、miR-155等,起始或促进细胞凋亡和胞内Mtb清除。本研究与上述研究结果相似,同时本研究双荧光素酶报告结果也显示,Ipr1是miR-146a的靶基因,因此本研究认为,转染高表达的miR-146a后,通过提高Ipr1水平,调控细胞的增殖与凋亡,发挥抗Mtb的作用。
4 结论
过表达的miR-146a可增加Mtb感染的AECⅡ细胞活性,降低凋亡,研究机制认为可能与通过激活Ipr1水平相关。Ipr1是miR-146a靶基因,可通过激活表达而发挥减少Mtb对AECⅡ细胞活性的损伤。

