乳酸菌发酵西兰花的代谢组学分析及其对萝卜硫素含量的影响
侯菲翔,蔡燕雪,肖珊,王波,陈璇,王际辉*
1(大连工业大学 生物工程学院,辽宁 大连,116034)2(东莞理工学院 生命健康技术学院,广东 东莞,523808)
西兰花(Brassicaoleraceavar.italica)属于十字花科植物中的芸薹属甘蓝种,也称绿花菜、青花菜等[1],因营养价值很高,被誉为“蔬菜之王”。原产于欧洲地中海意大利一带,19世纪末传入中国,现已成为我国消费者喜爱的蔬菜之一。西兰花中还富含多种生物活性成分(如多酚类化合物、类黄酮、异硫氰酸盐等),因此具有较强的抗氧化活力[2]。
由于代谢组学可发现样品间的细微差别,故可对乳酸菌发酵食品的成分进行定性或定量分析。目前,关于非靶向代谢组学应用于硒酸盐处理西兰花芽[3]、环境光亮对西兰花代谢组学的影响[4]、西兰花小花创伤应激的分子机制[5]均有报道,但关于非靶向代谢组学研究乳酸菌发酵西兰花前后组分变化情况仍不明晰。
萝卜硫素(sulforaphane)是一种异硫氰酸盐,是最有前景的具有抗癌活性的天然植物活性物质之一[6],萝卜硫素可以激活醌还原酶或谷胱甘肽硫转移酶等II型解毒酶,达到失活部分致癌基因的效果,最终发挥抗癌作用[7],同时萝卜硫素也具备较强的抗氧化、抗肥胖、抗糖尿病等活性[8]。
在完整的西兰花组织中,硫代葡萄糖苷与黑芥子酶被严格分开,只有组织细胞被破坏时才会相互接触,因此萝卜硫素等异硫氰酸盐的生成对于植物来说是一种主动的防御机制,所产生的植物次级代谢产物对破坏其细胞正常结构的动物或病菌等都能够产生一定的生理毒性[9]。阻碍萝卜硫素生成的主要原因有:(1)传统烹饪及冷冻对西兰花内黑芥子酶的热失活;(2)表皮特异硫蛋白(epithiospecifier protein,ESP)的存在使得生西兰花中硫代葡萄糖苷降解后更加倾向于转向生物活性很低的萝卜硫素腈;(3)萝卜硫素本身不稳定且受热易降解[10]。
针对这些问题,前人主要提出两种思路:一种是在西兰花育苗时提高前体物硫代葡萄糖苷的含量,进而增加萝卜硫素的转化量,如使用富硒肥、盐离子、光照等外源性胁迫方式[11];另一种是在加工过程中改变酶活或添加保护剂等以减少萝卜硫素的降解,提高其稳定性[12]。虽然它们都在一定程度上被动地保留了萝卜硫素的含量,但仍然存在无法主动促进西兰花生成更多萝卜硫素的局限性。
本研究从西兰花中筛选内源乳酸菌对西兰花泥进行发酵,并对发酵前后西兰花的基本营养指标进行测定,通过非靶向代谢组学技术,研究了代谢产物的种类和丰度并筛选出显著性差异代谢物,最后分析了乳酸菌发酵对萝卜硫素含量的影响。本课题的开展为明确乳酸菌发酵西兰花过程中的组分变化情况及其在新型功能性食品领域的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
西兰花选购于东莞市农贸市场,经鉴定品种为Brassicaoleraceavar.italica。MRS(de Man, Rogosa, and Sharpe)肉汤培养基、MRS琼脂培养基,广东环凯微生物科技有限公司;细菌基因组DNA提取试剂盒,北京索莱宝科技有限公司;BCA蛋白浓度检测试剂盒,上海碧云天生物技术有限公司;3,5-二硝基水杨酸,上海源叶生物科技有限公司;萝卜硫素标准品(≥90%,HPLC)、甲醇、乙酸胺、甲酸、甲醇、乙腈,美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
ZQZY-78BV培养箱,上海知楚仪器有限公司;Spark酶标仪,瑞士TECAN有限公司;PB9590破壁机,中国奥克斯集团有限公司;AB Triple TOF 6600质谱仪,美国AB SCIEX公司;ACQUITY UPLC BEH C18色谱柱,美国Waters公司;CV200冷冻浓缩机,北京艾吉姆科技有限公司;Agilent 1250 Infinity II高效液相色谱,美国Agilent公司。
1.3 实验方法
1.3.1 西兰花内源乳酸菌的筛选
乳酸菌的筛选参考文献[13],取西兰花的花顶2 cm部分切出并收集100 g,加入到250 mL灭菌MRS肉汤培养基中,于37 ℃下孵育24 h。完成后取适量按10倍稀释法稀释至10-5CFU/g,取200 μL稀释液转移至灭菌MRS琼脂培养基中并于37 ℃下孵育24 h。取平板上10个单菌落在另一灭菌MRS琼脂培养基上划线培养,分别对其命名为BrocLAB1-BrocLAB10,重复2次后得到纯种菌并冻藏。
1.3.2 菌种鉴定
将菌液进行细胞破碎,随后提取菌种基因组DNA并送至广东美格基因科技有限公司进行菌种鉴定。PCR扩增目的片段后使用引物8F和16SR对片段进行Sanger测序并拼接。拼接好后的序列与NCBI的NT库进行BLAST比对。
1.3.3 西兰花发酵
取西兰花的花顶2 cm部分,按每300 g西兰花加入200 mL灭菌水的比例加入破壁机破壁75 s,取出西兰花泥并混匀。取250 g西兰花泥于250 mL蓝盖试剂瓶中,加入选定菌种菌液使其浓度为108CFU/g,分别发酵0、12、24、36、48、60 h后立即停止,随机分装至透明真空袋后分别于4、-20和-80 ℃下贮存。
1.3.4 总蛋白含量
总蛋白含量使用BCA蛋白浓度测定试剂盒(增强型)完成。停止发酵后取2 mg发酵西兰花冻干粉溶解于1 mL体积分数为80%甲醇得到2 mg/mL 悬浊液,700 r/min下振荡20 min后取20 μL上清液与200 μL BCA工作液于37 ℃下反应20 min。随后在酶标仪内562 nm波长处观察吸光值。以牛血清蛋白(bovine serum albumin, BSA)为标准品绘制标准曲线y=0.913 8x+0.092 4,R2=0.998 4,结果表示为BSA当量(mg BSA/g DW)。
1.3.5 总还原糖含量
总还原糖的测定方法为3,5-二硝基水杨酸法并在前人的研究方法[14]基础上加以修改。停止发酵后取5 mg发酵西兰花冻干粉溶解于1 mL 80%甲醇得到5 mg/mL悬浊液,700 r/min振荡20 min后取200 μL上清液与200 μL DNS试剂混合并沸水浴加热5 min,随后将其稀释至原来的1/10并在酶标仪内观察波长540 nm处吸光值。以葡萄糖为标准品绘制标准曲线y=0.360 7x+0.051 2,R2=0.998 9,结果表示为葡萄糖当量(mg Glucose/g DW)。
1.3.6 非靶向代谢组学
未发酵和发酵48 h的西兰花样品送至上海中科新生命生物科技有限公司进行非靶向植物代谢组学分析。具体检测步骤参考文献[15]如下:发酵西兰花样品在4 ℃条件下解冻,随后选取不同处理组发酵西兰花样品至预冷的溶剂中[V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1],涡旋混匀后在4 ℃下超声波30 min,随后在-20 ℃下静置20 min后离心(10 000 r/min、4 ℃、20 min),上清液干燥后备用。分析时使用100 μL溶液[V(乙腈)∶V(水)=1∶1]涡旋复溶并离心(10 000 r/min、4 ℃、15 min),上清液进样。
色谱分析使用C18色谱柱分离,柱温40 ℃,流速0.4 mL/min,进样量2 μL,流动相A:25 mmol/L乙酸胺+体积分数为0.5%甲酸的水溶液,流动相B:甲醇。梯度洗脱程序如下:0~0.5 min,5% B;0.5~10.0 min,5%~100% B;10.0~12.0 min 100% B;12.0~ 12.1 min,100%~5% B;12.1~16.0 min 5% B。随机顺序自动连续进样,环境温度4 ℃。
西兰花样品一级和二级质谱的采集和分析通过质谱仪参考文献[15]进行。ESI源分离条件如下:Ion Source Gas1 60,Ion Source Gas2 60,Curtain gas(CUR)30,样本温度600 ℃,IonSapary Voltage Floating(ISVF)±5 500 V(正负两种模式),TOF MSm/z扫描范围60~1 000 Da,产物离子m/z扫描范围25~1 000 Da,TOF MS扫描累积时间0.20 s/spectra,产物离子扫描累积时间0.05 s/spectra。二级质谱采用数据依赖型采集(information dependent acquisition,IDA)获得,并且采用高灵敏度模式,去族电压为±60 V(正负两种模式),裂解电压为(35±15) eV。IDA设置如下:Exclude isotopes within 4 Da,Candidate ions to monitor per cycle为10。
通过使用ProteoWizard和MSDAIL软件,将原始数据由RAW格式转换为mz XML格式、对齐峰位置、校正保留时间并提取峰面积,随后依次进行结构鉴定、数据预处理、数据质量评价和分析。
1.3.7 萝卜硫素含量
参考文献[13]的方法。取5 g发酵西兰花,与5 mL去离子水振荡混合并超声波处理5 min,加入20 mL乙酸乙酯,于4 ℃、8 000 r/min下离心10 min,收集上清液后向沉淀再加入15 mL乙酸乙酯再离心,收集上清液于室温下冷冻浓缩。完成后加入250 μL体积分数为30%的乙腈,过0.22 μm有机尼龙微孔滤膜并加入到带衬管的2 mL棕色色谱进样瓶中待测。
色谱分析采用C18色谱柱分离,柱温30 ℃,流速0.3 mL/min,进样量5 μL,流动相A:0.1%甲酸溶液,流动相B:0.1%甲酸乙腈溶液,等度洗脱程序为0.0~10.0 min,20% B。
1.3.8 数据处理
所有实验数据为重复实验平均值,至少3次重复,单因素方差分析使用SPSS 27.0软件,均值比较测试方法为LSD并通过Waller-Duncan进行显著性分析,不同字母表示差异显著(P<0.05),所有数据由OriginPro 2023进行作图,实验结果通过平均值±标准差表示。
2 结果与分析
2.1 菌种筛选与西兰花发酵产品特性
前期通过对西兰花内生菌筛选,共选出10株西兰花内源乳酸菌进行16S rDNA片段扩增测序,并在NCBI上进行BLAST比对。物种注释鉴定结果:BrocLAB1、BrocLAB3~9为植物乳杆菌(Lactiplantibacillusplantarum),BrocLAB2~4、BrocLAB10则为戊糖乳杆菌(Lactiplantibacilluspentosus)。进一步根据生长曲线、产酸与耐酸曲线,最终在两种物种各挑1株优良菌种,BrocLAB1和BrocLAB10来进行后续发酵实验(表1)。

表1 筛选的西兰花内源乳酸菌的物种注释结果Table 1 Species annotation of selected endogenous lactic acid bacteria in broccoli
2.2 总蛋白与总还原糖含量
西兰花发酵过程中的总蛋白含量变化如图1所示,未发酵的西兰花样品总蛋白含量为(96.1±13.6) mg BSA/g DW。随着发酵时间的增加,西兰花总蛋白含量略有下降,但整体呈波动状态,特别在发酵60 h后为(82.6±8.7) mg BSA/g DW,发酵前后总蛋白含量整体变化不明显(P>0.05)。
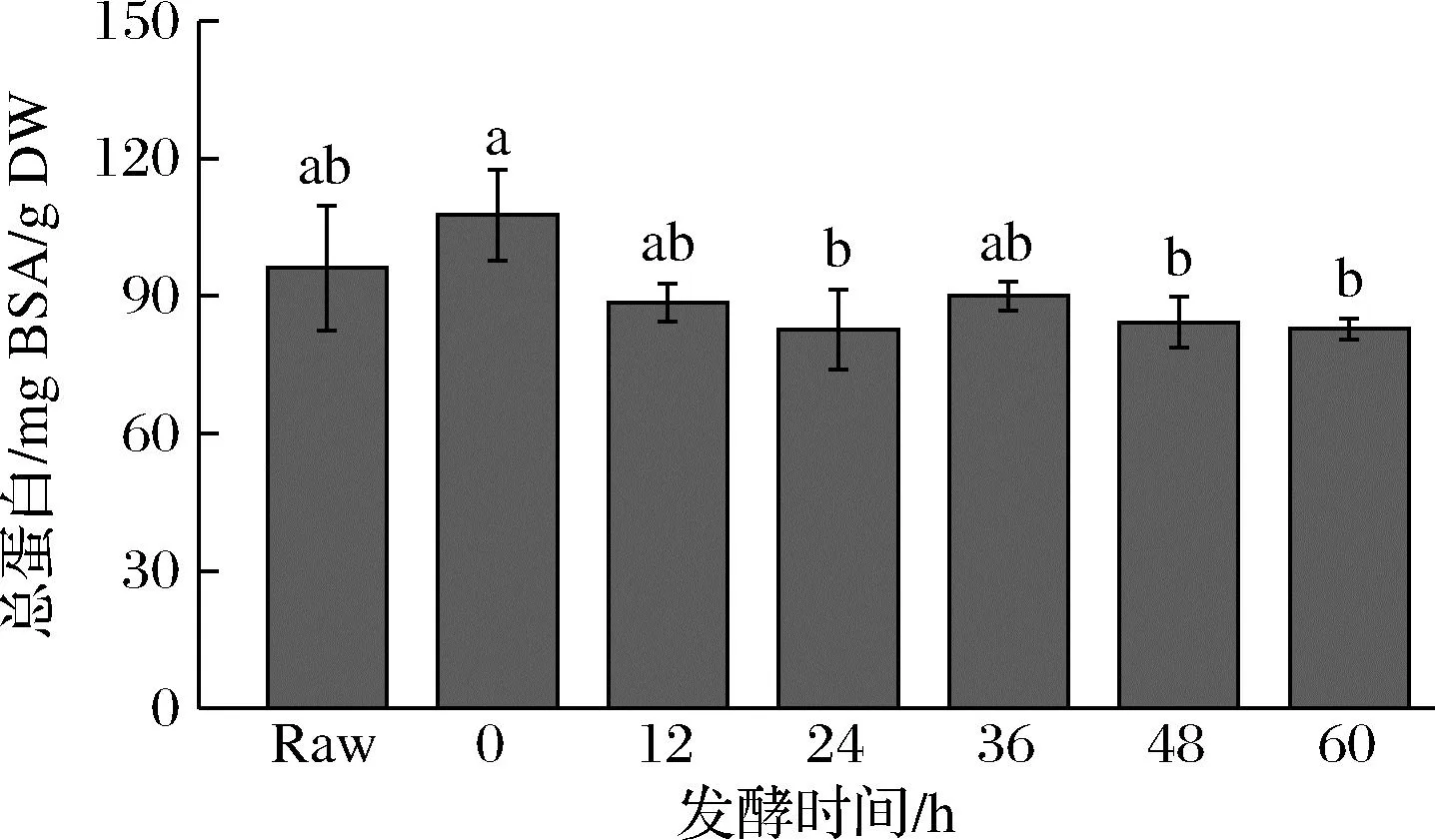
图1 发酵后西兰花总蛋白含量的变化Fig.1 Changes in total protein content of broccoli after fermentation
进一步研究发酵前后西兰花总还原糖含量变化,如图2所示。发酵前西兰花的总还原糖含量为(180.0±16.2) mg Glucose/g DW,与文献报道结果一致[16]。发酵后,西兰花样品的总还原糖含量显著下降,这可能是因为还原糖被用于乳酸菌的生长和乳酸的生成[17]。可以观察到发酵24 h后总还原糖含量急剧下降至(57.6±4.8) mg Glucose/g DW,而在48 h后又缓慢降至(51.6±5.9) mg Glucose/g DW,这说明乳酸菌只在最开始的24 h内迅速消耗糖类物质。
2.3 代谢组学鉴定与差异分析
非靶向代谢组学能对样本中各类代谢物进行分析,测定各代谢物的含量、表征代谢物分子的表现型并对比不同样品组间的概况[3],能有效体现出生物体内的代谢水平。通过匹配数据库中代谢物的基本信息,包括分子质量、保留时间以及二级碎裂谱图,对西兰花样品代谢物结构进行鉴定,等级均在Level 2以内。发酵西兰花样品中共鉴定出977种代谢物,其中正离子模式鉴定到的代谢物589种,负离子模式388种。合并正离子模式和负离子模式下的所有代谢产物,并统计其分类后发现占比最高的前3个分别是脂质和脂类化合物、有机酸及其衍生物、有机杂环化合物(表2)。同样有研究发现,通过戊糖片球菌发酵西兰花汁后有49.47%的非挥发性代谢物被分类为脂质和脂类化合物分子[18]。
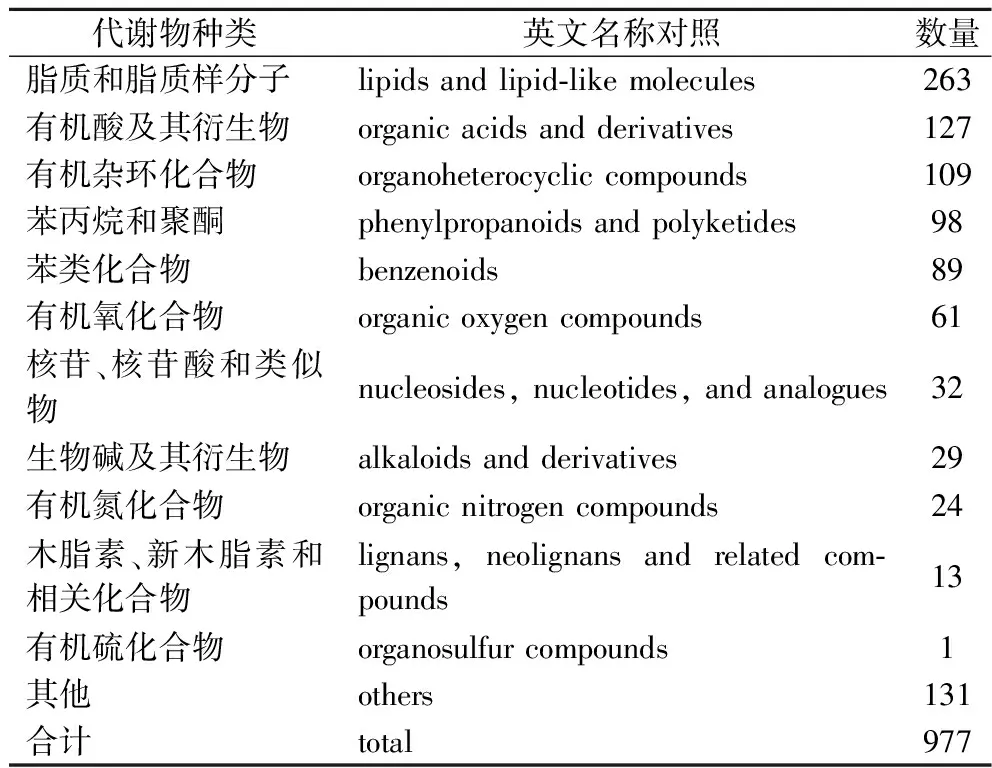
表2 正、负离子模式下鉴定到的发酵西兰花 样品中的代谢物分类Table 2 Metabolite classification identified in fermented broccoli samples in positive and negative ion modes.
单变量统计分析结合多维统计分析是代谢组最常使用的一种组间显著性差异代谢物的筛选方法。对西兰花样品中基于单变量统计分析方法检测到的所有代谢产物进行差异性分析,差异改变倍数(Fold Change,FC)取log2,采用火山图的形式按照FC>1.5或FC<0.67,P<0.05的标准筛选差异代谢物,结果显示,与Raw相比,发酵48 h后的西兰花内共鉴定出327个下调代谢物和162个上调代谢物,结果如图3-a所示。进一步对发酵西兰花组间进行正交偏最小二乘分析。每个分析模型均通过了置换检验且Q2>5,选取变量权重值大于1、P<0.05的差异代谢物为显著性差异代谢物,如图3-b所示。从结果可以发现,在所有的上调代谢物中,具有显著性差异代谢物有山梨醇、L-3-苯基乳酸、3-(4-羟基-3-甲氧基苯基)丙酸、丙氨酰苯丙氨酸、新绿原酸、山柰酚、L-乳酸、色氨酸、琥珀酸等;多次出现的下调显著性差异代谢物有L-苹果酸、泛糖苷、鸟苷、葡萄糖酸、尿苷、古龙酸、D-葡萄糖等。山梨醇被发现能提高蔬菜的货架期[19]并发现发酵后显著上调。L-乳酸则是乳酸菌的主要产物,有报道指出乳酸菌能消耗大量苹果酸并生成乳酸[20],结果发现发酵后L-乳酸上调,而L-苹果酸为下调。山萘酚具有抗氧化和抗炎的效果[21],并发现发酵后为上调的显著性差异代谢物。有报道指出古龙酸是西兰花中的一种酚酸类化合物[22],并发现它在发酵后下调,这与文献报道的结果相符[23]。
对显著性差异代谢物进行层次聚类分析并绘制热图,其结果如图3-c所示,图中不同色块颜色表示对应代谢物的相对表达量,聚在不同簇内的代谢物具有不同的表达模式,这可能由于西兰花在发酵前后,乳酸菌的发酵作用导致部分功能差异化,进而激发了不同的代谢过程或细胞通路,最终引起代谢产物的差异。
为了进一步直观地体现出各代谢产物的转换关系,图3-d展示了相关性系数|r|>0.8且P<0.05的代谢物分子对。图中外圈上不同颜色的短弧线分别表示代谢产物所属化学分类,内圈起点代表各显著性差异代谢物的种类和数量,相连接的线条表示各个代谢物之间的转换关系相关性。从结果可以发现,相较于未发酵的西兰花样品,经过乳酸菌发酵后的部分代谢产物产生了显著的转化情况,这充分说明发酵过程对于西兰花的代谢途径具有明显的改变作用,这种改变可以促进具有功能性的小分子产生更高的表达,赋予发酵食品更多的功能特性。
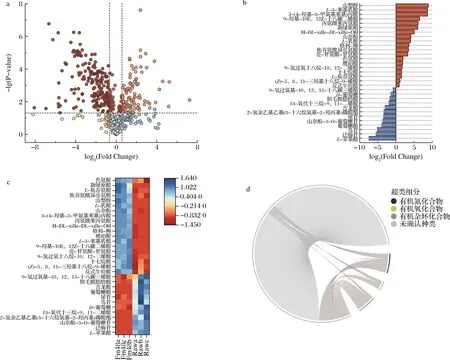
a-代谢产物火山图;b-显著性差异种类;c-聚类分析;d-代谢产物转换情况
2.4 萝卜硫素含量
根据萝卜硫素检测标准曲线(y=8.862 5x+8 865.8,R2=0.988 0),分别测定未发酵西兰花的萝卜硫素含量为(869.1±56.1) μg/mL,这个结果略高于文献报道的(724.61±8.24) μg/mL[24],这可能是品种的差异造成的。西兰花样品发酵48 h后含量为(1 768.9±12.9) μg/mL,含量显著提高到未发酵样品的203.53%(P<0.01)。萝卜硫素是硫代葡萄糖苷的分解产物,推测萝卜硫素含量的增加可能是由于西兰花在乳酸菌发酵过程中萝卜硫素转化率的提高所致。硫代葡萄糖苷根据反应条件和其结构,经历复杂的酶促和非酶促反应转化为各种产物。在黑芥子酶作用下,硫代葡萄糖苷解离生成葡萄糖和不稳定的糖苷配基,随后发生Lossen重排反应分别生成异硫氰酸酯、腈类和其他降解产物[25]。乳酸菌发酵过程中,环境pH值由于乳酸的产生导致下降,这可能是有利于萝卜硫素产量提高的一个原因[25]。此外,也可能由于内源微生物细胞壁降解酶的作用,在非发酵组织中不能正常反应的硫代葡萄糖苷得以释放最终转化为萝卜硫素[13]。
3 结论
本研究利用内源乳酸菌对西兰花泥进行发酵,对比了发酵前后基本营养指标,结果发现蛋白质含量基本不变,总还原糖含量显著下降;使用非靶向代谢组学技术,共鉴定出977种代谢物,其中代谢物化学分类占比最高的为脂质和脂类化合物,明确了发酵对西兰花代谢产物丰度的影响;最后测定西兰花中萝卜硫素在乳酸菌发酵后显著提高至未发酵样品的2倍。本研究的开展为拓展西兰花发酵产品在功能性食品中的开发应用提供参考。

